
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон сохранения энергии в термодинамикеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Закон сохранения энергии сыграл решающую роль в создании новой научной теории – термодинамики. Опираясь на этот закон, был сделан ряд открытий в области электродинамики. У Томсон, используя закон сохранения и превращения энергии при исследованиях явления электромагнитной индукции и самоиндукции, установил при этом, что энергия проводника с током может быть выражена формулой LI2 /2, где I –ток, a L – коэффициент самоиндукции — величина, зависящая только от геометрии проводника. Исследуя вопрос об энергии магнитов и электрических токов, У. Томсон в 1853 г. выразил эту энергию в виде интеграла, взятого по объему. В том же году Р. Клаузиус применил закон сохранения энергии к энергетическим процессам в цепи постоянного тока, а в следующем году – к термоэлектрическим явлениям. Помимо У. Томсона и Р. Клаузиуса над развитием и применением закона сохранения и превращения энергии много работал У. Дж. М. Ранкин. Он первым начал широко применять термин «энергия» и попытался дать этому понятию общее определение. Под энергией системы вслед за Ранкиным стали понимать ее способность производить работу. Ранкин писал: Термин «энергия» предполагает любое состояние субстанции, которое заключается в способности производить работу; количество энергии измеряется количеством работы, которую она способна произвести. Еще раньше, Ранкин разделил энергию на «актуальную», или «ощутимую», и «потенциальную», или «скрытую». К «ощутимой» энергии он относил «живую силу» (термин, широко используемый в более ранних работах многих ученых, начиная с Лейбница), теплоту, лучистую теплоту, свет, химическое действие и электрический ток, которые являются ее различными формами; к «потенциальной», или «скрытой», – «механическую силу гравитации», упругость, химическое сродство, энергию статического электричества и магнетизма. У. Томсон для «актуальной», или «ощутимой», механической энергии ввел впоследствии понятие кинетической энергии движущихся тел. Благодаря этим трем великим открытиям, – писал он, – мы можем теперь в общем и в целом обнаружить не только ту связь, которая существует между процессами природы в отдельных ее областях, но также и ту, которая имеется между этими отдельными областями.
Принцип возрастания энтропии Понятие энтропии
Понятие энтропии исторически возникло при рассмотрении и изучении тепловых процессов и создании термодинамики. К моменту зарождения термодинамики в естествознании господствовала механика Ньютона, механика обратимых процессов, которые могут идти как в прямом, так и в обратном направлении с так называемым обратимым временем. Например, вращающееся тело проходит при движении одни и те же положения при вращении по часовой стрелке, а затем и против часовой стрелки. Или другой пример: в принципе возможны все механические движения, показанные на кинопленке, при ее прокручивании как в прямом, так и в обратном направлении. В термодинамике в этом отношении все обстоит иначе. Французский математик и физик Ж.Б. Фурье установил один из основных законов теплопроводности – односторонний переход теплоты от более нагретого тела к менее нагретому. Именно с этого момента начался выход физики за пределы ньютоновой схемы. При переходе теплоты от более горячего тела к более холодному температуры тел постепенно (т.е. во времени!) выравниваются и становятся едиными для обоих тел – наступает состояние термодинамического равновесия. Таким образом, все системы, содержащие различные тела с разной температурой, естественным образом постепенно переходят в состояние термодинамического равновесия свыровненной температурой во всех участках данной системы. Такие процессы в силу закона Фурье имеют однонаправленность во времени, в связи с чем появилось понятие необратимости процессов, необратимости времени, «стрелы времени». Итак, первым важным открытием было открытие того факта, что все протекающие естественным образом (без участия внешних сил) тепловые процессы необратимы. Второе, не менее важное открытие – установление второго начала (закона) термодинамики – принадлежит С. Карно, который изучал проблему использования теплоты (тепловой энергии) через преобразование ее в механическую энергию для производства работы в тепловых двигателях. Во времена С. Карно это были в основном паровые машины. Результаты своих исследований он изложил в сочинении «Размышления о движущей силе, огне и о машинах, способных развивать эту силу».
Карно установил, что тепловую энергию, которой обладает нагретое тело, непосредственно невозможно превратить в механическую энергию для производства работы. Это можно сделать только в том обязательном случае, если часть тепловой энергии тела с температурой Т1 передать другому телу с меньшей температурой Т2 и, следовательно, нагреть его до большей температуры. Иными словами, в механическую энергию для производства работы можно преобразовать только часть тепловой энергии и только при обязательном условии, что в системе такого преобразователя имеется нагреватель с температурой Т1 и охладитель с температурой Т2, т.е. для производства работы механической системой необходима разность температур Т1 – Т2. Все механические системы, использующие тепло, работают «на перепаде температур» между нагревателем и холодильником. Карно выразил эту мысль следующим образом: Возникновение движущей силы обязано в паровых машинах не действительной трате тепла, но его переходу от горячего тела к холодному... Недостаточно создать теплоту, чтобы вызвать появление движущей силы: нужно еще добавить холод; без него теплота стала бы бесполезной. Помимо этого, одного из важнейших открытий XIX в., Карно определил ту часть тепловой энергии, которая может быть переведена в производство механической энергии, в производство работы в тепловых машинах, т.е. он нашел значение разности W = Q1 – Q2, где W – полученная механическая энергия в процессе преобразования тепловой энергии; Q1 – полная тепловая энергия, отдаваемая нагретым телом в процессе преобразований энергии; Q2 – часть тепловой энергии, переданной холодильнику. Определив разность Q1-Q2, Карно нашел максимальное значение коэффициента полезного действия тепловых машин (для так называемого идеального цикла Карно), которое оказалось равным
Из приведенного соотношения следует, что коэффициент полезного действия (кпд) тепловой машины определяется только значениями Т1 и Т2. Или, по словам Карно, движущаяся сила тепла не зависит от агентов, взятых для ее развития; ее количество исключительно определяется температурами тел, между которыми, в конечном счете, производится перенос тепла. В дальнейшем, развивая идеи Карно, один из основных создателей теоретической термодинамики немецкий ученый Р.Ю. Клаузиус ввел важнейшее понятие – энтропию. Постепенно содержание понятия энтропии стало существенно расширяться. Из термодинамического понятия оно сначала перешло в другие разделы физики – механику, электричество, магнетизм, оптику, а затем в смежные науки – химию, информатику, биологию, и сейчас стало одним из важнейших понятий современного естествознания наряду с таким, например, понятием, как энергия. Энтропия (от греч. – поворот, превращение) – функция состояния термодинамической системы, изменение которой dS в равновесном процессе равно отношению количества теплоты dQ, сообщенного системе или отведенного от нее, к термодинамической температуре Т системы. Р. Клаузиус обратил внимание на то, что из выражения Карно для максимального коэффициента полезного действия тепловой машины
Итак, для циклических обратимых процессов Принцип возрастания энтропии справедлив для любой изолированной системы. Это обстоятельство указывает на асимметрию природных явлений, т.е. на однонаправленность происходящих в ней процессов. Раскрытие в дальнейшем более глубокого смысла энтропии, а также установление закона ее возрастания привело к целому ряду очень важных, далекоидущих следствий. Исследование энтропии в дифференциальной форме Кроме того, оказалось, что с помощью энтропии удобно исследовать не только тепловые процессы, но и рассматривать процессы преобразования других видов энергии в тепловую. Так, механическая энергия в результате трения переходит в тепловую, электрический ток нагревает проводники тока, электромагнитное поле – среду, через которую оно распространяется, и т.д., т.е. все естественные процессы, в конечном счете, ведут к превращению всех видов энергии в тепловую. Постепенно возникло представление о качестве разных видов энергии и ее деградации с точки зрения качества. Под качеством энергии понимается возможность использования того или иного вида энергии для производства полезной работы. Сейчас принята следующая иерархия качества энергии в указанном смысле: ядерная, электромагнитная, химическая, механическая и тепловая энергии. При этом каждому виду энергии соответствует свое значение энтропии. Оно имеет минимальное значение для энергии высокого качества и возрастает при превращении всех видов энергии в тепловую и переходу системы в термодинамическое равновесие, при котором энтропия достигает максимальной величины.
В связи с этим значение энтропии («превращения») характеризует меру обесценивания энергии. Там, где происходят процессы изменения и преобразования энергии, следует «ее тень – энтропия». Сегодня, как уже говорилось, понятие энтропии и знание ее величины необходимы при рассмотрении различных вопросов в физике, например при изучении фазовых переходов между твердым телом, жидкостью и газом, определении теплоты плавления кристаллов, теплоты парообразования. При плавлении и испарении происходит изменение энтропии систем. Термодинамические основы растворения одних веществ в других также требуют знания энтропии. То же касается радужных пленок на поверхности воды и мыльных пузырей. Возрастание растворимости веществ с повышением температуры, расслоение бензина на поверхности воды также связаны с возрастанием энтропии. Изменение энтропии выталкивает молекулы углеводородов из водного окружения. Изменение энтропии выступает в роли действующей силы. Эта энтропийная сила называется гидрофобной. Вещества, которые выталкиваются ею из воды, называются гидрофобными веществами, в отличие от гидрофильных веществ вроде спирта, которые полностью растворяются в воде. С гидрофобными силами связаны многие важные явления. Но наиболее важные следствия, определяемые гидрофобными энтропийными силами, – это строение белков – веществ, определяющих протекание всех жизненных процессов. Из приведенных примеров видно, что энтропия имеет важнейшее значение для многих вопросов, в том теле и для биологических систем. Важность энтропии в биологии формулировал один из создателей квантовой механики Э. Шрёдингер в своей знаменитой книге «Что такое жизнь с точки зрения физики?» в следующем высказывании: «Живой организм питается отрицательной энтропией». Энтропия играет важную роль во всех естественно-научных дисциплинах. В химии, например, это изучение процессов окисления, пучение реакций со взрывом, оценка возможности или невозможности протекания многих реакций, исследование скоростей протекания тех или иных реакций и др. Исключительно широкое применение получила энтропия в информатике, в частности, для расчетов пропускной способности различных линий связи и систем передачи информации.
|
||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 475; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.13.83 (0.015 с.) |

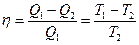 .
.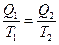 . Это соотношение, как известно, справедливо только для идеального обратимого цикла работы тепловой машины – цикла Карно. Отношение
. Это соотношение, как известно, справедливо только для идеального обратимого цикла работы тепловой машины – цикла Карно. Отношение 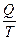 Клаузиус обозначил буквой S и назвал энтропией, что в переводе с древнегреческого означает «обращение», «превращение», «поворот». Таким образом, по мысли Клаузиуса, энтропия S =
Клаузиус обозначил буквой S и назвал энтропией, что в переводе с древнегреческого означает «обращение», «превращение», «поворот». Таким образом, по мысли Клаузиуса, энтропия S =  всегда будет меньше энтропии S2 =
всегда будет меньше энтропии S2 =  в силу того, что Т1 > Т2 и,следовательно, изменение энтропии ΔS = S2 – S1 всегда положительно. То есть в реальных процессах энтропия термодинамической системы будет возрастать.
в силу того, что Т1 > Т2 и,следовательно, изменение энтропии ΔS = S2 – S1 всегда положительно. То есть в реальных процессах энтропия термодинамической системы будет возрастать. показало, что dS является полным дифференциалом, и, следовательно, энтропия не зависит от вида физического процесса, а определяется только состоянием системы. Поэтому энтропия является функцией состояния.
показало, что dS является полным дифференциалом, и, следовательно, энтропия не зависит от вида физического процесса, а определяется только состоянием системы. Поэтому энтропия является функцией состояния.


