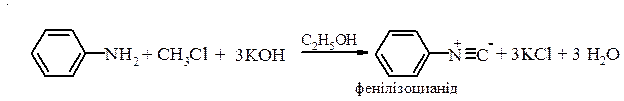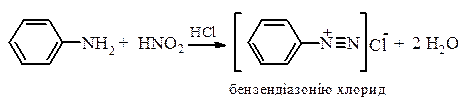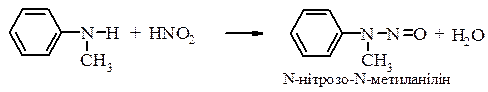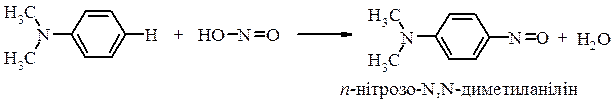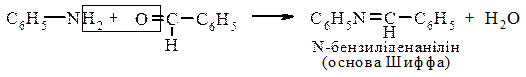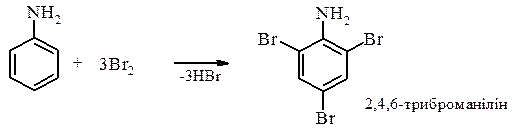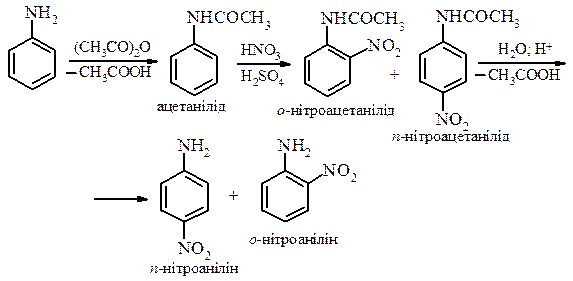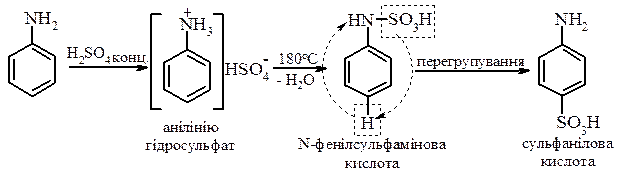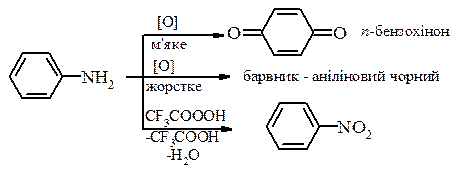Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні властивості ароматичних амінівСодержание книги
Поиск на нашем сайте
Це сполуки, які розподіляють на чисто ароматичні, у яких аміногрупа (─NН2) безпосередньо сполучена з атомом Карбону ароматичного ядра і жирно-ароматичні, у яких аміногрупа зв’язана з атомом Карбону бічного ланцюга. Вторинні і третинні ароматичні аміни можуть бути чисто ароматичними, наприклад: C6H5NHC6H5 (дифеніламін), (C6H5)3N (трифеніламін), або жирно-ароматичними, наприклад: C6H5NHCH3 (метилфеніламін), C6H5N(CH3)2 (диметилфеніламін). Подібно до амінів аліфатичного ряду ароматичні аміни виявляють основні властивості, оскільки в них на атомі Нітрогену аміногрупи є вільна пара електронів. Проте в ароматичних амінах за рахунок р-π-супряження електронна густина атома Нітрогену зміщується в бік бензольного ядра, внаслідок чого електронна густина на атомі Нітрогену зменшується і основні властивості ароматичних амінів послаблюються порівняно з амоніаком та аліфатичними амінами.
Так, константа основності аніліну становить 3,8·10-10, тоді як аміаку і метиламіну відповідно 1,8·10-5, 4,4·10-5. Основні властивості знижуються у такому ряду: СН3NH2 > NH3 > C6H5NH2 Ариламіни утворюють солі тільки з сильними мінеральними кислотами:
Наявність в ароматичному ядрі аніліну електрононегативних груп призводить до зменшення основності аміногрупи, так для п -нітроаніліну вона складає 0,1·10-12. Вторинні чисто-ароматичні аміни мають основність меншу, ніж анілін (дифеніламін К0=7,6·10-14), а трифеніламін основних властивостей не має. Таке значне зниження основних властивостей пов’язане з тим, що в супряженні вільної пари електронів атома Нітрогену бере участь два та три бензенових ядра. Алкільні групи, зв’язані з атомом Нітрогену аміногрупи, навпаки, підвищують основні властивості за рахунок позитивного індукційного ефекту, наприклад, N-метиланілін має К0=7,1·10-10. 1. Реакція алкілування. Первинні та вторинні ариламіни реагують з галогеналканами з утворенням N-алкіл- та N,N'-диалкілариламінів. Реакція відбувається трудніше у зв’язку з пониженою нуклеофільністю атому Нітрогену.
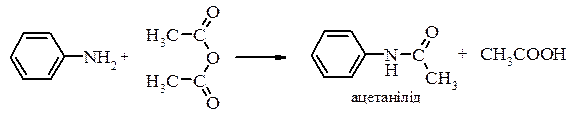
Реація ацилювання
Аніліди легко гідролізуються в кислому або лужному середовищах з утвренням вихідного аміну і карбонової кислоти:
Здатність ацильних похідних легко піддаватися гідролізу дозволяє використовувати цю реакцію в органічному синтезі для тимчасового захисту аміногрупи від окиснення та для зменшення її донорних властивостей. 3. Реакції утворення ізоціанідів (якісна реакція). Первинні ароматичні аміни при нагріванні з хлороформом та лугами в спиртовому середовищі утворюють ізоціаніди - речовини з неприємним запахом:
4. Реакції взаємодії з нітритною кислотою. Аліфатичні і ароматичні аміни по-різному реагують з нітратною кислотою. Цю реакцію можливо використовувати щоб розрізняти первинні, вторинні та третинні аміни алифітичного і ароматичного рядів. Первинні ароматичні аміни з нітритною кислотою в присутності сильної мінеральною кислоти утворюють солі діазонію. Ця реакція отримала назву реакції діазотування:
Вторинні ариламіни та N-алкілариламіни в цих умовах реагують аналогічно аліфатичним амінам і перетворюються у N-нітрозоаміни:
Третинні ароматичні аміни утворюють з нітритною кислотою ароматичні нітрозосполуки ─ відбувається реакція електрофільного заміщення за бензольним кільцем:
5. Реакція взаємодії з ароматичними альдегідами. Первинні ароматичні аміни реагують при нагріванні з ароматичними альдегідами, утворюя азометини (основи Шифа):
6. Реакції за участю атомів Карбону ароматичного ядра. За рахунок супряження електронів Нітрогену з ароматичним ядром значно збільшується електронна густина в орто - і пара -положеннях і утворюються більш стійкі σ-комплекси, що значно підвищують активність ароматичних амінів до реакції електрофільного заміщення в орто- і пара- положеннях. - Реакції галогенування. - Анілін взаємодіє з бромною водою при відсутності каталізаторів і утворюється 2,4,6-триброманілін.
- Реакція нітрування. У зв’язку з легким окисненням ароматичних амінів за аміногрупою проведення реакцій з реагентами, які можуть призвести до окиснення, проводять в умовах захисту аміногрупи реакцією ацилювання. Після проведення реакції ацильну групу гідролізують. Таким чином проводять реакцію нітрування.
- Реакція сульфування. При нагріванні аніліну з концентрованою сульфатною кислотою утворюється п ‑амінобензолсульфокислота, яку найчастіше назівають сульфаніловою кислотою. Реакція проходить через стадію утворення
7. Окиснення ароматичних амінів:
|
||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 1179; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.212.203 (0.008 с.) |