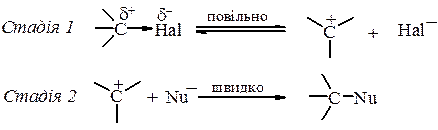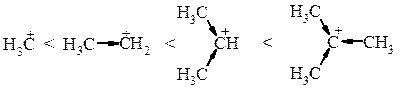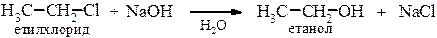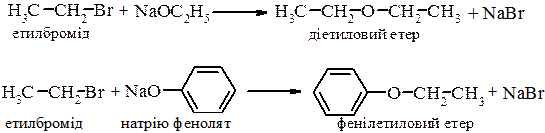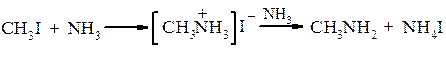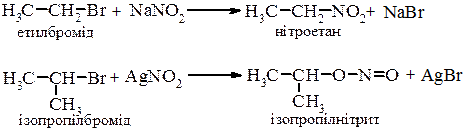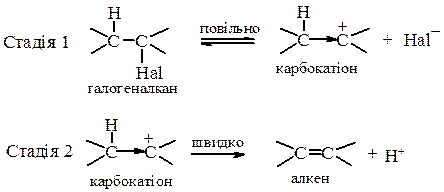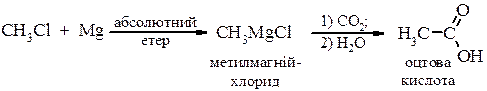Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
І. Реакції нуклеофільного заміщенняСодержание книги
Поиск на нашем сайте
Галогеналкани є електрофільними реагентами. Здатність галогеналканів вступати в реакції SN обумовлена полярністю зв’язку карбон–галоген. Оскільки атом галогену є більш електронегативним ніж атом Карбону, він зміщує на себе електронну густину зв’язку С–Hal. В результаті цього атом галогену набуває частково негативного заряду (δ-), а атом Карбону – частково позитивного заряду (δ+) і може бути атакованим нуклеофільним реагентом. Нуклеофільними реагентами можуть бути речовини, які мають атоми з неподіленими парами електронів (Н2O, NH3, RNH2, RSH тощо), а також речовини, які утворюють при дисоціації аніони (NaOH (OH –), KCN (CN –), NaSH (HS –) тощо).
При нуклеофільному заміщенні нуклеофіл атакує молекулу, віддаючи для утворення нового зв’язку свою пару електронів, а атом галогену відщеплюється від молекули галогеналкану з електронною парою зв'язку С–Наl. Реакційна здатність галогеналканів у реакціях SN зменшується в ряду: R– I > R– Br > R– Cl >> R– F Це пояснюється поляризованістю зв'язку С–Наl, тобто здатністю зв'язку збільшувати полярність при підході нуклеофільного реагенту. Поляризованість зв'язку тим більша, чим більш об'эмиста та рухлива електронна оболонка атомів, які утворюють зв'язок. Саме через низьку поляризованість зв'язку С–F флуоралкани практично не вступають в реакції нуклеофільного заміщення В залежності від будови галогеналканів, природи нуклеофілу та розчинника реакції SN відбуваються за двома основними механізмами SN1 та SN2. Механізм SN2 (заміщення нуклеофільне другого порядку або бімолекулярне нуклеофільне заміщення). За механізмом SN2 реагують первинні і трудніше вторинні галогеналкани. Реакція відбувається в одну стадію через утворення перехідного стану.
Для SN2 реакцій характерні такі ознаки: 1. Швидкість реакції залежить від концентрації обох реагентів. 2. Реакції супроводжуються, як правило, інверсією конфігурації атому Карбону, тобто конфігурація атому Карбону в процесі реакції змінюється на протилежну – відбувається Вальденівське обертання конфігурації. 3. При SN2 реакціях, як правило, відсутні перегрупування. Механізм SN1 (заміщення нуклеофільне першого порядку або мономолекулярне нуклеофільне заміщення). За цим механізмом проходить нуклеофільне заміщення у третинних і, в певних умовах, у вторинних галогеналканів. Перша стадія реакції – дисоціація – є лімітуючою стадією і відбувається за участю молекул протонного полярного розчинника. Друга стадія відбувається миттєво.
Особливості реакцій SN1: 1. Швидкість реакції залежить лише від концентрації галогеналкану. 2. Оскільки в реакціях SN1 на лімітуючий стадії утворюється карбокатіон, швидкість реакції перед усім залежить від відносної стійкості карбокатіону, тобто від електронних факторів: чим стійкіший утворений карбокатіон, тим більша швидкість реакції. Стійкість алкільних карбокатіонів обумовлена делокалізацією позитивного заряду за рахунок +І -ефекту і збільшується в ряду:
Тому утворення третинного карбкатіону для молекули енергетично вигідніше ніж вторинного, а тим більше первинного. 3. Оскільки реакції SN1 відбуваються через проміжне утворення карбокатіону, вони як правило, супроводжуються перегрупуванням. 1. Гілроліз галогеналканів. Галогеналкани гідролізуються до спиртів. Реакція проходить у присутності водних розчинів лугів або карбонатів лужних металів, так як з водою вона є оборотною.
2. Реакція Вільямсона. Реакція взаємодії галогеналканів з алкоголятами та фенолятами є одним з найкращих методів одержання етерів.
3. Взаємодія з солями карбонових кислот. При дії солей карбонових кислот на галогеналкани утворюються естери. Реакція проходить у середовищі апротонного полярного розчинника (диметилформамід, диметилсульфоксид).
4. Взаємодія з амоніаком, алкіл- та арил амінами. При взаємодії з аммоніаком та амінами галоген алкани алкілують їх з утворенням суміші первинних, вторинних і третинних амінів, а також – четвертинних амонієвих основ.
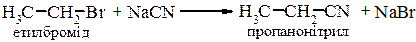
5. Взаємодія з солями синільна кислоти. Первинні та вторинні галогеналкани з натрієм або калієм цианідом у середовищі апротонного полярного розчинника утворюють нітрили (SN2).
6. Взаємодія з солями нітратної кислоти. Продукти цих реакцій залежать від умов проведення реакцій, будови галогеналкану та солі.
ІІ. Реакції елімінування. Реакції елімінування супроводжуються відщепленням гідрогенгалогену від галогеналканів і призводять до утворення алкенів.
Відщеплення гідрогенгалогенів від галлогеналканів стає переважним процесом у присутності нуклеофільних реагентів, які мають високу основність. До них належать спиртові розчини гідроксидів лужних металів або алкоголяти лужних металів. Елімінуванню сприяють також підвищення температури реакційної суміші і концентрації реагентів. Сприятливо впливає збільшення кількості замісників біля електрофільного атома Карбону. Тому найлегше елімінування відбувається в ряду третинних галогеналканів. Якщо в молекулі галогеналкану є кілька альтернативних шляхів відщеплення гідрогенгалогенів, то реалізується з них переважно той, в якому подвійний зв'язок утворюється при найбільш заміщеному атомі Карбону, тобто разом з галогеном відходить Гідроген від найменш гідрогенізованого сусіднього атома Карбону. Ця закономірність отримала назву "правило Зайцева":
Відщеплення галгеноводнів від галогеналканів може проходити за моно- та бімолекулярним механізмами. 1. Механізм Е1 – відщеплення мономолекулярне, швидкість реакції залежить лише від концентрації галогеналкану: V=k[R–Hal]
Лімітуюча стадія реакції – утворення карбокатіону, тому швидкість реакції зростає при переході від первинних до третинних алкілгалогенідів. Відщеплення протону за механізмом Е1 є наглядним проявом ефекту надсупряження; протон відщеплюється внаслідок перекривання вакантної орбіталі карбокатіоного центру з електронами сусіднього зв’язку С-Н. 2. Механізм Е2 – відщеплення бімолекулярне, швидкість реакції залежить від концентрації обох реагентів – галгеналкану та основи: V=k[R–Hal][В-]. Механізм Е2 зображується такою схемою:
Реакція за механізмом Е2 прискорюється із збільшенням числа замісників при сусідньому атомі Карбону. Це пов'язано з утворенням термодинамічно вигідного розгалуженого алкену та меншою міцністю зв’язку С–Н біля більш заміщеного атому Карбону.
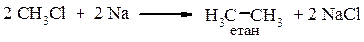
ІІІ. Взаємодія з металами
|
||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 1016; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.77.51 (0.01 с.) |