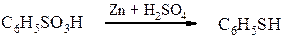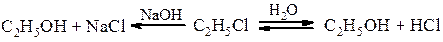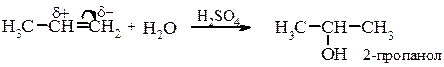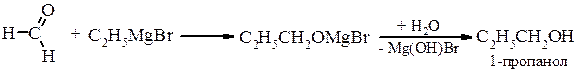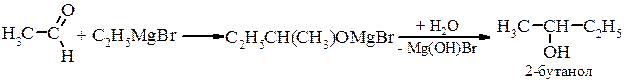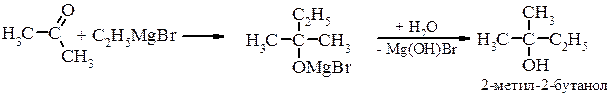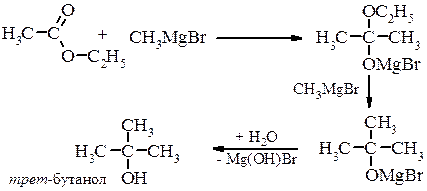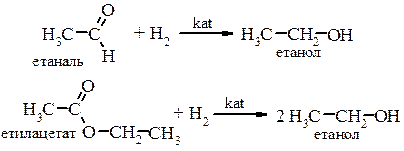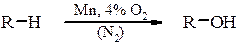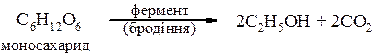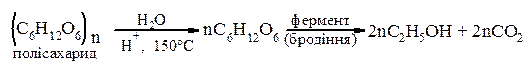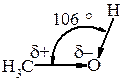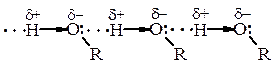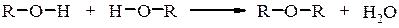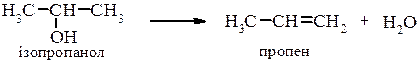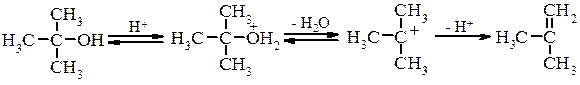Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні властивості сульфокислотСодержание книги
Поиск на нашем сайте
Реакції сульфогрупи - утворення солей С6H5SO3H + NaOH ® C6H5SO3Na + H2O; - утворення хлорангідридів (сульфохлоридів) С6H5SO2OH + PCl5 ® C6H5SO2Cl + POCl3 + HCl. бензолсульфохлорид Проте, звичайно сульфохлориди одержують дією хлорсульфонової кислоти на вуглеводні: С6H5SO2OH + HOSO2Cl ® C6H5SO2Cl + H2SO4 Сульфохлориди можна легко перетворити в естери та аміди, подібно до хлорангідридів карбонових кислот: C6H5SO2Cl + NaOC2H5 ® C6H5SO2OC2H5 + NaCl етиловий естер бензолсульфокислоти C6H5SO2Cl + 2 NH3 ® C6H5SO2NH2 + NH4Cl Бензолсульфамід - утворення тіофенолів
Реакції заміщення сульфогрупи - гідроліз (при дії перегрітої водяної пари в кислому середовищі сульфокислоти дають вихідні ароматичні вуглеводні)
- реакції лужного плавлення С6H5SO3Na + 2 NaOH ® C6H5ONa + Na2SO3 +H2O фенолят натрію 2 С6H5SO3Na + H2SO4 ® 2 C6H5OH + Na2SO4 - cплавлення солей сульфокислот з ціанідами з утворенням нітрилів С6H5SO3Na + NaCN ® C6H5CN + Na2SO3 3. Реакції електрофільного заміщення водню відбуваються важче, ніж у бензолі. Cульфогрупа затруднює електрофільного заміщення і орієнтує нові замісники в мета -положення.
ОДНО- І БАГАТОАТОМНІ СПИРТИ Спирти - це похідні вуглеводнів, у молекулах яких один або декілька атомів Гідрогену заміщені гідроксильними групами. В залежності від кількості гідроксильних груп спирти бувають одноатомні та багатоатомні.
Методи одержання спиртів Гідроліз галогенопохідних Спирти одержують гідролізом галогенпохідних при нагріванні з водою або водним роззином лугу. В першому випадку реакція зворотня
Каталітична гідратація алкенів
Металоорганічний синтез а) первинні спирти
б) вторинні спирти
в) третинні спирти
4. Каталітичне гідрування карбонільних сполук у присутності каталізаторів (Ni, Co, Pt, Pd) а) гідрування альдегідів і естерів з утворенням первинних спиртів:
б) каталітичне відновлення кетонів призводить до утворення вторинних спиртів:
в) відновлення ароматичних альдегідів і кетонів та естерів ароматичних кислот відбувається аналогічно. Окиснення алканів Реакція окиснення має практичне застосування для вищих парафінів С12-С20:
Ферментативна переробка вуглеводів – спиртове бродіння моносахаридів і полісахаридів
Будова спиртів
Зв’язки С–О і О–Н поляризовані, негативним кінцем диполя є Оксиген. Загальний (сумарний) дипольний момент спиртів m = 1,6-1,8 D. Полярність зв’язку О–Н значно вища, ніж полярність зв’язку С–О. Такий розподіл електронної густини сприяє тому, що для О–Н групи характерні гетеролітичні (іонні) реакції, в яких може розірватись О–Н-зв’зок або С–О. Полярність зв’язку О–Н і наявність неподіленої електронної пари електронів у атома Оксигену зумовлюють утворення водневих зв’язків, які сприяють існуванню асоціатів між молекулами спирту. Це пояснює високі температури кипіння спиртів (tкип.(С2Н5ОН) = 78,3 °С; tкип.(СН3–О–СН3) = 23,6 °С).
Спирти С1–С3 змішуються з водою у будь-яких попорціях, що пояснюється утворенням водневих зв’язків з молекулами води.
Хімічні властивості спиртів
1. Спирти – амфотерні сполуки. Виявляють властивості дуже слабких кислот: у реакції з металічним натрієм утворюють солі – алкоголяти:
Алкоголяти легко розкладаються водою, адже спирти більш слабкі кислоти ніж вода
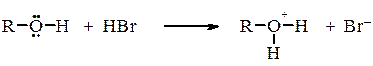
Кислотні властивості спиртів зменшуються в наступному порядку: первинні > вторинні > третинні. Як і вода, спирти проявляють і основні властивості: реагують на холоду з сильними кислотами з утворенням солей алкілоксонію:
При нагріванні, а у випадку третинних спиртів на холоду, оксонієві солі перетворюються в галогенопохідні. Внутрішньо- та міжмолекулярна дегідратація спиртів Дегідратація При дії на спирти дегідратуючих речовин (H2SO4, H3PO4, Al2O3, CuSO4 та ін.) проходить міжмолекулярне або внутрішньомолекулярне відщеплення води з утворенням відповідно етерів та ненасичених сполук.
Внутрішньомолекулярна дегідратація проходить на тих самих каталізаторах, що і міжмолекулярна але при підвищеній температурі. В залежності від будови спирта і умов проведення реакції відщеплення води проходить за механізмами Е1 або Е2, наприклад для третинного спирту при каталітичній дії кислоти механізм реакції можна представити наступним чином:
3. Заміщення гідроксильної групи. Гідроксильна група спиртів здатна заміщуватися галогеном при взаємодії спиртів з галогеноводнями, галогенідами фосфору або тіонілхлоридом (див. розд. галогенопохідні вуглеводнів). Спирти порівняно легко окиснюються такими окисниками як KMnO4, K2CrO7. Первинні спирти окиснюються до альдегідів, вторинні до кетонів. Багатоатомні спирти повторюють властивості одноатомних.
ФЕНОЛИ. ХІНОНИ Фенолами називають органічні сполуки, які містять гідроксильну групу, безпосередньо сполучену з атомом Карбону бензольненового ядра. Залежно від кількості гідроксильних груп в їх структурі феноли поділяють на одноатомні, двоатомні, тощо. Методи одержання фенолів
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 368; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.253.224 (0.007 с.) |