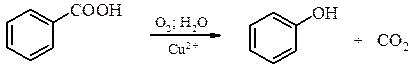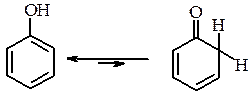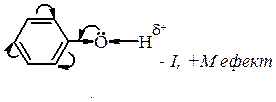Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Плавення солей ароматичних сульфокислот із лугами
С6H5SO3Na + 2 NaOH ® C6H5ONa + Na2SO3 +H2O фенолят натрію С6H5SO3Na + HCl ® C6H5OH + NaCl Метод широко використовується в промисловості, реакцію проводять при 320-350°С з NaOH. Вихід 60-80%. Гідроліз галогенопохідних
Реакцію проводят в присутності солей Купруму з 8%-ним розчином NaOH в автоклаві. Розклад гідропероксидів
4. Окиснювальне декарбоксилювання карбонових кислот. Реакція проходить при 200-300°С у присутності солей купруму (ІІ).
Розклад солей діазонію
Будова фенолів При розгляді будови фенолу можна було б припустити існування кето-єнольної таутомерії:
Однак більшість фенолів існує виключно в єнольній формі. Більша стійкість єнольній формі фенолів зумовлена більшим ступенем супряження неподіленої пари електронів атома Оксигену групи О–Н з p-електронами фенольного ядра, що призводить до стабільності молекули в порівнянні з кетонною формою. Хімічні властивості фенолів Хімічні властивості фенолів визначаються гідроксильною групою і сполученим з нею бензеновим ядром. Гідроксил виявляє –І-ефект і разом з тим вільні пари р-електронів атома Оксигену взаємодіють з π-електронами бензенового ядра (р,π-супряження), тому в результаті такої взаємодії р‑електронна густина Оксигену зміщується в напрямку бензенового ядра (ефект супряження сильніший ніж індукційний).
1. Кислотні властивості фенолів. Феноли виявляють більшу кислотність ніж спирти та вода, проте вони слабкіші ніж вугільна та карбонові кислоти. Феноли реагують з розчинами лугів з утворенням фенолятів. В свою чергу феноли виділяють з розчинів фенолятів вугільною кислотою: ArOH + NaOH ® ArONa + H2O ArONa + CO2 + H2O ® ArOH + NaHCO3 Більша кислотність фенолів у порівнянні зі спиртами пояснюється додатковою делокалізацією заряду у фенолят-аніоні, якої немає в алкоголят аніоні:
На кислотні властивості фенолу впливають замісники в ароматичному ядрі. Електроноакцепторні замісники особливо в орто - і пара - положеннях, значно збільшують кислотність фенолів. Наприклад, тринітрофенол (пікринова кислота) має константу іонізації 1,6·10-1. 2. Утворення етерів та естерів. Феноли легко алкілуються при діі на феноляти галогенопохідних, особливо у присутності порошку Купруму, а також при дії алкілсульфатів, естерів сульфокислот та діазометану:
С6H5ONa + C2H5I ® С6H5OC2H5 + NaI фенетол С6H5OH + CH2N2 ® С6H5OCH3 + N2 анізол При взаємодії фенолятів з галогенаренами утворюються ароматичні етери: С6H5ONa + С6H5Br ® С6H5OC6H5 + NaBr дифеніловий етер Дифеніловий етер має запах герані. Взаємодія фенолятів з галогенагідридами карбонових кислот призводить до утворення естерів: С6H5ONa + CH3COCl ® С6H5OOCH3 + NaCl Аналогічні продукти одержуються також за реакцією ацилування фенолів ангідридами карбонових кислот. Можлива естерифікація фенолу кислотами в присутності H2SO4 та H3PO4 в умовах азеотропної відгонки води. 3. Окиснення фенолів. Феноли легко окиснюються, навіть киснем повітря. При окисненні хромовою сумішшю фенол перетворюється в п ‑бензохінон, який забарвлений у жовтий колір.
|
|||||
|
Последнее изменение этой страницы: 2016-12-29; просмотров: 355; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.6.75 (0.007 с.) |