
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Z – число протонов в ядре, зарядовое числоСодержание книги
Поиск на нашем сайте
Заряд числа, по такому утверждению, определяется как произведение порядкового номера на элементарный электрический заряд. В данном случае е – это заряд электрона, элементарный электрический заряд его называют, и взят он по модулю, потому что понятно, что заряд ядра у нас положительный. В этом случае порядковый номер стали называть зарядовым числом, порядковый номер – это число, соответствующее числу протонов в ядре. Таким образом, мы, говоря о порядковом номере, можем говорить о количестве протонов в ядре. Следующее число, о котором необходимо сказать, – это число массы. Оно, это число, обозначено буквой А, и это самое число берут то же из таблицы Менделеева и округляют его до целых. Дальше мы можем говорить о том уравнении, которое называется во всем мире уравнением Иваненко – Гейзенберга. Это уравнение состоит из трех чисел: массового числа, зарядового числа и числа нейтронов. Давайте посмотрим, как оно записывается и как обозначаются данные величины. Уравнение Иваненко - Гейзенберга А = Z + N А – массовое число, Z – порядковый номер элемента, N – число нейтронов в ядре Посмотрите: массовое число А говорит о том, какое количество нуклонов входит в ядро. Оказалось, что, по таблице Менделеева определяя массовое число химического элемента, мы определяем число нуклонов в ядре атома. Z, как мы говорили, будет порядковый номер и число протонов в ядре. N в данном случае – это число нейтронов. Таким образом, мы можем из этого уравнения определить число нейтронов, число протонов, зная массовое число и порядковый номер. Здесь необходимо отметить важный момент. Дело в том, что в 1913 году еще один ученый Содди (вы помните, что этот человек работал вместе с Резерфордом) установил интересную вещь. Выяснено было, что существуют химические элементы с абсолютно одинаковыми химическими свойствами, но разным массовым числом. Такие элементы, у которых одинаковые химические свойства, но разное массовое число, стали называть изотопами. Изотопы – это химические элементы с одинаковыми химическими свойствами, но с различной массой атомных ядер. Еще надо добавить, что у изотопов разная радиоактивность. Все это вместе привело к изучению этого вопроса. Здесь показаны изотопы легких и тяжелых элементов химических. Давайте посмотрим. Мы выбрали специально разные области таблицы Менделеева, чтобы показать, что практически все элементы химические имеют изотопы. Изотопы: У водорода этих изотопов три. Первый изотоп Следующий вопрос, который мы должны затронуть, вытекает из сказанного. Как эти частицы, эти нуклоны удерживаются внутри ядра? Мы назвали различные химические элементы, изотопы различные, особенно у тяжелых элементов, там, где нуклонов, т.е. протонов и нейтронов, много. Как, каким образом они удерживаются внутри ядра? Мы знаем, что в маленьком ядре расстояния, размеры ядра очень и очень малы, бывает собрано большое количество частиц нуклонов. Как эти нуклоны там так плотно, тесно удерживаются, какими силами? Ведь за счет электростатического отталкивания эти частицы должны очень быстро распадаться, разлетаться. Мы знаем, что разноименные только заряды притягиваются, частицы, заряженные разноименными зарядами. Если частицы заряжены одноименно, понятно, что они должны отталкиваться. Внутри ядра находятся протоны. Они положительно заряжены. Размер ядра очень мал. В этом же ядре находятся еще и нейтроны, значит, должны быть силы, которые удерживают вместе те и другие частицы. Эти самые силы называют ядерными силами. Ядерные силы – это силы притяжения, действующие между нуклонами. Можно сказать, что у этих сил существуют свои особые свойства. Первое свойство, о котором мы должны сказать, – это то, что ядерные силы должны превосходить силы электростатического отталкивания. И это так, когда удалось их определить, то выяснилось, что они в 100 раз превосходят силы электростатического отталкивания. Еще одно очень важное замечание, что действуют ядерные силы на малом расстоянии. Например, 10-15м – это и есть диаметр ядра, эти силы действуют. Но стоит только увеличиться размеру ядра до 10-14, казалось, совсем немного, то это приводит к тому, что ядро обязательно распадется. На этом расстоянии уже ядерные силы не действуют. А силы электростатического отталкивания продолжают действовать и именно они отвечают за то, что ядро распадается. Еще можно сказать о ядерных силах то, что они не центральны, т.е. они не действуют вдоль прямой, соединяющей эти частицы. И то, что ядерные силы не зависят от того, обладает частица зарядом или не обладает, потому что в ядро входят и протоны, и нейтроны. Вместе эти частицы находятся. Таким образом, вывод: эти частицы, нуклоны, удерживаются в ядре за счет ядерных сил, и эти силы действуют только в ядре. Еще можно отметить, что ядерные силы имеют важное значение в плане стабильности ядра. Отвечают за долговременность существования этого элемента. В заключение мы можем отметить еще одно: когда мы будем говорить об энергетике, вот здесь именно ядерные силы будут играть основную роль. Об этом мы поговорим на следующих уроках. До свидания. Задание к уроку. 1. Определите нуклонный состав ядер железа 2. В ядре атома химического элемента 22 протона и 26 нейтронов. Назовите этот химический элемент. 3. Оцените силу гравитационного взаимодействия между двумя нейтронами в ядре. Масса нейтрона примерно равна 1,7*10-27 кг, расстояние между нейтронами примите равным 10-15 м, значение гравитационной постоянной 6,67*10-11(Н*м2)/кг2.
|
||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 1459; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.103.14 (0.009 с.) |

 Н – протий
Н – протий  U
U H – дейтерий
H – дейтерий  U
U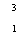 Н – тритий
Н – тритий (количество нуклонов, протонов, нейтронов).
(количество нуклонов, протонов, нейтронов).


