Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нейроваскулярные синдромы нижних конечностейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Синдром грушевидной мышцы (пири-формис-синдром) складывается из поражения самой грушевидной мышцы и сдавления седалищного нерва и нижней ягодичной артерии (рис. 7.95). Клинику часто определяет взаимоотношение указанных мышц и нерва. Волокна грушевидной мышцы, начинаясь от передней поверхности крестца, через большое седалищное отверстие идут к верхушке большого вертела. Грушевидная мышца разделяет большое седалищное отверстие на надгрушевидное и подгрушевид-ное, при этом грушевидная мышца отделяет верхний ягодичный сосудисто-нервный пучок (одноименные артерия, вена и нерв) от нижнего ягодичного, в котором проходят внутренние половые сосуды, половой, седалищный и задний кожный нервы. Грушевидная мышца окружена собственным фасциальным влагалищем, а со стороны таза выстлана еще и париетальной фасцией. Фасциаль-ные футляры грушевидной мышцы имеют две пластинки, между которыми имеются фасциальные отроги
Рис. 7.95. Синдром грушевидной мышцы. 1 — расщепление грушевидной мышцы на два брюшка, высокое деление седалищного нерва; 2 — малоберцовый нерв; 3 — болынеберцовый нерв. и рыхлая клетчатка. Париетальная фасция также состоит из 2 пластинок. Одна из них — пристеночная — рыхлая, другая имеет плотное, иногда апоневротическое строение. Грушевидная мышца в местах прикрепления и фиксации к костям не имеет фасций, она непосредственно вплетается в ткань надкостницы. Такой способ прикрепления мышцы, возможно, служит предпосылкой возникновения в этих местах дистрофических изменений при спазмах мышц. Особенности строения грушевидной мышцы (расщепление мышцы на два брюшка, снабженных выраженными сухожилиями) и топографии (высокое деление седалищного нерва, прохождение заднего кожного нерва между сухожилиями двух брю-шек, расположение седалищного нерва между хорошо развитым сухожилием грушевидной мышцы и крест-цово-остистой связкой) могут создать предпосылки для функционального разобщения внутри- и внетазовых ее частей, что играет определенную роль в патогенезе синдрома. Все пе- речисленные изменения могут способствовать сдавлению седалищного нерва и внутренних половых сосудов в подгрушевидном отверстии патологически измененной мышцей. Среди причин, приводящих к поражению мышцы, выделяют рефлекторный спазм вследствие поражения поясничного и крестцового отделов позвоночника, травму, воспалительные процессы, артроз тазобедренного сустава. Клиническая картина синдрома грушевидной мышцы характеризуется преобладанием неврологического компонента над сосудистым. Неврологическая симптоматика состоит в болевом синдроме. Боль локализуется в ягодичной области, иррадиирует в поясницу, ногу; как правило, боль имеет ноющий характер. Часто болевой синдром сопровождается преходящими парестезиями, которые ощущаются в основном в зоне иннервации седалищного нерва (зябкость, чувство ползания мурашек, покалывание, онемение, одеревенение). У половины больных изменение чувствительности может наблюдаться в областях, выходящих за зону корешка или седалищного нерва (в виде широкого лампаса). Характерные симптомы — диффузная слабость больной ноги, понижение тонуса и гипотрофия ягодичных, разгибателей и приводящих мышц бедра, мышц голени. Среди трофических нарушений наиболее часто встречается гиперкератоз. У части больных, кроме неврологического компонента, может присутствовать и сосудистый. Для него характерны снижение пульса на артериях стопы, влажность ноги (особенно стопы), изменение цвета больной конечности (цианоз или бледность), снижение кожной температуры. Грубых сосудистых и трофических расстройств при этом синдроме не наблюдается. Диагноз основывается на детальном сборе жалоб, анамнезе, осмотре больного и проведении ряда клинических проб. Важны неврологичес- кие тесты: напряжение грушевидной мышцы при пальпации (при наружной пальпации в глубине ягодичной области грушевидная мышца определяется в виде ограниченного тяжа или валика различной плотности), болезненность капсулы крестцово-под-вздошного сочленения, болезненность внутренней поверхности большого вертела бедра, снижение коленного рефлекса, положительный симптом стволового ишиаса Бехтерева (боль в подколенной ямке при форсированном прижатии колена больного, лежащего на спине, к постели) и симптом Гроссмана (при ударе молоточком по поясничным позвонкам или по средней линии крестца возникает сокращение ягодичных мышц на стороне пораженной грушевидной мышцы). Для синдрома грушевидной мышцы наиболее типичен симптом приведения бедра и вращения ноги: пассивное приведение ноги с ротацией ее внутрь. Для исключения натяжения седалищного нерва бедро приводят при согнутой в коленном суставе ноге. С целью дифференциальной диагностики используют блокаду патологически измененной мышцы раствором новокаина. Для инфильтрации грушевидной мышцы иглу вводят до ощущения препятствия от плотной крестцово-остистой связки, после чего иглу извлекают на 0,5 см и вводят 10 мл 0,5 % раствора новокаина. Обычно через 10—20 мин уменьшаются боль и зябкость ноги, она теплеет, что подтверждает наличие пи-риформис-синдрома. Консервативная терапия является основным методом лечения. Ее основу составляет сочетание ортопедических, физиотерапевтических мероприятий и лекарственной терапии. Для лечения применяют локальные воздействия (блокады, иглотерапия, электропунктура), ортопедические методы (специальные укладки и вытяжения), лекарственное лечение (витамины группы В, прозерин, га-лантамин, дибазол), физиотерапию (электрофорез, магнитотерапия, ультразвук), массаж, ЛФК. Показаниями к хирургическому лечению являются выраженная стадия синдрома, длительная безуспешная консервативная терапия. Техника операции. Положение больного на животе или здоровом боку. Разрез кожи кзади от передневерх-ней подвздошной ости проводят книзу впереди большого вертела, затем продолжают на бедро по ягодичной складке (доступ Гагена—Торна— Радзиевского). После рассечения кожи, подкожной жировой клетчатки и поверхностной фасции обнажают широкую фасцию и сухожилие большой ягодичной мышцы. Надсекают собственную фасцию и сухожилие большой ягодичной мышцы над большим вертелом, затем разрез ведут через верхний и нижний края большой ягодичной мышцы; кожный мышечный лоскут отворачивают кнутри, обнажают седалищный нерв и грушевидную мышцу, которую резецируют. Подколенный синдром обусловлен наличием широкого и короткого пластинчатого тяжа фасции, соединяющей собственное фиброзное влагалище бедренной артерии и переднюю стенку межфасциального ложа на уровне бедренно-подколенного канала в нижней трети бедра. Вследствие этого в нижней трети бедра артерия, вена и n.tibialis очень тесно прижимаются к плотной малоподвижной апоневротической пластине, что приводит к нарушению их функции. Подколенный синдром чаще встречается в молодом возрасте у лиц физического труда и в большинстве случаев возникает после поднятия тяжестей и физической нагрузки. В клинической картине превалируют артериальная или венозная недостаточность и неврологическая симптоматика. Для подколенного синдрома типична спонтанная и отраженная боль в подколенной области, в голени и бедре на стороне поражения. Интенсивность болей зависит от движений в коленном суставе. Наряду с болевым синдромом отмечаются преходящие парестезии в ноге, усиливающиеся при движении. Стойкий болевой синдром заставляет больных щадить коленный сустав, что может привести к его контрактуре. Важным признаком подколенного синдрома является отек подколенной ямки. Артериальная и венозная недостаточность, имеющие острый или хронический характер, часто доминируют в клинической картине. Острая артериальная недостаточность может быть обусловлена стойким спазмом подколенной артерии в межфасци-альном ложе, ее тромбозом или эм-болиями в дистальное артериальное русло. В этом случае клиническая картина характеризуется внезапной сильной болью, бледностью кожных покровов ноги, нарушением чувствительности (парестезии и гипестезии) с исчезновением сначала тактильной, а затем и болевой чувствительности, отсутствием пульса, запустеванием поверхностных вен, параличом конечности в поздних стадиях. Хроническая артериальная недостаточность развивается при постепенном сужении просвета артерии. Проявляется в ранних стадиях перемежающейся хромотой, зябкостью, похолоданием, онемением, в поздних — болью в покое, снижением мышечной силы, язвенно-некротическими изменениями. Венозная недостаточность также может иметь острые или хронические проявления. При остром тромбозе подколенной или глубоких вен голени отмечаются типичные симптомы: боль в голени, отек, местное повышение температуры, болезненность при пальпации голени, положительный симптом Хоманса (боль при тыльном сгибании стопы). Хроническая венозная недостаточность проявляется отеками голени и может быть обусловлена остаточными явлениями перенесенного острого тромбофлебита глубоких вен и постоянной компрессией подколенной вены. При объективном обследовании, как правило, выявляются уплотнение головок и болезненность в точках прикрепления трехглавой мышцы бедра и полусухожильно-полуостистой мышцы. Несколько реже наблюдаются симптом стволового ишиаса Бехтерева, диффузное понижение тонуса мышц ноги и снижение ахиллова рефлекса. Определение пульсации, ультразвуковое (УЗДГ, дуплексное сканирование), рентгеноконтрастное исследование артерий и вен, измерение транскутанного напряжения кислорода на стопе дают информацию о состоянии сосудов и выраженности ишемии. Характерных диагностических проб при подколенном синдроме нет. В 20 % случаев может быть положительным симптом закручивания голени: при резком приведении голени с попыткой поворота ее и стопы внутрь ослабевает пульс на артериях стопы и подколенной артерии. Лечение подколенного синдрома хирургическое. Оперативные вмешательства в большинстве случаев выполняют в запущенных стадиях заболевания (окклюзии подколенной артерии или артерий голени), что является прямым показанием к реконструктивным операциям на сосудах. При отсутствии окклюзирующих поражений сосудов и доказанном подколенном синдроме используют пери-артериальную симпатэктомию подколенной артерии, флеболиз подколенной вены. Техника операции. Положение больного на животе, конечность слегка согнута в коленном суставе. Проводят продольный разрез кожи, подкожной клетчатки и поверхностной фасции длиной 10—12 см; отступив от срединной линии кнаружи, рассекают собственную фасцию и по проекции обнажают большеберцовый нерв. Глубже и кнутри от нерва выделяют подколенную вену, под которой располагается одноименная артерия, отделенная от сумки коленного сустава жировой клетчаткой. Выделяют под- коленную артерию и вену из фиброзного влагалища на всем протяжении раны, выполняют периартериальную симпатэктомию. Результаты лечения в ближайшие и отдаленные сроки благоприятные. Литература Верещагин В.Я. Роль поражения экстракраниального отдела позвоночных артерий в нарушении мозгового кровообращения//Журн. невропатол. и психиатр.—1962.—№ П.— С. 1654. Грейда Б. П. Синдром шейного ребра//Вес-тн. хир.-1988.-Т.140, № 6.-С.45-46. Грейда Б.П. Реберно-ключичный синдром Фальконера—Веделя//Вестн. хир.—1988.— Т.141, № 10.-С.121-122. Измуханов А.К., Матыбаев Н.К., Дашиев В.А. Сравнительная оценка хирургических доступов к грудным симпатическим уз-лам//Грудная хир.—1982.—№ 5.-С.72-75. Кипервас И.П. Нервно-сосудистые нарушения при синдроме сдавления сосудов и нервов в области шеи плечевого пояса//Клин. мед.-1982.-№ 7.-С.35-40. Кипервас И. П. Периферические нейровас-кулярные синдромы.—М.: Медицина, 1985. Лурье А. С. Хирургия плечевого сплетения.—М.: Медицина, 1968.—215 с. Петровский Б.В., Беличенко И.А., Крылов B.C. Хирургия ветвей дуги аорты.—М.: Медицина, 1970. Попов В.В., Мосунов А.И. Функциональная флебоманометрия при компрессионном синдроме грудного выхода//Вестн. хир.— 1994.-Т.152, № 3-4.-С.100. Сулътанов Д.Д. Хроническая ишемия верхних конечностей: Автореф. дис.... д-ра мед. наук.—Душанбе, 1996. Шалимов А.А., Дрюк Н.Ф., Олейник Л.И., Полищук Ю.Э. Хирургическое лечение ней-рососудистого синдрома грудного выхо-да//Хирургия.-1987.-№ 7.-С.1-4. Chamberlain J., Macpherson A. Cervico-dorsal sympatectomy for Raynauds syndrome// J.R. Coll. Surg. Edinb. - 1974. - Vol. 19. -P.228-234. Cristol R. Aquisitions resentes sur la physio-pathologic du phenomene de Raaynaud//Ga-zette Med. De France.-1981.-Vol.88.- P.107-113. Dorasio R., Ezzet F. Arterial complications of the thoracic outlet syndrome//Amer. J.Surg.— 1979.-VoU38.-P.246-250. Dzsinich С, Papp S., Szlavy L., Szflbo I. Arterial complication caused by rhoracic outlet syn-drome//XIII World Congress of the International Union of Angiology. — September 11— 16.-Rochester. USA, 1983.-P.121. Juvonen Т., Jarisatta, Laitala P. et al. Anomalies at the Thoracic Outlet Are Frequent in the General Population//Amer.J.Surg.—1995.— Vol.170, N 1.-P.33-37. Kieffer J., Jue-Denis P., Benhamou M. et al. 1983.-Vol.l09.-P.714-722. Lindgren K., Oksala I. Term outcome of Surgery for Thoracic Outlet Syndrome//Am-er.J.Surg.-1995.-Vol. 169, N 3.-P.358-360. Machleder H. Vaso-occkusive disorders of the upper estremity//Curr.problems in surg.— 1987.-Vol.153, N 5/6.-P.353-360. Machleder H., Wheeler Е., Barber W. Treatment of upper extremity ischemia by cervico-dorsal sympatectomy//Vasc. Surg.—1979. — Vol.13, N 6.-P.399-404. Melliere D., Becquemin J., Ettienne G. Les complications de la chirurgie defieles thoracocervi-cobrachiaux // J.Chirurgie.—1985.—Vol.122, N3. -P.151-158. Salo J., Varstela E., Ketonen P. et al. Management of vascular complications in thoracic outlet syndrome//Acta chir.scand.—1988.— Vol.154, N 5-6.-P.349-352. Scher L., Veith F., Haimovichi H. et al. Staging of arterial complications of cervical rib: Guidelines for surgical management//Surgery.— 1984.-Vol.95, N 6.-P.644-649. Sellke F., Kelly Th. Thoracic outlet syndro-me//Amer. J.Surg.-1988.-N 1.-P.54-57. Ангиодисплазии (мальформации; врожденные пороки сосудов) Первые упоминания, касающиеся ар-териовенозных соустий сосудов конечностей, относятся к XVIII в., когда в 1737 г. появились публикации В.Hunter, описавшего артериовеноз-ные фистулы. Одной из первых фундаментальных работ по врожденной сосудистой патологии является монография Trelat и Movod (1869), в которой авторы пришли к выводу, что заболевание, характеризующееся гипертрофией конечностей, варикозным расширением подкожных вен и капилляров, возникает вследствие врожденного нарушения развития сосудов. Muscatelo (1894) считал, что ге-мангиомы являются врожденными опухолями, возникшими из эндотелия кровеносных сосудов. В 1890 г. французские невропатологи Klippel и Trenaunay обнаружили у нескольких больных триаду симптомов: гипертрофию конечностей, врожденные пигментно-сосудистые пятна на коже, венозные эктазии на ограниченных участках пораженной конечности. В 1907 г. Weber опубликовал свои данные, объединив ранее описанный синдром Klippel и Тге- naunay в одну группу заболеваний ge-mangioectasia hypertrophica, подчеркнув тем самым сосудистый характер патологии, сочетающейся с тяжелыми трофическими нарушениями и гипертрофией больной конечности. В 1918 г. автор обнаружил у части таких больных наличие артериовеноз-ных аневризм. У нас в стране первые сообщения, посвященные изучению клиники и патогенеза этого заболевания, появились в 1928 г. С.Я.Рубашов установил, что наряду с гипертрофией конечности, наличием сосудистого невуса и флебэктазий по наружной поверхности конечности у больных имеется множество артериовенозных свищей. Автор предположил, что именно свищи являются причиной возникновения подобных нарушений, обозначенных термином "macrome-galia partialis congenita". Врожденные сосудистые заболевания довольно распространены. По данным D.A.Tue, H.J.Clause и др. (1963), в американской литературе имелись сообщения лишь о 200 больных с ангиодисплазиями сосудов. В своей монографии E.Malan, Pyg- lionizi (1974) описали 350 случаев ан-гиодисплазий. Ю.Ф.Исаков, Ю.А.Тихонов (1974) сообщают об опыте диагностики и лечения 152 больных, A.Van Der Stricht (1986) - 300 больных, St.Belov (1990) — 766 больных с ангиодисплазиями. В отечественной литературе наибольший клинический материал представлен в работе В.Н. Дана (1989), анализирующего опыт лечения 433 больных с ангиодисплазиями различной локализации. Этиология и патогенез ангиодисп-лазий. Этиология ангиодисплазий до сих пор остается не выясненной и мало изученной. Длительное время ангиодисплазий относили к опухолевым процессам [Петров А.П., 1931; Холдин С.А., 1935; Borst, 1924]. Ряд авторов выдвигают гипотезу возникновения ангиодисплазий вследствие травматических повреждений [Кита-ев В.И., 1950; Unna P.V., 1894]. По мнению G.W.Johnson и др. (1956), травма является как бы толчком в клиническом проявлении ангиодисплазий. В возникновении порока развития сосудов ряд авторов большое значение придают инфекционному процессу [Reinhoff W.G., 1974; Gebenar A., 1961], другие считают причиной возникновения ангиодисплазий хромосомные аберрации [До-лецкий С.Я., Тихонов Ю.А., 1967; Pyglionisi A., 1964]. Значительную роль в возникновении ангиодисплазий, по мнению ряда авторов, играет наличие в крови высокого уровня прогестерона и эстрогенов, которые выделяются во время беременности [Penlachs P., Vidal-Barraquer F., 1953; Alvares R., 1963]. Доказательством этого факта является то, что во время беременности и полового созревания наиболее ярко проявляются клинические признаки заболевания. Однако большинство авторов признают, что ангиодисплазий являются врожденными сосудистыми заболеваниями, возникшими в результате воздействия тератогенных факторов в эмбриогенезе. E.Malan (1974), J.F.Me-rlen и др. (1980) считают, что возник- шие изменения в какой-либо стадии эмбриогенеза приводят к образованию различных пороков развития сосудов. Известно, что зачаток сосудистой стенки первоначально образуется из ангиобластов, которые, соединяясь между собой, образуют капиллярную сеть, представляющую собой недифференцированную первичную сосудистую систему зародыша. В пределах этой сети происходит дифференциация на артериальные и венозные ветви, отличающиеся друг от друга различным направлением движения крови. В дальнейшем под влиянием генетических, локальных и гемоди-намических факторов, например направления распределения и давления крови, дифференцируется первичная капиллярная сеть. Часть капилляров подвергается обратному развитию, а из другой части сосудов с центростремительным направлением кровотока образуется венозная система. За этой стадией следует стадия образования окончательных сосудистых стволов, артерий и вен [Woolard, 1992] (рис. 7.96). Однако еще длительно существуют анастомозы между этими сосудами [Sabin, 1917]. По-видимому, в момент перехода сетеобразной стадии в петлевую из оставшихся между артериями и венами одного или нескольких каналов и образуются артерио-венозные фистулы, существующие уже во внеутробном периоде жизни [Malan, Piglionisi, 1955]. Приведенная концепция образования и развития врожденных нарушений сосудистой системы позволяет объяснить возникновение не только изолированной формы ангиодисплазий, но и происхождение сложных сочетанных пороков сосудов в зависимости от стадии эмбриогенеза. Однако до сих пор не ясно, почему в ряде случаев клинические признаки заболевания проявляются спустя значительное время после рождения. Нередко это бывает связано с ростом организма, гормональными пере- стройками, травмой, беременностью или интоксикацией. Большое значение в развитии заболевания имеют гемодинамические факторы, поскольку они осуществляют связь между системой циркуляции и патологически измененными сосудами. Постепенное нарушение гемодинамики приводит к снижению резистентности шунтов и к увеличению их диаметра [Holman G., Taylor J., 1952; Schlenk et al., 1960]. Вследствие извращенного регионального кровотока возникает хроническая венозная недостаточность, степень которой зависит от распространенности и длительности существования ангиодисплазии. Следует заметить, что извращенный кровоток в обширных ангиоматозных полостях поддерживается также и за счет гипо-коагуляции, характерной для этих больных, что препятствует тромбо-образованию, а иногда приводит и к развитию геморрагического синдрома [Хрущева И.А., Титова М.И., 1974; Kasabachi H.H., Merriti K.K., 1940]. Изменение трофики тканей является результатом нарушения региональной гемодинамики. Если вначале отмечается лишь истонченность артериальных стенок, то со временем в них происходят дегенеративные изменения с атрофией гладкомышеч-ных клеток, уменьшением эластичности ткани. Удлинение и извилистость проксимальной артерии также связана с гемодинамическими факторами. Сила, заставляющая ее вытягиваться вдоль ее большой оси, прямо пропорциональна градиенту продольного давления [Lamport H. et al., 1962; Ingebrigtsen R. et al., 1970]. Подобные изменения происходят и в проксимальной вене, где также имеет место расширение и варикозное уз-лообразование [Yothlin, Linstedt E., 1975]. При этом наблюдается не только неравномерное истончение стенок вены за счет пролиферации и фиброза интимы, но и дегенеративные изменения, приводящие к образованию аневризм. Процессы извра-
Рис. 7.96. Развитие сосудистой системы из примитивной капиллярной сети (по Woolard). а — аксиальная артерия; б — v.cephalica; в — каудальная вена; г — примитивная капиллярная сеть, подвергающаяся резорбции. щенного развития приводят к фрагментации и исчезновению внутреннего эластического слоя. Именно по этой причине неудачен термин "ар-териализация", часто применяемый при описании изменений, имеющих место в венозной стенке. По мере развития венозных коллатералей все большая часть потока крови направляется дистальнее по этой вене, которая в данном участке дегенеративно изменена, хотя в меньшей степени, чем проксимальная часть [Hoi R., 1961; Jamison J. et al, 1975]. У больных с длительно существующими артериовенозными свищами часто увеличены размеры сердца. Наличие такой зависимости было показано более 70 лет назад [Stewart F., 1913; Reid, 1925]. Увеличение объема сердца от должного колеблется в пределах от нескольких процентов у больных с малым, до почти 86 % у больных с большим свищом.
28 - 4886 Широко распространенные арте-риовенозные пороки, захватывающие самые разнообразные органы, также известны как причина, способствующая увеличению сердечного выброса и приводящая к развитию сердечной недостаточности (M.Coel, 1978). В результате нарушения региональной гемодинамики возникают различные дистрофические изменения органов и тканей местного характера. Н.И.Краковский и соавт. (1962), А.В.Покровский и соавт. (1969) считают, что гипертрофия конечности возникает как следствие утолщения и удлинения костей, так и в результате увеличения массы мягких тканей. Утолщение костей происходит за счет гиперстимуляции периоста, а удлинение за счет усиления кровоснабжения диафиза кости [Malan G., Pyglionesi A., 1965]. Некоторые авторы полагают, что гипертрофия конечности возникает в результате венозного стаза вследствие стимуляции ростковой зоны хряща и связана с нарушением взаимосвязи эндооста с периостом в результате хронической гипоксии при нарушенном венозном кровотоке [Horton В., 1932; Vanderheelf P. et al., 1963]. В дистальных отделах конечностей появляются признаки хронической венозной недостаточности с развитием венозной гипертензии, недостаточности клапанного аппарата всех вен и нарушением микроциркуляции в тканях в виде трофических расстройств, вплоть до развития трофических язв. При прямых артерио-венозных свищах ишемические изменения в дистальных отделах конечностей возникают в результате "обкрадывания", т.е. кровь в значительно меньших количествах поступает в капиллярное русло дистальных отделов мягких тканей. Морфология Артериовенозные ангиодисплазии. На этапе эмбрионального развития в период образования первичных капил- ляров возникают артериовенозные шунты. Часть из них на стадии обратного развития трансформируются под действием различных неблагоприятных факторов, в результате чего появляются фистулы, соединяющие артериальные и венозные сосуды различных калибров. J.Gius (1960) установил, что артериовенозные свищи влияют на морфологическую структуру сосудистой стенки. Вначале вена приспосабливается к имеющейся гипертензии путем утолщения мы-шечно-эластичных элементов средней оболочки, затем наступают расширение ее стенок и недостаточность клапанного аппарата. В результате возникают нарушения в капиллярах, что приводит к нарушению клеточного метаболизма. В стенке вены развивается склеротический процесс, в средней ее оболочке разрастаются коллагеновые волокна, пронизывающие мышечную основу и достигающие склерозиро-ванной адвентициальной оболочки, интима утолщается. В начальной стадии заболевания наблюдается значительное утолщение стенки артерии за счет выраженного развития продольных пучков гладкомышечных волокон. В дальнейшем стенка артерии теряет эластичность, истончается, становится извитой; происходит разво-локнение внутренней эластичной мембраны, уменьшается количество мышечных волокон. Стенка свища, соединяющего артерию и вену, представляет собой склерозированную артерию. При наличии ангиоматоза мягких тканей образуются сосудистые каверны, состоящие из артериальных и венозных сосудов. Дистальнее артериовенозного свища в артериальной стенке значительно уменьшается количество эластичных и мышечных волокон (Holman E., 1962). Венозные ангиодисплазии. Изменения в стенках вен при венозной ангиодисплазии практически соответс- твуют изменениям венозной стенки при артериовенозной форме ангио-дисплазии. При венозно-кавернозном ангиоматозе стенка вен резко истончается, в мягких тканях обнаруживается множество каверн с разрушением окружающих мягких тканей. Лимфангиоматоз. При лимфангио-матозе развиваются изменения в окружающих тканях в виде дистрофических нарушений мышечных волокон, подкожной клетчатки, кожи. Лимфатические сосуды резко расширяются, стенки истончаются с образованием лакун. Классификация Наиболее удачные классификации, созданные А.В.Покровским, Ю.Д.Москаленко (1969, 1971), E.Malan, Puglio-nisi (1974), Ю.Ф.Исаковым, Ю.А.Тихоновым (1974), А.П.Миловановым (1978), основаны на клинико-мор-фологическом подходе к концепции разделения ангиодисплазий в зависимости от доминирующего сосудистого компонента. Классификация, предложенная В.Н.Даном (1989), дает возможность сформулировать четкий диагноз, выбрать оптимальную хирургическую тактику. I. Артериальная форма 1. Аплазия артерий. 2. Гипоплазия артерий. 3. Врожденные аневризмы артерий. II. Венозная форма а) аплазия, гипоплазия, странгуля б) врожденная клапанная недоста в) флебэктазия. Поражение поверхностных, мышечных и органных вен: а) стволовая флебэктазия (варикоз б) ангиоматоз (ограниченный, диф — поверхностный (капиллярный сосудистый невус); — глубокий — кавернозный; — органный кавернозный. III. Артериовенозная форма. 1. Артериовенозные свищи: а) макрофистулезная форма; б) микрофистулезная форма; в) в сочетании с кавернозным IV. Лимфатическая форма. 1. Аплазия, гипоплазия, лимфэк-тазия. 2. Лимфангиоматоз: а) ограниченный; б) диффузный; в) органный. Диагностика Диагностика ангиодисплазий в первую очередь основана на данных анамнеза и внешних клинических признаках. Установить диагноз ангиодисплазий в большинстве случаев несложно, за исключением, когда поражены внутренние органы. По данным Ю.Ф.Исакова и соавт. (1974), у 53,2 % детей с ангиодиспла-зиями заболевание выявляется с рождения, а к 7 годам — у 86,8 %. По данным В.Н.Дана (1989), у 92,4 % больных возникновение заболевания отмечено с рождения. Артериовенозные ангиодисплазий конечностей (клиническая симптоматика). Одним из частых признаков, сопровождающих ангиодисплазий, является болевой синдром, который возникает вследствие компрессии нервных стволов [Москаленко Ю.Д., 1970]. По данным автора, болевой синдром встречается у 83,7 %, по данным Г.М.Пивоваровой (1973) — у 79,7 % больных. Другим частым проявлением ангиодисплазий является изменение
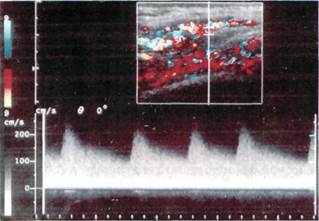
28* окраски кожи. По данным А.А.Шалимова и соавт. (1982), эти изменения отмечаются у 56,9 %, по данным В.Н.Дана (1989) - у 67,9 % больных. Большое число больных отмечают, что у них пораженная конечность длиннее контралатеральной, что приводит к нарушению осанки, деформации позвоночника. По данным Г.М.Пивоваровой (1973), этот симптом встречается у 67 % с артериове-нозными свищами нижних конечностей. В результате артериовенозного сброса и увеличения венозного давления, а также недостаточности клапанного аппарата у 42—59 % больных развивается варикозное расширение вены конечностей [Цыгельников С.А., 1997]. Достаточно часто у больных при артериовенозной форме ангиодисп-лазии с поражением дистальных отделов конечностей вследствие гипоксии тканей развиваются трофические язвы: по данным Ю.Д.Москаленко (1970) — у 12,9 % больных, по сообщению В.Н.Дана (1989) - у 16,5 % пациентов. Кроме того, практически у всех этих больных возникают рецидивирующие кровотечения из трофических язв, вплоть до профузных. Важным методом в дифференциации макро- и микрофистулезных форм ангиодисплазии является аус-культация над пораженными магистральными сосудами. Ю.Д.Москаленко (1970) у 37,7 % больных выявил систолический или систолодиасто-лический шум над областью ангиодисплазии. Однако при макрофистулезной форме артериовенозной ангиодисплазии эти симптомы встречаются, по сообщению В.Н.Дана (1989), у 100 % больных. Кроме того, локальная гипертермия встречается у 100 % при макрофистулезной форме и у 23 % больных при микрофистулезной форме поражения. При рентгенологическом исследовании пациентов с артериовенозны-ми ангиодисплазиями выявляются выраженные изменения в малом круге кровообращения с увеличением размеров сердца у 50 % больных. Наибольшие изменения в сердце имеются при локализации свищей в области шеи и верхних конечностей [Иваницкая М.А., Москаленко Ю.Д., Рушанов И.И., 1970]. Ю.Д.Москаленко (1970) на основе результатов исследований гемодинамики методом радиокардиографии с альбумином-131 показал изменение кровотока по большому кругу кровообращения в сторону увеличения его, а также получил данные, свидетельствующие об увеличении ОЦК, что в свою очередь приводит к гипертрофии миокарда и дилатации полостей сердца. Обычная рентгенография мягких тканей и костей при различных формах ангиодисплазии дает ценную диагностическую информацию. Наиболее часто обнаруживают очаговый или диффузный остеопороз, иногда (при артериовенозных ангио-дисплазиях) — гипертрофию и удлинение костей конечностей [Malan Е., 1965; Cabaabe E., 1985] в 40 % случаев. Ультразвуковое исследование может быть основным в постановке диагноза. С помощью УЗИ исследуют магистральные артерии и вены с определением их анатомического хода и расположения с последующим расчетом диаметра и показателей гемодинамики. Исследуют состояние мягких тканей, сосудов [Кунцевич Г.И., Ку-сова Ф.У., 1999]. Ультразвуковая допплерография (УЗДГ). В 1971 г. S.Sabris, L.Cotton сообщили об использовании УЗДГ в определении периферических артериовенозных свищей. В 1981 г. A.Stella, L.Petrini выделили при УЗДГ 3 группы признаков: • морфологические (форма волны в зависимости от расположения датчика — над артерий, веной, областью артериовенозной фистулы; • количественные — определение непосредственной и средней скорости кровотока; • акустические, связанные с распределением частотных интервалов и полученные в зависимости от расположения датчика. Определение сегментарного АД позволяет определить и локализовать зону артериовенозного сброса, поскольку систолическое АД увеличивается проксимальнее гемодинамически значимой зоны AV-сброса и снижается или остается нормальным дисталь-нее ее по сравнению со здоровой конечностью [Rutherford R., 1990]. Использование цветного доппле-ровского картирования (ЦДК) и импульсной допплерографии (ИД) позволяет диагностировать ангиоматоз-ные массы, представленные конгломератом сосудов различного калибра — от 1,2 до 2,9 мм в диаметре с венозным (ЛСК 0,03—0,467 м/с) и артериальным (ЛСК 0,28—0,67 м/с) характером кровотока и преобладанием последнего при артериовеноз-ной ангиодисплазии. Характерным признаком артериального кровотока является наличие высокой диастолической скорости кровотока — от 0,2 до 0,43 м/с. Подобная картина свидетельствует о ги-перваскуляризации тканей [Кусова Ф.У., 1998]. УЗИ в режиме ЦДК и ИД позволяет определить вовлечение в процесс как кожи, подкожной клетчатки, так и мышц. Дуплексное сканирование (ДС) демонстрирует увеличение размеров артерий и вен с записью патологического спектра кровотока [Partsch H., 1990]. Определение объемной скорости кровотока и ЛСК с помощью ДС до и после лечения использовали В.Н.Дан (1989), W.Jares (1990). Авторы указывают на повышение этих показателей (на 100—300 %) в зависимости от величины артериовенозного сброса. По данным Ф.У.Кусовой (1998), УЗ-сканирование в реальном масштабе времени в В-режиме, режиме цветного допплеровского картирования и/или энергии отраженного допплеровского сигнала в сочетании с анализом спектра допплеровского сдвига частот позволяет неинвазивно диагностировать ангиодисплазию конечностей, определить и детализировать форму заболевания, регистрировать количественные показатели гемодинамики в исследуемых сосудах, выявить степень распространенности процесса в мягких тканях и костных структурах, а также определить состояние центральной гемодинамики по данным эхокардиографи-ческих исследований (рис. 7.97). Эхокардиография. По данным Г.И.Кунцевиц, Ф.У.Кусовой (1999), при артериовенозной ангиодисплазии объемная перегрузка артериального русла коррелирует с достоверным уве-
Рис. 7.97. Турбулентный кровоток в проекции артериовенозного ангиома-тоза, регистрируемый при дуплексном сканировании.
Рис. 7.98. Сеть расширенных сосудов в проекции ангиоматоза. личением показателей минутного объема кровотока. У больных с артериовенозными ангиодисплазиями конечностей отмечено увеличение показателей центральной гемодинамики — минутного объема кровообращения на 88 %, сердечного индекса — на 90 %, ударного выброса — на 30 % (Кусова Ф.У., 1998). Радиоизотопное определение степени артериовенозного шунтирования. 06 использовании микросфер альбу 7 %, при микрофистулезной форме Для окончательной диагнос
|
|||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 987; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.134.165 (0.014 с.) |