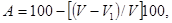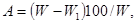Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Система контроля качества комбикормовСодержание книги
Поиск на нашем сайте
[29, 63] Промышленный выпуск комбикормов для рыб определил необходимость системы контроля их качества. Цель системы - обеспечение сохранности питательной ценности компонентов и самих комбикормов, выявление их недоброкачественности, которая может вызывать не только паталогические изменения в организме рыб, но и их гибель. Система основана на ряде разных по природе показателей, изложенных в НТД на комбикорма, и входящие в них компоненты: · антипитательные факторы, возникающие при дисбалансе основных групп питательных веществ (белки, жиры, углеводы), а также незаменимых аминокислот, витаминов, макро- и микроэлементов; · токсические факторы (присутствие токсинов плесневых грибов и других микроорганизмов, в том числе возбудителей болезней, токсинов из растительного сырья, сельскохозяйственных ядохимикатов, соединений тяжелых металлов, продуктов окисления жиров и т.д.); · факторы технологической природы (тонина помола исходных компонентов, водостойкость частиц корма, их размерность, крошимость и т.д.). В системе выдерживается следующая очередность операций: - входной контроль качества поступающего сырья; - технологический контроль процессов производства комбикормов; - контроль качества выработанных комбикормов на выходе, при отправке их в рыбхозы; - контроль качества комбикормов при поступлении в рыбоводные хозяйства, а также непосредственно перед скармливанием рыбам. Все корма обычно имеют специфический запах основного сырья. Недопустимы даже малейшие признаки затхлости или гнилости. Влажность каждого вида кормов или их компонентов не должна превышать величины, указанной в прилагаемом к каждой партии сертификате. Жмыхи и шроты масличных культур должны также быть без гнилостного запаха, примесей. Зерновые культуры, в первую очередь пшеница, ячмень, рожь, должны быть сухими и не зараженными вредителями злаковых культур. Учитывая, что кормление рыб проводится в воде, при определении качества гранулированных кормов, наряду с внешними признаками, необходимо исследовать их водостойкость. Обычно водостойкость определяют по скорости набухания гранул, интенсивности их размывания и экстрагирования питательных веществ. Скорость набухания или скорость размягчения гранулированного корма оценивают как объемным так и весовым методами. При объемном методе определения частичного набухания гранул берут три параллельных пробы по 10 шт. для каждого интервала времени. До начала исследования гранулы каждой пробы измеряются штангенциркулем с точностью до 0,1 мм для определения их среднего объема и погружаются в сосуды с водой. Желательно, чтобы объем воды в сосудах превышал объем гранул не менее, чем в 10 раз. Длительность опытов определяется поставленными задачами. Для практических целей набухание гранул целесообразно проводить в течение 0,5; 1; 2; 3 часов. По окончании каждой экспозиции опытные гранулы с помощью пинцета извлекают из сосудов и скальпелем снимают набухшую часть корма. Сохранившуюся часть гранул измеряют тем же методом и вычисляют среднюю величину. Затем по разности определяют скорость набухания в процентах к первоначальной величине. Расчет набухания проводят по следующей формуле:
где: А — скорость набухания, %; V — первоначальный объем гранул, мм3; V1 — конечный объем гранул, мм3. Это же уравнение после некоторых преобразований будет иметь следующий вид:
где: d — первоначальный диаметр гранул, мм; d1 — конечный диаметр гранул, мм; h — первоначальная длина гранул, мм; h1 —конечная длина гранул, мм. При использовании весового метода рекомендуется исследовать две параллельные пробы по 10 гранул для каждого интервала времени. До начала экспозиции определяется средняя масса каждой пробы, которые затем погружаются в сосуды с водой. Через определенное время каждая группа проб извлекается из воды, гранулы очищают от набухшей части, доводят до постоянной массы и определяют среднюю массу каждой пробы. Скорость набухания определяют по абсолютной сухой массе следующим уравнением:
где: W — средняя начальная масса, кг/ч; W1 — средняя конечная масса, мг Полное набухание гранул рекомендуется определять с момента их погружения в воду до полного размягчения. С этой целью подготавливают ряд параллельных проб по 10 гранул в каждой, и по двум-трем пробам выявляют приблизительное время полного набухания. Затем закладывают полную серию проб и примерно за 25—30 мин. до ориентировочного времени, через каждые 5 мин., определяют время полного набухания. Момент полного набухания определяют путем слабого нажатия острием препаровальной иглы на вертикально установленные гранулы. Интенсивность размывания гранулированного корма определяют тем же методом, что и скорость полного набухания. Этот метод позволяет определять механическую прочность гранул в набухшем состоянии. Полное размывание определяют по деформации гранул исследуемого корма, при этом происходят не только механические потери, но и экстрагирование питательных веществ. Длительность процесса обычно фиксируют визуальными наблюдениями. Интенсивность экстрагирования питательных веществ определяют по пробам исследуемого корма, которые извлекают из воды через определенные промежутки времени и подвергают химическому анализу. Опыты проводят в стеклянных сосудах, объем которых должен не менее чем в 50 раз превосходить пробу исследуемого корма. Для исследования берут из среднего образца не менее трех проб средней массой каждая около 100 г. Затем две параллельные пробы помещают в сосуды с водой и отмечают время. Третью пробу используют для получения первоначальных данных по исследуемым химическим ингредиентам. Через заданное время воду из сосудов сливают, затем осторожно извлекают и подсушивают (следует избегать механических потерь) пробу. В подсушенном образце определяют потери по разнице между массой пробы в начале и конце опыта, а также содержание соответствующих химических компонентов по общепринятым методикам. Расчеты рекомендуется проводить по следующей формуле:
где: A — потери исследуемого вещества к исходному содержанию, %; a — исходная масса корма, г; a1 — масса корма после экспозиции, г; b — исследуемое вещество в исходной пробе, %; b1 — исследуемое вещество в конечной пробе, %. Влажность корма — весьма важный показатель оценки качества, так как увеличение влажности ускоряет процесс порчи любых видов кормов. Сущность метода определения предусматривает подготовку и проведение испытания. При подготовке к испытанию на железном листе нагревают хлористый кальций до получения жидкой массы. Затем после испарения воды его прокаливают до получения сухого вещества, которое разбивают на куски нужной величины и помещают в банку с притертой пробкой. Затем для проведения испытания в предварительно высушенные до постоянной массы бюксы берут две пробы исследуемого продукта (около 5 г каждая), взвешенные с точностью до 0,01 г. Исследуемуемый корм тонким слоем рассыпают по дну бюкса. Открытые бюксы вместе с крышками помещают в предварительно нагретый до температуры 130 + 20С электросушильный шкаф. Высушивание проводится в течение 40 минут, считая с момента фиксации температуры. Через 40 мин. бюксы вынимают из сушильного шкафа тигельными Гранулированные корма рекомендуется хранить в специальных производственных складских помещениях в мешках или насыпью. При таких условиях гранулы могут храниться до двух месяцев, а в отдельных случаях и более длительное время. Особенно благоприятно сказывается на сроках хранения кормов применение различных антиокислителей. Так как прежде всего окислению подвергаются жиры, то и действие антиокислителей направлено на предупреждение этих процессов. В нашей стране в качестве антиокислителей для пищевых целей разрешены следующие: бутилоксианизол (БОА); бутилокситолуол (ионол, БОТ); додецилгаллат (ДГ); аскорбиновая кислота (витамин С). В качестве кормовых антиокислителей рекомендуется сантохин и дилудин, анфелан. Введение указанных антиокислителей (0,02% к массе кормовой смеси) способствует увеличению срока хранения кормов. Отмечено, что смесь антиокислителей в силу эффекта синергизма оказывает более сильное стабилизирующее действие на окислительные процессы. Однако несмотря на применение антиокислителей, через определенное время жиры окисляются, и корма становятся непригодными для использования в кормовых целях. Для выявления качества корма по величине окисленного жира согласно ГОСТу 8285—74 определяют перекисное и кислотное числа. Если перекисное число не превышает 0,3% йода, а кислотное 30 мг КОН, такие корма можно использовать для кормления рыб. При более высоких значениях указанных показателей корма становятся непригодными для дальнейшего использования. Перекисное число оценивается по количеству йода, выделенного из йодистого калия перекисными соединениями, содержащимися в 100 г жира (%). Кислотное число определяется по количеству едкого калия, израсходованного для нейтрализации свободных жирных кислот, содержащихся в одном грамме жира. Определение перекисного числа основано на реакции окисления йодисто-водородной кислоты водородом, выделяющимся при разложении перекиси в кислой среде. Кислотное число определяется методом титрования, основанным на нейтрализации свободных жирных кислот раствором щелочи. Для определения перекисного и кислотного чисел требуются следующие реактивы: хлороформ (х. ч.); уксусная кислота ледяная (х. ч.); йодистый калий (насыщенный на холоду водный раствор готовится перед применением); дистиллированная вода; крахмал (1%-ный водный раствор); натрий серноватисто-кислый (0,002 н); бензол безводный; этиловый спирт; спиртовой раствор едкого калия (КОН 0,1 н готовится за день до применения); спиртовой раствор фенолфталеина (1%). П о с у д а. Банки с притертой пробкой емкостью 0,5 и 1 л. Стаканы химические на 50, 100 и 200 мл. Колбы конические с притертыми пробками на 500 мл. Бюретки на 50—100 мл. Мензурки мерные на 100 мл. Воронки диаметром 5 и 9 см. Цилиндры мерныена10 и 100 мл. Пипетки градуированные на 1 и 3 мл. Стеклянные палочки. Химические бумажные фильтры. Марля. Весы аналитические и штатив железный с лапками. А н а л и з. Для проведения анализа следует с помощью хлороформа извлечь жир из исследуемого корма. Для этого 250—300 г корма помещают в банку емкостью 0,5 л, заливают хлороформом до полного смачивания гранул 6—8 ч. Затем отцеживают через чистую 4-слойную марлю хлороформ с извлеченным жиром. После этого его фильтруют через бумажный складчатый фильтр в химический стакан. Полученный экстракт наливают в предварительно взвешенные на аналитических весах стаканы на 50 мл с таким расчетом, чтобы после испарения хлороформа в них осталось около 0,2 — 0,4 г жира для определения перекисного числа и около 1—2 г жира для определения кислотного числа. На каждую пробу должно быть не менее 5 стаканов с жиром. После полного испарения хлороформа стаканы с жиром взвешивают и по разности массы (стакан с жиром минус стакан без жира) определяют пробу жира. Определение перекисного числа начинается с того, что в стакан с пробой жира (0,2—0,4 г) наливают по 30 мл смеси хлороформа с ледяной уксусной кислотой (приготовленной из равных частей компонентов) и при помешивании стеклянной палочкой растворяют жир. Раствор без потерь переносят в коническую колбу с притертой пробкой. Затем в колбу добавляют 1 мл насыщенного водного раствора йодистого калия, закрывают пробкой и смесь тщательно перемешивают. При этом не должно происходить нарушения гомогенности растворов, в противном случае увеличивают количество растворяющей смеси. Раствор выдерживают в течение 20 мин. без света. После этого содержимое колбы разбавляют 50 мл дистиллированной воды и приливают 3 мл 1%-ного раствора крахмала. Выделившийся йод оттитровывают 0,002 н раствором серноватистокислого натрия. Одновременно в тех же условиях проводится контрольный опыт. Перекисное число (ПЧ) определяют по следующей формуле:
где: V1 — количество 0,002 н раствора серноватокислого натрия, пошедшее на титрование выделившегося йода в основном опыте, мг; V0 — количество 0,002 н раствора серноватистокислого натрия, пошедшее на титрование в контрольном опыте, мг; 0,02538 — титр 0,002 н раствора серноватнстокислого натрия, выраженный по йоду и умноженный на 100; r — поправка к титру 0,002 н раствора серноватокислого натрия; Р — проба жира, г. Такие вычисления производят для каждого из пяти образцов жира. Затем вычисляют среднюю величину, которая и будет показателем перекисного числа исследуемого корма. Определение кислотного числа производят в стаканах с пробой (1—2 г) жира, экстрагированного из исследуемого корма. В каждый из таких стаканов наливают по 50 мл предварительно нейтрализованного бензола и растворяют жир. Раствор без потерь переносят в конические колбы с притертыми пробками и титруют 0,1 н спиртовым раствором КОН в присутствии фенолфталеина до розового (красноватого) цвета, не исчезающего в течение 10 секунд. Кислотное число (КЧ) жира (мг КОН) вычисляют по следующей формуле:
где: V — количество 0,1 и. раствора КОН, израсходованное при титровании, мг; 5,611 — титр 0,1 н. раствора КОН; r — поправка к титру 0,1 и. раствора КОН; P — проба жира, г. Средняя величина кислотного числа вычисляется из пяти исследованных проб. Определение токсичности комбикорма по биопробе на инфузориях стилонихиях (экспресс-метод ВНИРО). Метод основан на извлечении из исследуемых продуктов различных фракций токсических веществ ацетоном и последующем воздействии водных растворов этих фракции на инфузории стилонихии. Аппаратура, материалы, реактивы. Весы лабораторные 4-го класса точности, мельница лабораторная марки МРП-2 или других аналогичных марок, микроскоп бинокулярный стереоскопический с увеличением 2 Х 8 марки МБС, фильтр мембранный № 6, шкаф сушильный, блок микроаквариумов луночных, колбы конические исполнения 2 (с прошлифованными пробками) вместимостью 50—100 см3, стаканы химические вместимостью 100 см3, шприц медицинский многократного использования, пипетки исполнения 2, вместимостью 10 и 15 см3 или исполнения 6, 7 вместимостью 25 см3,пробирки исполнения 2 (с пришлифованными пробками) вместимостью 25 см3, пробирки вместимостью 5 см3, пипетки пастеровские, чашки Петри, штатив для пробирок, часы песочные на 2 мин., дрожжи пекарские прессованные, бумага фильтровальная, карандаш по стеклу, сито лабораторное с отверстиями диаметром 0,5 мм, культура инфузорий стилонихий, ацетон. Изготовление блока луночных микроаквариумов. Блок луночных микроаквариумов изготовляют из пластин органического стекла размером 15х9х1,3 см. В пластине высверливают с последующей полировкой 5 рядов по 10 лунок. Диаметр каждой лунки 1,2 см — верхний, 0,8 см — нижний, глубина - 0,7 см. Рабочий объем каждой лунки 0,4 см3 (рис. 10). Чашки Петри, блоки микроаквариумов моют мыльным раствором и ополаскивают водопроводной проточной водой. Блоки из оргстекла сушат только на воздухе, чашки Петри прокаливают в сушильном шкафу при температуре 150—180°С. Не допускается использование посуды и проведение испытаний в помещениях, предназначенных для проведения химических анализов. Культуру инфузорий стилонихий приобретают в лаборатории прикладной физиологии и токсикологии Всесоюзного научно-исследовательского института рыбного хозяйства и океанографии. Транспортируют в стеклянной посуле вместимостью 50—100 см3, не допуская перегрева и переохлаждения. Период акклиматизации к лабораторным условиям составляет 24 ч. Средой для культивирования стилонихий является водопроводная вода, которую отстаивают в закрытых ватным тампоном колбах в течение 1 недели и стерилизуют нагреванием в кипящей водяной бане в течение 1 ч.
Рис. 10. Блок луночных микроаквариумов Приготовление корма для инфузорий. Свежие пекарские прессованные дрожжи массой около 50 г измельчают и высушивают до постоянной массы в бытовом холодильнике. Хранят вчистой банке с притертой пробкой. Срокхранения — 12 мес. Культивируют стилонихию в чашке Петри, используя в качестве корма сухие пекарские дрожжи в количестве около 0,003 г во время посева культуры. Пересев культуры проводят 2 раза в неделю. При пересадке инфузории носик пипетки необходимо вносить непосредственно в водную среду, находящуюся в чашке Петри. Приготовление среды для культивирования инфузорий (культуральной среды) Культивирование проводят при комнатной температуре 18— 28°С и естественном освещении, избегая прямых солнечных лучей. Допускается в случае низкой комнатной температуры использовать лампу дневного света, устанавливая ее сверху на расстоянии 1 м от стола, на котором находится стилонихия. Для поддержания необходимой температуры лампу вместе с чашками Петри со стилонихией накрывают полиэтиленовой пленкой (подобие теплички). Подготовка пробы для испытаний. Среднюю пробу исследуемого продукта измельчают и просеивают через сито с отверстиями диаметром 1 мм. Навеску исследуемого продукта массой 10 г помещают в пробирку с пришлифованной пробкой вместимостью 25 см3, заливают ацетоном в количестве (в зависимости от вида испытуемого продукта), указанном в табл. 1, и экстрагируют при энергичном встряхивании в течение не менее 2 мин. Пробирку помещают в штатив и дают отстояться в течение 15 минут. При необходимости допускается увеличивать количество ацетона, но не более чемна 2 см3 (при высокой разбухаемости исследуемого продукта и невозможности получения отстоявшегося экстракта в нужном количестве) и вновь экстрагируют в течение 2 минут. Экстракт в количестве 0,5 см3 осторожно отбирают при помощи длинной иглы шприцем и переносят в химический стакан с отстроенной в течение одной недели и декантированной водой комнатной температуры. Количество воды в стакане для различных видов испытуемого продукта указано в табл. 68. Экстракцию сырья с малым удельным весом (мучку, отруби) следует проводить в конических колбочках вместимостью 50— 100 см3 с пришлифованными пробками, а отстоявшийся в них экстракт для удобства отбора шприцем переливают в пробирку вместимостью 5 см3, дают отстояться еще в течение 5 мни, а затем 0,5 см3 экстракта переносят также в химический стакан с водой.
Таблица 69
Подготовка тест-организмов Для биотестирования используют суточную культуру инфузорий. Для этого инфузории за сутки до постановки опыта в массе пересаживают на новую среду с кормом (на 25 см3 среды — не более 0,003 г пекарских сухих дрожжей, избыток корма может привести к гибели инфузорий) и культивируют при температуре 24—26°С. При этом инфузории концентрируются вокруг корма. Проведение испытания Для исследования одного образца корма используют пять повторностей (пять микроаквариумов). Пересадку и подсчет инфузорий проводят под микроскопом при увеличении 2х8. Отбирают пастеровской пипеткой инфузории, сконцентрированные вокруг корма в чашке Петри, и вносят их в каждый микроаквариум по одной капле. При этом в каждый микроаквариум должно попасть от 10 до 20 шт. инфузорий. Просматривают под микроскопом численность инфузорий в каждом микроаквариуме, и, если их слишком много в одном и недостает в других, то инфузории более-менее равномерно распределяют в микроаквариумах той же пипеткой. После распределения инфузорий в каждый микроаквариум другой пастеровской пипеткой вносят по две капли пробы для биотестирования. Через 5 мин подсчитывают инфузории в каждом микроаквариуме и заносят их численность в журнал. Травмированные инфузории при подсчете не учитывают. После подсчета инфузорий объемы содержимого в микроаквариумах доводят до 1/2 их вместимости внесением той же пробы, и регистрируют время в журнале. При внесении экстракта исследуемой пробы в микроаквариумы следует носик пипетки вытирать ваткой во избежание попадания в микроаквариумы жира с наружной стороны пипеток. Параллельно, с целью определения качества ацетона и воды, проводят контрольный опыт. Для этого также в пять микроаквариумов помещают вышеуказанным способом инфузории и доводя каждый микроаквариум водным раствором ацетона с массовой долей 1 % до его вместимости. Численность инфузорий в каждом аквариуме регистрируют в журнале. Через (1ч) экспозиции вторично подсчитывают численность инфузории. Инфузории в контроле должны остаться живыми. В случае токсичности продукта инфузории в опыте подвергаются распаду - лизису. Количество погибших (лизированных) организмов зависит от степени токсичности корма. Степень токсичности исследуемого продукта определяют по выживаемости инфузорий через 1 ч экспозиции в вытяжке исследуемого продукта. Выживаемость инфузорий (N) в процентах вычисляют по формуле:
где N2 - среднее арифметическое (из пяти повторностей) количество инфузорий через 1 ч экспозиции, шт.; N1 – среднее арифметическое (из пяти повторностей) количество инфузорий в начале опыта, шт. Степень токсичности исследуемого продуктаопределяют по табл. 69.
Таблица 69
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 1843; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.185.207 (0.01 с.) |