Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Динамическое состояние белков в организме. Катепсины.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Динамическое состояние белков в организме. Катепсины.
Белки тканей организма постоянно обновляются, то есть подвергается распаду, и постоянно замещаются вновь синтезированными белками. Период полуобмена белков в таких тканях как кровь, слизистая кишечника, печень составляет приблизительно 10 дней. В таких тканях, как кожа, мышцы период полуобмена белков более продолжителен,
Распад тканевых белков (катаболизм) осуществляют особые тканевые протеолитические ферменты катепсины. Выделяют несколько их видов, которые обозначают буквами А, В, Д, Н, N. Катепсины локализованы как в лизосомах, так и в цитозоле. Лизосомальные катепсины называются кислыми катепсинами, так как оптимум рН для них равен 4,5-5,5. Катепсины могут относиться как к эндопептидазам, так и к экзопептидазам. В активном центре катепсинов могут присутствовать цистеин, аспарагиновая кислота, серин. Биологическая роль катепсинов:
Пищевые белки как источник аминокислот. Переваривание белков.
Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот в крови в среднем 35-65 мг/дл. Большая часть входит в состав белков, масса которых во взрослом организме 15 кг. В организме в сутки распадается на аминокислоты 400 грамм белка, столько же синтезируется. Для поддержания баланса необходимо 30-50 г в сутки, при физической нагрузки 100-120 г в сутки.
95-97% белков пищи всасываются в виде АК.Пептидазы ЖКТ поэтапно расщепляют пептидные связи белковой молекулы до конечного продукта гидролиза белков- АК,При гидролизе происходит разрыв СО-NН связи.
Протеиназы желудочно-кишечного тракта, субстратная специфичностьпротеиназ.
Переваривание происходит под действием протеаз - пептидгидролаз. Протеазы, гидролизирующие пептидные связи внутри молекулы - эндопептидазы, концевые аминокислоты - экзопептидазы.
Специфичность действия протеаз. Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот. Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды. В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Эндопептидазы (эндопротеиназы) — протеолитические ферменты (пепсин, трипсин, химотрипсин), расщепляющие пептидные связи внутри пептидной цепи. С наибольшей скоростью ими гидролизуются связи, образованные определёнными аминокислотами.
Экзопептидазы, их роль в переваривании белков.
Экзопептидазы (экзопротеиназы) ферменты, гидролизующие белки, отщепляя аминокислоты от конца пептида: карбоксипептидазы — от C-конца, аминопептидазы — от N-конца, дипептидазы расщепляют дипептиды. Экзопептидазы синтезируются в клетках тонкого кишечника (аминопептидазы, дипептидазы) и в поджелудочной железе (карбоксипептидаза). Функционируют эти ферменты внутриклеточно в кишечном эпителии и, в небольшом количестве, в просвете кишечника.
Экзопептидазы отщепляют концевые амикислоты, освобождая их от бремени пептидной связи, VIVA LA RESISTANCE!!!
Протеиназы поджелудочной железы. Панкреатит.
В тонком кишечнике продолжаются процессы переваривания и дело протеиназ живет. Затем всё всасывается через эпителий кишечника в кровь.
Диагностическое значение биохимического анализа желудочного и Дуоденального соков.
Желудочный сок — сложный по составу пищеварительный сок, вырабатываемый различными клетками слизистой оболочки желудка. Желудочный сок содержит соляную кислоту и ряд минеральных солей, а также различные ферменты, главнейшими из которых являются пепсин, расщепляющий белки, химозин (сычужный фермент), створаживающий молоко, липаза, расщепляющая жиры. Составной частью желудочного сока является также слизь, играющая важную роль в защите слизистой оболочки желудка от раздражающих веществ, попавших в него; при высокой кислотности желудочного сока слизь нейтрализует ее.Кроме соляной кислоты, ферментов, солей и слизи, в желудочном соке содержится также особое вещество - внутренний фактор Касла. Это вещество необходимо для всасывания витамина В12 в тонких кишках, что обеспечивает нормальное созревание красных кровяных телец в костном мозге. При отсутствии фактора Касла в желудочном соке, что обычно связано с заболеванием желудка, а иногда с его оперативным удалением, развивается тяжелая форма малокровия. Анализ желудочного сока является очень важным методом исследования больных с заболеваниями желудка, кишечника, печени, желчного пузыря, крови и пр
Низкая кислотность - симптом гастрита. Повышенная кислотность - изжога, диарея, симптом язвы.
Желудочно-кишечного тракта.
Выбирайте тот тип гормонов, который вам нравится больше всего и поведайте о нем на итоговой!
Биологическое значение.
Наиболее активно происходит дезаминироание глутаминовой кислоты, процесс катализирует фермент глутаматдегидрогеназа, ну а верный ассистент - кофермент это НАД+. Реакции идет в 2 этапа. Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент- олигомер из 6 субъединиц. Играет важную роль, т.к. является регуяторным ферментом аминокислотного обмена. Биологическая роль - регуляторным ферментом аминокислотного обмена.
Глутаматдегидрогеназа.
ЭТО ЕСТЬ обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование α-кетоглутарата. Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц. Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Синтез глутаматдегидрогеназы может индуцироваться стероидными гормонами (кортизолом).
Логическая роль.
Большинство аминокислот не способно де-заминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглу-тарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования.
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: амино-трансферазы (кофермент ПФ) и глутаматдегид-рогеназы (кофермент NAD+). Значение этих реакций в обмене аминокислот очень велико, так как непрямое деза-минирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты.
Образование серотонина и гистамина. Роль аминов.
Серотонин - биологическое активное вещество широкого спектра действия. Стимулирует сокращение гладкой мускулатуры, оказывает сосудосоуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием.
Гистамин образуется путём декарбоксилиро-вания гистидина в тучных клетках соединительной ткани Выполняет в организме человека следующие функции: • стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона); • повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль); • сокращает гладкую мускулатуру лёгких, вызывает удушье; • участвует в формировании воспалительной реакции - вызывает расширение сосудов, покраснение кожи, отёчность ткани; • вызывает аллергическую реакцию; • выполняет роль нейромедиатора; • является медиатором боли.
Образование катехоламинов и ГАМК, функции аминов.
Катехоламины прямо или косвенно повышают активность эндокринных желез, стимулируют гипоталамус и гипофиз. При любой напряженной работе, особенно физической, содержание в крови катехоламинов увеличивается. Это приспособительная реакция организма к нагрузке любого рода. И чем более выражена реакция, тем лучше организм приспосабливается, тем быстрее достигается состояние тренированности. При интенсивной физической работе повышение температуры тела, учащение сердцебиения и др. вызвано выделением в кровь большого количества катехоламинов.
Адреналин, его называют «гормоном страха» из-за того, что при испуге сердце начинает биться чаще. Выброс адреналина происходит при любом сильном волнении или большой физической нагрузке. Адреналин повышает проницаемость клеточных мембран для глюкозы, усиливает распад углеводов (гликогена) и жиров, вызывает сужение сосудов органов брюшной полости, кожи и слизистых оболочек; в меньшей степени сужает сосуды скелетной мускулатуры. Артериальное давление под действием адреналина повышается. Если человек испуган или взволнован, то его выносливость резко повышается.
Норадреналин называют «гормоном ярости», т.к. в результате выброса в кровь норадреналина всегда возникает реакция агрессии, значительно увеличивается мышечная сила. Его секреция и выброс в кровь усиливаются при стрессе, кровотечениях, тяжелой физической работе и других ситуациях, требующих быстрой перестройки организма. Так как норадреналин оказывает сильное сосудосуживающее действие, его выброс в кровь играет ключевую роль в регуляции скорости и объема кровотока.
Дофамин вызывает повышение сердечного выброса, оказывает вазоконстрикторное действие, улучшает кровоток и пр., стимулирует распад гликогена и подавляет утилизацию глюкозы тканями. Дофамин вызывает повышение концентрации глюкозы в крови. Он участвует в регуляции образования гормона роста, в торможении секреции пролактина.
γ-Аминомасляная кислота (ГАМК) — аминокислота, важнейший тормозной нейромедиатор центральной нервной системы человека и других млекопитающих. Аминомасляная кислота является биогенным веществом. Содержится в ЦНС и принимает участие в нейромедиаторных и метаболических процессах в мозге.
Аминов.
Вообщем, учим эту последовательность, ферменты и умее повторить. Будьте молодцами
Диагностика, лечение.
Классическая ФКУ - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы, которые приводят к снижению активности фермента или полной его инактивации. При этом концентрация фенилаланина повышается в крови в 2030 раз (в норме - 1,0-2,0 мг/дл), в моче - в 100-300 раз по сравнению с нормой (30 мг/дл).
Наиболее тяжёлые проявления ФКУ - нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. При отсутствии лечения больные не доживают до 30 лет
Диагностика: Производится полуколичественным тестом или количественным определением фенилаланина в крови. При нелеченных случаях возможно выявление продуктов распада фенилаланина (фенилкетонов) в моче (не ранее 10—12 дня жизни ребёнка).
Лечение:
Альбинизм
Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в меланоцитах. В результате дефекта тирозиназы нарушается синтез пигментов меланинов. Клиническое проявление альбинизма (от лат. albus - белый) - отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь. Длительное пребывание таких больных под открытым солнцем приводит к раку кожи. Частота заболевания 1:20 000.
Исхождение.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови - гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла Нарушение орнитинового цикла наблюдается при гепатитах различной этиологии и некоторых других вирусных заболеваниях. Например, установлено, что вирусы гриппа и других острых респираторных вирусных инфекций снижают активность карбамоилфосфатсинтетазы I. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию. Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников.
Все симптомы гипераммониемии - проявление действия аммиака на ЦНС. Для диагностики различных типов гиперам-мониемии производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активности фермента в биоптатах печени. Основной диагностический признак - повышение концентрации аммиака в крови. Содержание аммиака в крови может достигать 6000 мкмоль/л (в норме - 60 мкмоль/л).
Уремия (uraemia; греческий uron моча + haima кровь; синонимы мочекровие) — синдром аутоинтоксикации, развивающийся при выраженной почечной недостаточности в результате задержки в организме азотистых метаболитов и других токсических веществ, расстройства водно-солевого, кислотно-щелочного и осмотического гомеостаза, сопровождающийся вторичными обменными и гормональными нарушениями, общей дистрофией тканей и дисфункцией всех органов и систем. (Источник: Леди Википедия.)
Диагностическое значение.
Принцип метода основан на определении количества аммиака, высвобождаемющегося при разложении мочевины сыворотки или цельной крови под действием уреазы, колориметрическим методом с использование метода Несслера.
Диагностическое значение имеет повышение концентрации мочевины, которое встречается при хронических поражениях почек, усиленном распаде белков в тканях, непроходимости кишечника, закупорке мочевыводящих путей. Снижение уровня мочевины встречается при голодании, безбелковой диете, ферментных дефектах мочевинообразования.
Образование и выведение солей аммония. Глутаминаза почек.
Тканей.
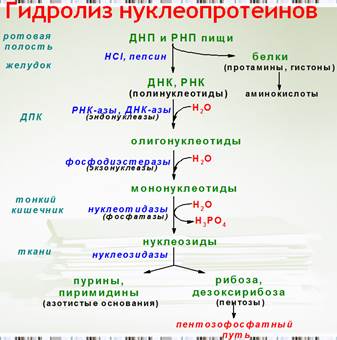
Схема говорит о многом. Съели курочку, её надо разобрать. ДНП и РНП чрез пищевод попадает в желудок, там, под действием агрессивных агентов - соляной кислоты и пепсинов расщепляются до полинуклеотидов. Дальше в ход вступают эндонуклеазы, образуются олигонуклеотиды и экзонуклеазы, ура, получили мононуклеотиды.
Циклу.
И СНОВА БИОЛОГИЯ!!! ВОССЛАВЬ ЕЁ!!! Процесс митоза принято подразделять на четыре основные фазы: профазу, метафазу, анафазу и телофазу. Так как он непрерывен, смена фаз осуществляется плавно — одна незаметно переходит в другую.
Циклин-зависимые киназы — группа белков, регулируемых циклином и циклиноподобными молекулами. Большинство Циклин зависимых киназ участвуют в смене фаз клеточного цикла; также они регулируют транскрипцию и процессингмРНК. Циклин-зависимые киназы являются серин\треониновыми киназами, и фосфорилируют соответствующиеостатки белков. Известно несколько CDK, каждая из которых активируется одним или более циклинами ииными подобными молекулами после достижения их критической концентрации, притом по большей частиCDK гомологичны, отличаясь в первую очередь конфигурацией сайта связывания циклинов. В ответ науменьшение внутриклеточной концентрации конкретного циклина происходит обратимая инактивациясоответствующей CDK. Если CDK активируются группой циклинов, каждый из них как бы передаваяпротеинкиназы друг другу, поддерживает CDK в активированном состоянии длительное время. Такие волны активации CDK возникают на протяжении G1- и S- фаз клеточного цикла.
Полимеразы, их роль.
Транскрипция - первая стадия реализации генетической информации в клетке. В ходе процесса образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции. Транскрипция у эукариотов происходит в ядре. В основе механизма транскрипции лежит тот же структурный принцип комплементарного спаривания оснований в молекуле РНК (G = C, A=U и Т=А). ДНК служит только матрицей и в ходе транскрипции не изменяется. Рибонук-леозидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ) - субстраты и источники энергии, необходимые для протекания полимеразной реакции, образования З',5'-фосфодиэфирной связи между рибонуклеозидмонофосфатами.
Синтез молекул РНК начинается в определённых последовательностях (сайтах) ДНК, которые называют промоторы, и завершается в терминирующих участках (сайты терминации). Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции - транскриптон. У эукариотов в состав транскриптона, как правило, входит один ген,у прокариотов несколько. В каждом транскриптоне присутствует неинформативная зона; она содержит специфические последовательности нуклеотидов, с которыми взаимодействуют регуляторные транскрипционные факторы. Транскрипционые факторы - белки, взаимодействующие с определёнными регуляторны-ми сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транс-криптонах эукариотов составляет в среднем 1:9 (у прокариотов 9:1). Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК. Разделение ДНК на множество транскриптонов позволяет осуществлять с разной активностью индивидуальное считывание (транскрипцию) разных генов.
В процессе транскрипции различают З стадии: инициацию, элонгацию и терминацию.
Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. В ядрах эукари-отов обнаружены З специализированные РНК-полимеразы: РНК-полимераза I, синтезирующая пре-рРНК; РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК. РНК-полимеразы - оли-гомерные ферменты, состоящие из нескольких субъединиц - 2α, β, β', σ. Субъединица σ (сигма) выполняет регуляторную функцию, это один из факторов инициации транскрипции. РНК-полимеразы I, II, III, узнающие разные промоторы, содержат разные по строению субъединицы σ.
63. Понятие о мозаичной структуре генов, первичном транскрипте; механизм созревания РНК (посттранскрипционный процессинг).
Эукариотические гены, в отличие от бактериальных, имеют прерывистое мозаичное строение. Кодирующие последовательности (экзоны) перемежаются с некодирующими (интронами). Экзон [от англ. ex(pressi)on - выражение, выразительность] - участок гена, несущий информацию о первичной структуре белка. В гене экзоны разделены некодирующими участками - интронами. Интрон (от лат. inter - между) - участок гена, не несущий информацию о первичной структуре белка и расположенный между кодирующими участками - экзонами. В результате структурные гены эукариот имеют более длинную нуклеотидную последовательность, чем соответствующая зрелая иРНК, последовательность нуклеотидов в которой соответствует экзонам. В процессе транскрипции информация о гене списывается с ДНК на промежуточную иРНК, состоящую из экзонов и интронов. Затем специфические ферменты - рестриктазы - разрезают эту про-иРНК по границам экзон-интрон, после чего экзонные участки ферментативно соединяются вместе, образуя зрелую иРНК (так называемый сплайсинг). Количество интронов может варьировать в разных генах от нуля до многих десятков, а длина - от нескольких пар оснований до нескольких тысяч.
Белка у эукариотов.
Динамическое состояние белков в организме. Катепсины.
Белки тканей организма постоянно обновляются, то есть подвергается распаду, и постоянно замещаются вновь синтезированными белками. Период полуобмена белков в таких тканях как кровь, слизистая кишечника, печень составляет приблизительно 10 дней. В таких тканях, как кожа, мышцы период полуобмена белков более продолжителен,
Распад тканевых белков (катаболизм) осуществляют особые тканевые протеолитические ферменты катепсины. Выделяют несколько их видов, которые обозначают буквами А, В, Д, Н, N. Катепсины локализованы как в лизосомах, так и в цитозоле. Лизосомальные катепсины называются кислыми катепсинами, так как оптимум рН для них равен 4,5-5,5. Катепсины могут относиться как к эндопептидазам, так и к экзопептидазам. В активном центре катепсинов могут присутствовать цистеин, аспарагиновая кислота, серин. Биологическая роль катепсинов:
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1676; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.119.149 (0.012 с.) |