
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Принцип Паулі. Періодична система елементів Менделєєва
Стан електрона в атомі визначається за допомогою чотирьох квантових чисел n, l, m, s. Фізичні величини, обумовлені цими числами, і можливі їх значення наведені в табл. 31.1. Таблиця 31.1
В 1925 р. В. _Паулі встановив принцип: у будь-якому атомі не може бути двох електронів з однаковим набором квантових чисел, тобто електрони повинні відрізнятися один від одного хоча б одним квантовим числом. Користуючись принципом Паулі, можна знайти максимальне число електронів з однаковим значенням головного квантового числа і таких, що відрізняються один від одного хоча б одним квантовим числом l, m, s. Різні стани атома, що характеризуються значенням головного квантового числа n=1 і n=2, наведені в табл. 31.2. Видно, що максимальне число електронів, що перебувають у стані з n=1, дорівнює двом, а при n=2 це число дорівнює восьми. У загальному випадку максимальне число електронів, які перебувають у стані зі значенням головного квантового числа n, дорівнює 2n2. Електрони з однаковим значенням головного квантового числа утворюють оболонки, які позначаються буквами K (n=1), L (n=2), M (n=3) і т.д. У кожній з оболонок електрони розподіляються по підоболонкам, що відповідають даному значенню орбітального квантового числа l. Число підоболонок дорівнює порядковому номеру n оболонки. Максимальне число електронів у підоболонці з даним l дорівнює 2(2l+1). У порядку зростання орбітального квантового числа l=0, 1, 2, 3, 4,... підоболонки позначаються буквами відповідно s, p, d, e, f.
Таблиця 31.2
Теоретичне обґрунтування періодичної системи елементів Менделєєва засновано на трьох положеннях.
1. Загальне число електронів в атомі даного елемента дорівнює його порядковому номеру в таблиці Менделєєва. Це означає, що сумарний негативний заряд електронів компенсується позитивним зарядом ядра і тому атом у цілому електронейтральний. 2. При заповненні електронних оболонок повинен виконуватися принцип мінімуму енергії, що полягає в тому, що при переході від одного елемента до наступного, тобто при приєднанні до атома нового електрона, у першу чергу заповнюються стани з найменшою енергією. 3. Заповнення електронами енергетичних станів в атомі відбувається відповідно до принципу Паулі. Виходячи із цих принципів, розглянемо тепер будову початкових періодів таблиці Менделєєва. Перший період містить два елементи — водень і гелій. В атомі водню є один електрон, що заповнює стан із квантовими числами n=1, l=0, m=0, s=+1/2 або –1/2. В атомі гелію два електрони мають однакові числа n=1, l=0, m=0, але різні значення спінових квантових чисел: для одного з них s=+1/2, а для іншого s=–1/2. Ці два електрони повністю заповнюють щонайнижчу K-оболонку. Другий період починається з атома літію, що має три електрони: два з них утворюють K-оболонку, а третій перебуває на L-оболонці, що відповідає значенню головного квантового числа n=2. Елементи Be, B, C, N, O, F, Ne, що йдуть далі в міру зростання номерів, також мають повністю заповнену K-оболонку, а інші електрони заповнюють L-оболонку, причому спочатку заповнюється підоболонка s (Li, Be), а потім підоболонка p —для інших елементів другого періоду. Заповнення 2p-оболонки закінчується на атомі неону і ним же завершується другий період періодичної системи. C третього періоду, тобто з лужного елемента натрію, починається заповнення M-оболонки(n=3): спочатку заповнюється 3 s-подоболочка (Na, Mg), а потім 3 p-подоболочка. Закінчується період інертним газом аргоном, у якого 3 p-підоболонка повністю заповнена. Заповнення електронами різних станів для атомів перших трьох періодів показано в табл.31.3. Відповідно до принципу мінімуму енергії оболонки мають бути послідовно заповнені одна за одною, а в межах кожної оболонки – спочатку s-підоболонка, потім p-, d-, f- підоболонки. Однак, починаючи із четвертого періоду такий порядок порушується: спочатку заповнюється більш висока підоболонка, а потім більш низька. Як показують строгі квантово-механічні розрахунки, це пов'язане з тим, що енергія електрона залежить не тільки від головного квантового числа, але й від орбітального. Тому енергетично більш вигідним може виявитися стан з більшим n, але меншим l. Групу елементів від лантану (La57) до лютецію (Lu71) називають лантаноїдами або рідкоземельними елементами. У них відбувається заповнення внутрішніх оболонок при практично незмінних зовнішніх оболонках, тому лантаноїди характеризуються близькими хімічними властивостями. Подібним чином поводяться актиноїди — група елементів від актинію (Ac89) до лоуренсія (Lr103) у сьомому періоді.
Табл.31.3
Рентгенівські спектри Рентгенівські промені — це електромагнітні хвилі з малою довжиною хвилі — l £ 0,1 нм. Рентгенівське випромінювання виникає при бомбардуванні електронами електрода, виконаного з матеріалу, що складається з атомів з z > 20. Розрізняють суцільний і характеристичний (лінійчастий) рентгенівські спектри.
Суцільний рентгенівський спектр (рис. 31.3) виникає при порівняно низькій прискорювальній напрузі в рентгенівських трубках (U ≈ (3...5)×104 В). Форма суцільного рентгенівського спектра нагадує спектр випромінювання АЧТ (див. §29.1), але роль температури грає прискорююча напруга. Принципове розходження цих двох типів спектрів полягає в тому, що спектр суцільного рентгенівського випромінювання обмежений з боку коротких хвиль значенням l0, при якому інтенсивність випромінювання перетворюється на нуль. Зі зростанням напруги значення короткохвильової границі l0 зміщується в область коротких хвиль. Походження суцільного спектра, існування в ньому короткохвильової границі і її залежність від напруги можна пояснити так. При зіткненні з анодом електрон потерпає різке гальмування, тобто рухається з великим від’ємним прискоренням. Відповідно до законів класичної електродинаміки заряд, що рухається прискорено, випромінює електромагнітні хвилі. Строгі розрахунки за теорією Максвелла дозволили знайти аналітичний вираз для залежності I(l), показаної на рис. 31.3. Щоб пояснити існування короткохвильової границі суцільного спектра запишемо закон збереження енергії для взаємодії електрона з анодом. Пройшовши прискорюючу різницю потенціалів U, електрон набуває кінетичну енергію mv2/2=eU, що частково витрачається на випромінювання світлового кванта з енергією hν, а частково перетворюється в теплову енергію, що приводить до розігрівання анода: eU=hn+Q. Для кожного з електронів, що співударяється з анодом, співвідношення між hn і Q різне: чим більш Q, тим менше hn, і навпаки. Тому рентгенівський спектр є суцільним. У деяких сприятливих випадках вся кінетична енергія електрона переходить в енергію електромагнітного випромінювання: eU= hn.
Оскільки n0=c/l0, то з останнього співвідношення випливає
Таким чином, з ростом напруги l0 зменшується, що погоджується з дослідом (рис. 31.3).
При більш високих напругах рентгенівський спектр радикально перетворюється: на тлі суцільного рентгенівського спектра з'являються гострі піки, сукупність яких утворює лінійчастий спектр. Механізм виникнення лінійчастого спектра такий. При високих напругах енергія електрона стає достатньою для того, щоб вибити електрон з однієї із внутрішніх оболонок атома. При цьому на внутрішній оболонці виникає незаповнене місце – вакансія, яка далі може бути заповнена в результаті переходу електрона з більш високої оболонки. Такий перехід буде супроводжуватися випромінюванням рентгенівського кванта певної частоти. Якщо вакансія утворилася на K-оболонці, то переходи типу L→K, M→K, N→K приводять до утворення в рентгенівських спектрах K-серії (рис. 31.4). L-серія виникає в результаті переходів електрона з більш високих оболонок на L-оболонку: M→L, N→L і т.д. Аналогічно виникають і інші серії лінійчастого рентгенівського спектра. Експериментально було встановлено, що лінії якої-небудь серії задовольняють співвідношенню, що нагадує узагальнену формулу Бальмера для воднеподібних атомів (див. §29.6):
де R — постійна Ридберга; s— стала екранування; n і m — натуральні числа, причому n < m. Формулу (31.6) називають законом Мозлі. Зміст сталої екранування полягає в тому, що електрон, що здійснює перехід на більш низьку оболонку, «відчуває» не весь заряд ядра Ze, а заряд (Z – s)e, ослаблений екрануючим впливом інших електронів. Наприклад, для переходу L→K s=1, оскільки на K-оболонці залишається один електрон, що зменшує заряд ядра на величину одного елементарного заряду. Частота першої лінії K-серії, що виникає в результаті переходу L→K, знаходиться за формулою
Формула (31.7) дозволила найбільш точно визначити заряд ядра атома і зіграла видатну роль в обґрунтуванні ядерної моделі атома. Слід відзначити, що оскільки лінійчатий рентгенівський спектр виникає при переходах електронів на внутрішніх оболонках атома, то на ньому зовсім не позначається стан зовнішніх електронних оболонок, що визначається тим, чи входить атом у яку-небудь сполуку або залишається вільним. Це надзвичайно полегшує використання рентгеноскопічного методу для аналітичних цілей, наприклад, у геології.
Серед інших застосувань рентгенівських променів відзначимо можливість вивчення структури кристалів і внутрішніх оболонок атомів, структурний аналіз у хімії й біології (наприклад, розшифровка структури ДНК), діагностика й терапія в медицині, стерилізація харчових продуктів, дефектоскопія в техніці, криміналістика і т.д.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 312; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.60.149 (0.017 с.) |
 s-підоболонка
s-підоболонка
 p-підоболонка
p-підоболонка
 Рис. 31.3
Рис. 31.3
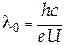 .
. Рис. 31.4
Рис. 31.4
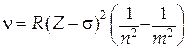 ,
,
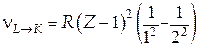 .
.



