Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Б. Механизмы регуляции экспрессии генов у эукариотовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Эукариотические организмы (и особенно млекопитающие) устроены значительно сложнее прокариотов и нуждаются в более сложном
Рис. 4-47. Механизм индукции лактозного оперона. А - в отсутствие индуктора (лактозы) белок-репрессор связан с оператором. РНК-полимераза не может присоединиться к промотору, транскрипция структурных генов оперона не идёт; Б - в присутствии лактозы белок-репрессор присоединяет её, изменяет свою конформацию и теряет сродство к оператору. РНК-полимераза связывается с промотором и транскрибирует структурные гены: β-галактозидазы (А), катализирующей гидролиз лактозы до глюкозы и галактозы; галактозидпермеазы (В), осуществляющей транспорт лактозы и других галактозидов в клетки; тиогалакто-зидтрансацетилазы (С) - фермента, способного переносить ацетильную группу ацетил-КоА на тиогалактозу. Функция его в процессе утилизации лактозы пока неясна.
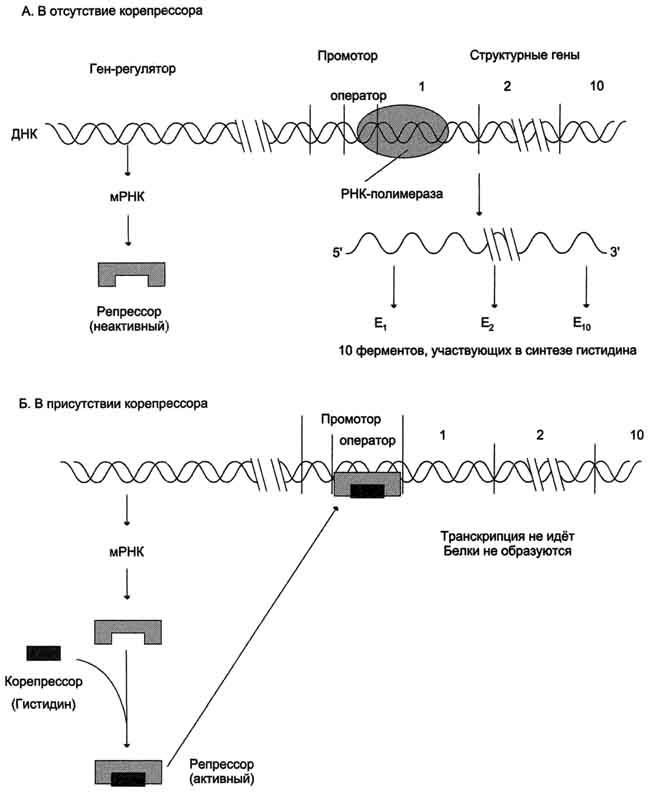
Рис. 4-48. Механизм репрессии синтеза ферментов, участвующих в образовании гистидина. А - в отсутствие корепрессора (гистидина) белок-репрессор не имеет сродства к оператору, РНК-полимераза присоединяется к промотору, и происходит транскрипция 10 структурных генов, кодирующих строение ферментов, участвующих в синтезе гистидина; Б - в присутствии гистидина в среде комплекс белка-репрессора с корепрессором, т.е. Гис, связывается с оператором, препятствует присоединению РНК-полимеразы к промотору и останавливает транскрипцию. аппарате регуляции. Так, в организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям. В то же время различными методами исследования ДНК (прежде всего, методом молекулярной гибридизации) доказано, что количество и структура ДНК практически всех клеток организма одинаковы (за исключением лимфоцитов), т.е. все клетки организма содержат один и тот же геном. У высших организмов по сравнению с прокариотическими существенно возрастает содержание ДНК на гаплоидную клетку: с 4,2×106 пар нуклеотидов у Е. coli до 3,3×109 пар нуклеотидов в клетках человека. 1. Организация хроматина в дифференцированных В клетках млекопитающих наряду с адаптивной регуляцией, обеспечивающей приспособление организма к меняющимся условиям внутренней и внешней среды, существуют механизмы, которые сохраняют стабильную (существующую на протяжении всей жизни клетки и даже многих её генераций) репрессию одних генов и депрессию других.
В ядрах дифференцированных клеток хроматин имеет такую укладку, что только небольшое число генов (часто менее 1%) доступно для транскрипции. Различают участки гетерохроматина, в которых ДНК упакована очень компактно и недоступна для транскрипции, и участки эухроматина, имеющие более рыхлую укладку и способные связывать РНК-полимеразу. В разных типах клеток в область эухроматина попадают разные гены, а это означает, что в разных тканях транскрибируются разные участки хроматина. Стойкая репрессия генов гетерохроматина обеспечивается:
Исследования показали, что области эухроматина, в которых расположены активно транскрибируемые гены, обладают некоторыми структурными особенностями:
Разнообразие клеток и возросшая сложность клеточных процессов нуждаются в большом разнообразии механизмов регуляции. Показано, что разный набор и количество белков в эукариотических клетках может регулироваться:
Изменение количества генов Геном эукариотов обнаруживает высокую пластичность, играющую важную роль в регуляции активности некоторых генов и увеличивающую разнообразие клеточных ответов. У млекопитающих реализуются следующие варианты изменений в структуре генов: · Амплификация (или увеличение числа) генов используется организмом в том случае, когда возникает необходимость увеличить синтез определённого генного продукта. Многие гены, кодирующие белки или РНК, необходимые организму в больших количествах (например, гистоны, рРНК, тРНК), постоянно присутствуют в амплифицированном соетрянии. Так, у человека 20% общего генома состоит из участков, кодирующих рибосомные, транспортные и ядрышковые РНК, последние из которых обеспечивают посттранскрипционные модификации РНК. Амплифицированные участки могут располагаться друг за другом (тандемно) в хромосоме или образовывать внехромосомные фрагменты ДНК, называемые двойными мини-хромосомами, их размер колеблется от 100 до 1000 килобаз (1 килобаза = 1000 пар нуклеотидов). Описано более 20 генов, способных амплифицироваться при определённых условиях. К числу генов, для которых обнаружена амплификация, относят ген металлотионеина. Продукт экспрессии этого гена - низкомолекулярный белок металлотионеин, обладающий способностью связывать тяжёлые металлы (медь, цинк, кадмий, ртуть) и защищать клетки от отравления этими соединениями. Установлено, что в ответ на повышение концентрации тяжёлых металлов в крови в клетках происходит амплификация гена металлотионеина. Другими примерами генов, количество которых увеличивается под влиянием лекарственных препаратов, являются ген дигидрофолатредуктазы (см. разделы 9, 10) и ген Р-гликопротеина, ответственный за синтез белка, обеспечивающего множественную лекарственную устойчивость опухолевых клеток (см. раздел 16). · Утрата генетического материала -довольно редкий способ регуляции. Наиболее яркий пример потери всех генов за счёт разрушения ядра - процесс созревания эритроцитов. Нестабильны амплифицированные гены, двойные хромосомы. Они, как правило, исчезают в последующих генерациях. Утрата генетического материала происходит в процессе созревания лимфоцитов и образования плазматических клеток разных клонов, синтезирующих секретируемые формы иммуноглобулинов. Перестройка генов У высших организмов, так же как и у прокариотов, отмечают процесс обмена, перемещения генов между хромосомами или внутри хромосомы, объединение генов с образованием изменённой хромосомы, которая после таких структурных изменений способна к репликации и транскрипции. Этот процесс получил название "генетическая рекомбинация". У эукариотов рекомбинации наблюдают:
Рассмотрим более подробно механизмы, обеспечивающие образование в организме каждого человека около 10 млн (107) различных антител, т.е. количества значительно большего, чем число всех других белков, существующих у каждого индивидуума. Антитела с одинаковыми антигенсвязывающими свойствами синтезируются В-лимфоцитами, принадлежащими к одному определённому клону (т.е. группе клеток, возникшей из одной родоначаль-ной клетки), При попадании в организм любого антигена среди имеющегося набора В-лимфоцитов всегда найдётся такой клон клеток, антитела которого имеют комплементарный ему активный центр. Антитела встроены в плазматическую мембрану В-лимфоцитов, и их антигенсвязывающие участки локализованы на поверхности клеток. Антиген, присоединяясь к активному центру антитела, вызывает пролиферацию клеток и превращение В-лимфоцитов в плазматические клетки, в которых идут активный синтез и секреция не связанных с мембраной антител.
Изучение вопроса о происхождении антител позволило сделать вывод о том, что огромное многообразие белков иммунной системы кодируется ограниченным количеством генетического материала, изменения в котором обеспечиваются рекомбинациями и соматическими мутациями (или изменениями в структуре ДНК,которые сохраняются при последующих делениях клеток). Вспомним, что мономерные антитела - доменные белки, состоящие из двух идентичных тяжёлых (Н) цепей и двух идентичных лёгких (L) цепей. Лёгкие цепи имеют двухдоменную структуру и включают вариабельный (VL) и константный (CL) домены. Тяжёлая цепь состоит из 4-5 доменов: одного вариабельного (VH) и, как правило, трёх константных (СH). Иммуноглобулины - гликопротеины; их углеводная часть присоединяется к константной области Н-цепей. В связывании антигенов участвуют 2 активных центра антитела, образованные вариабельными областями Н-цепей (VH) и L-цепей (VL). L-цепи бывают двух типов: λ (лямбда) и κ (каппа), значительно различающиеся по первичной структуре С-областей. Наличие в антителах С- и V-областей позволило предположить, что гены, обеспечивающие синтез L- и Н-цепей, образуются в результате соединения двух участков гена, один из которых кодирует вариабельную область, а второй - константную. И действительно вскоре было установлено, что в зародышевых клетках и соматических клетках, не синтезирующих иммуноглобулины, участки гена, кодирующие V- и С-области L-цепей λ-типа, разделены протяжёнными нуклеотидными последовательностями, но сближены в зрелых В-лимфоцитах, синтезирующих Lλ Из этого следовал вывод о том, что в процессе дифференцировки В-лимфоцита из зародышевой клетки происходит "вырезание" протяжённого участка генетического материала, обеспечивающее сближение VL- и Cλ-областей с образованием полного гена L-цепи иммуноглобулина. Этот процесс перестройки в геноме получил название соматической рекомбинации, так как он связан с созреванием лимфоцитов и не передаётся по наследству.
Описано 3 разных семейства генных фрагментов, или сегментов, кодирующих строение L- и Н-цепей Ig. Два семейства ответственны за синтез лёгких цепей: сегменты, кодирующие строение L-цепей типа λ, расположены в хромосоме 22, генетический материал L-цепей типа к (каппа) - в хромосоме 2, а информация о всём разнообразии Н-цепей локализована в хромосоме 14. Полные гены L-цепей λ и κ типов в ходе дифференцировки собираются из 3 сегментов: вариабельного (VL), соединительного (JL) и константного (CL). Так, для L-цепей к типа обнаружено около 300 сегментов, кодирующих N-концевой вариабельный (Vκ) участок полипептидной цепи длиной в 95 аминокислотных остатков, 5 сегментов, в которых содержится информация об остальных 13 аминокислотах Vκ области, и 1 сегмент константной области. В зародышевых клетках 300 сегментов Vκ расположены в хромосоме последовательно на расстоянии 7 килобаз друг от друга. Каждый V-сегмент состоит из 2 экзонов, разделённых коротким интроном: лидирующий экзон (L) кодирует сигнальный пептид (20-25 аминокислотных остатков), а экзон Vκ - основную часть вариабельного домена. Семейство Vκ-сегментов отделено от группы соединительных сегментов (Тк) участком ДНК размером в 20 килобаз. Между последним из Jκ-сегментов и Сκ-экзоном, кодирующим домен константной области, расположен интрон размером в 2,4 килобазы (рис. 4-49). В ходе дифференцировки В-клеток один из вариабельных VL-сегментов путём соматической рекомбинации переносится из отдалённого участка в участок той же хромосомы, рядом с одним из сегментов JL. Например, сегмент V2 объединяется с соединительным мини-сегментом J4, и формируется полный ген L-цепи. Он состоит из 3 экзонов и 2 нитронов, расположенных в гене в следующем порядке: 5'L-I1-V2-J4-J5-I2-С-3', где L - лидерная последовательность, кодирующая сигнальный пептид, I, - интрон V2-сегмента, а 12 - интрон между семейством JL-сегментов и Сκ-экзоном. После транскрипции гена в ходе сплайсинга из первичного транскрипта удаляются интроны I1, I2и лишний сегмент J5, а все кодирующие последовательности соединяются в единую информационную молекулу зрелой мРНК. В процессе синтеза L-цепи на рибосоме лидерный участок, состоящий в основном из гидрофобных аминокислот, обеспечивает прохождение белка через мембрану ЭР и затем отщепляется. Образуется L-цепь, имеющая аминокислотный состав, характерный для L-цепи κ-типа в молекуле Ig.
Расчёты показывают, что из имеющихся сегментов κ-гена в организме можно синтезировать 4500 полных генов, кодирующих L-цепи κ-типа. Формирование полных генов L-цепей λ-типа происходит так же, как L-цепей κ-типа. Рис. 4-49. Образование гена лёгкой цепи κ (каппа) типа и его транскрипция. 1 - V-сегменты L-цепей состоят из двух экзонов и разделяющего их интрона. Экзоны кодируют сигнальный пептид (L) и почти весь вариабельный домен V. В ходе соматической рекомбинации сегмент гена вариабельной части L-цепи (V2) объединяется с одним из соединительных сегментов (J4); 2 - транскрибируется полный ген L-цепи, состоящий из трёх экзонов и двух интронов, расположенных в следующем порядке: 5'L -I1-, V2J4-J5-I2-С-3'; 3 - в ходе сплайсинга первичного транскрипта гена интрон I1 сегмента V2, J5 сегмент и интрон I2, отделяющий V2J 4 от С-области, удаляются. Ещё большее разнообразие вариантов возникает при сборке полных генов тяжёлых (Н) цепей Ig. Н-цепи кодируются четырьмя сегментами: VH, DH (от англ, diversity) сегментами разнообразия, JH и СH. У человека обнаружено около 500 VH, 15 DH и 4 JH сегментов. Каждый VH сегмент содержит информацию об аминокислотной последовательности сигнального пептида и около 100 аминокислот VH домена. В сегменте DH закодирован участок полипептидной цепи, содержащий от 2 до 13 аминокислот, а в сегменте JH - 4-6 аминокислот. Полный ген вариабельного домена образуется путём соединения VH, DH и JH сегментов. При формировании полного гена вариабельной части Н-цепи Ig, состоящей из VH, D и JHсегментов, происходит 2 рекомбинационные состыковки: на первом этапе удаляется участок между выбранными Dx и Jy кодирующими последовательностями, а на втором - между Vi и DxJy сегментами. Экзонов, кодирующих константную область Н-цепей, описано 10: Сμ, Сσ, Сγ3, Сγ1, Сα1, Сγ2α, Сγ2β, Сγ4, Сε и Сα2, они определяют классы и подклассы иммуноглобулинов - IgM, IgG, IgA и т.д. Первыми в иммунном ответе появляются IgM, поскольку к полному гену вариабельного домена ближе всех остальных С-экзонов находится Cμ, сегмент Н-цепи. Активированные В-клетки могут синтезировать мембранно-связан-ную и секретируемую формы IgM. Кроме того, они могут переключаться с синтеза IgM на образование антител других классов. Перед каждым СH экзоном имеется участок ДНК, называемый "участок переключения", или "свич-сайт" (от англ, swich site), построенный из повторяющихся нуклеотидных последовательностей. Эти участки облегчают протекание дополнительной рекомбинации, в ходе которой удаляются С-сегменты между полным геном вариабельной области и С-сегментом того класса, который должен быть включён. Исследование нуклеотидных последовательностей генов некоторых подклассов L-цепей к-типа и Н-цепей показало, что разнообразие структуры сегментов, закодированных в зародышевой клетке, увеличивают соматические мутации. Мутации происходят в дифференцированных клетках на участках VL-JL и VHDHJH сегментов в процессе или после рекомбинаций, делая, таким образом, количество антител практически неограниченным. Очень важно, что мутации происходят в областях, ответственных за узнавание антигенов, обеспечивая более полное соответствие активного центра антитела антигену. Таким образом, перестройки генетического материала в процессе формирования полных генов Ig происходят в несколько этапов, каждый из которых приурочен к строго определённой стадии дифференцировки В-лимфоцитов. Из сегментов, которые кодируют различные участки полипептидной цепи, входящей в вариабельные домены, и одного из экзонов константного домена собираются полные гены тяжёлых и лёгких нитей Ig. Сборка L-цепей включает одну соматическую рекомбинацию, а сборка Н-цепей происходит с помощью двух соматических рекомбинаций. Когда В-лимфоциты синтезируют Ig не класса М, то это сопровождается ещё одним дополнительным рекомбинационным событием. Соматические мутации, происходящие в зрелых В-лимфоцитах, делают многообразие антител неисчерпаемым. Аналогичные процессы наблюдают и в ходе дифференцировки Т-лимфоцитов. Регуляция транскрипции Регуляция транскрипции генов высших организмов сходна с регуляцией экспрессии генов прокариотов. Основное различие состоит в значительно большем количестве участков ДНК и регуляторных факторов, контролирующих этот процесс. У животных и человека различные гены экспрессируются в разные моменты времени и с разной интенсивностью. Здесь, так же, как у прокариотов, есть гены "домашнего хозяйства", транскрибирующиеся конститутивно, т.е. постоянно и во всех тканях. Это гены гликолиза, синтеза РНК и некоторых белков (например, альбумина). Существуют гены, транскрибирующиеся только в специализированных клетках, т.е. имеет место тка-неспецифическая экспрессия. Например, экспрессия генов α- и β-цепей глобина происходит только в клетках-предшественниках эритроцитов. Многие гены подвергаются адаптивной регуляции и являются объектами индуцибельных воздействий или негативного контроля. Ранее уже говорилось о том, что минимальный синтез любого белка поддерживается в том случае, если к ТАТА-участку промотора присоединяется ТАТА-связывающий белок, факторы транскрипции и РНК-полимераза, образующие инициирующий комплекс, осуществляющий синтез небольшого количества мРНК. Формирование комплекса - многоступенчатый процесс, от образования которого зависит скорость инициации транскрипции. Идентифицировано более 100 различных белков, способных взаимодействовать со специфическими регуляторными последовательностями ДНК, влияя главным образом на процесс сборки транскрипционного комплекса и скорость транскрипции (рис. 4-50). Эти белки имеют один или несколько доменов, обеспечивающих выполнение регуляторных функций. · ДНК-связывающие домены, ответственные за узнавание и связывание регуляторных факторов со специфическими участками на молекуле ДНК; · Домены, активирующие транскрипцию за счёт связывания с белками основного инициаторного комплекса: транскрипционными факторами, коактиваторами и РНК-поли-меразой; · Антирепрессорные домены, благодаря которым белки способны взаимодействовать с гис-тонами нуклеосом и освобождать транскрибируемые участки ДНК от связи с этими ингибиторными структурами; Домены, связывающие лиганды, присоединение которых к белку изменяет его конформацию и обеспечивает связывание с молекулой ДНК. Лигандь1-индукторы транскрипции - стероидные гормоны, ретиноевая кислота, каль-цитриол (производное витамина D3) и гормоны
Рис. 4-50. Адаптивная регуляция транскрипции у эукариотов. Промоторы эукариотических генов находятся под контролем большого числа регуляторных участков на молекуле ДНК: TATA-, CAAT-, GC-последовательностей, энхансеров, сайленсеров-последовательностей, к которым присоединяются комплексы белков с различными лигандами (цАМФ, стероидными гормонами, метаболитами, ионами металлов и т.д.). щитовидной железы. Лигандами-репрессорами могут быть конечные продукты метаболических путей, некоторые гормоны. Будучи липофильньши молекулами, они проходят плазматическую, а иногда и ядерную мембраны, взаимодействуют с внутриклеточными рецепторами, присоединяясь к лиганд-связьгвающему участку (рис. 4-51). Присоединение лиганда к рецептору образует ДНК-связьшающий участок, узнающий специфическую последовательность в регуляторной зоне ДНК и индуцирующий транскрипцию определённых генов. На молекуле ДНК на расстоянии 100-200 пар оснований от стартовой точки транскрипции имеются короткие специфические последовательности ДНК: СААТ - элемент (или бокс), CG-бокс и октамерный бокс (включающий 8 пар оснований), узнающие транскрипционные факторы. Эти элементы есть во всех клетках, и конститутивно экспрессируемые гены нуждаются только в них. В то же время для генов, подвергающихся адаптивной регуляции, обнаружены участки молекулы ДНК, которые удалены (до 1000 и более пар оснований) от промотора, но тоже участвующие в регуляции транскрипции. Эти нуклеотидные последовательности бывают 2 типов. Энхансеры - участки ДНК размером 10-20 пар оснований, присоединение к которым регуляторных белков увеличивает скорость транскрипции. Если участки ДНК, связываясь с белками, обеспечивают замедление транскрипции, то их называют сайленсерами. Эти структурные элементы молекулы ДНК контролируют транскрипцию, даже если они:
Рис. 4-51. Действие лиганда-индуктора транскрипции на клетку млекопитающих. Лиганд-индуктор, например стероидный гормон, связывается с внутриклеточным рецептором, находящимся в ядре или цитоплазме, и поступает в ядро. Комплекс гормон-рецептор присоединяется к определённому участку на молекуле ДНК и активирует транскрипцию гена. Образуется мРНК - матрица для синтеза белка, обеспечивающего определённый клеточный ответ.
Элементы ответа, или cis-элементы -регуляторные последовательности ДНК, общие для группы генов. Они обеспечивают координированную регуляцию транскрипции генов и, как правило, располагаются на расстоянии примерно в 250 пар оснований выше промотора каждого гена. В остальном эти нуклеотидные последовательности имеют много общего с энхансерами. В данном варианте регуляции один и тот же индуктор, связываясь с соответствующим регуляторным белком, может активировать много разных генов, так как каждый из них в регуляторной области содержит один и тот же cis-элемент. Один из белков-продуктов этой группы генов может оказаться индуктором другой группы генов. Конечный результат регуляции - серия ответных реакций за счёт активации различных генов одним индуктором (рис. 4-52). К генам, регулируемым cis-элементами, относят гены, чувствительные к стероидным гормонам, гены белков теплового шока и многие другие. Например, при повышении температуры или после какого-либо другого клеточного стресса активируется синтез транскрипционного фактора, который индуцирует транскрипцию генов, кодирующих строение шаперонов. Очевидно, что эффективность регуляции во многом зависит от структуры транскрипционных факторов и внутриклеточных рецепторов, непосредственно взаимодействующих с молекулой ДНК. Установлено, что большинство ДНК-связывающих белков принадлежит к трём семействам в зависимости от структуры домена, непосредственно взаимодействующего с двойной спиралью ДНК. Эти белки включают структуры типа "спираль-поворот-спираль", "цинковые пальцы" и "лейциновой молнии" (см. раздел 1). Как правило, эти структуры - небольшие фрагменты молекул белков, а сайт-специфическое связывание происходит за счёт взаимодействия между радикалами аминокислот
Рис. 4-52. Активация группы генов с помощью одного индуктора. Группа генов имеет общий регуляторный cis-элемент и активируется одним и тем же регуляторным белком. Один из белковых продуктов первой серии ответных реакций активирует вторую серию генов (* - cis-элементы к белку X; # - cis-элементы к белку С). этих участков и азотистыми основаниями молекулы ДНК.
|
|||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 801; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.174.57 (0.018 с.) |