Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аминоацил-тРНК синтетазы (аминоацил-тРНК лигазы)Содержание книги
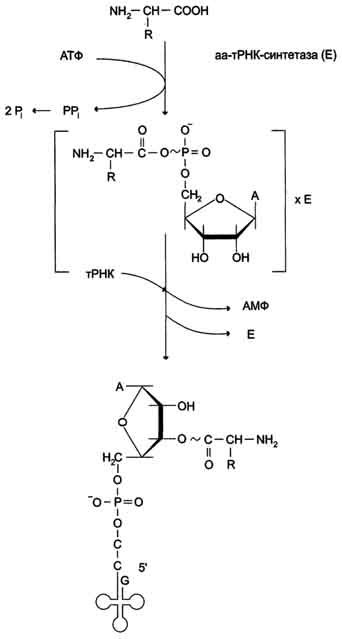
Поиск на нашем сайте В цитозоле клеток 20 различных аминокислот присоединяются α-карбоксильной группой к 3'-гидроксильному акцепторному концу соответствующих тРНК с образованием сложноэфирной связи. Эти реакции катализирует семейство ферментов, носящее название аминоацил-тРНК синтетаз (аа-тРНК-синтетаз). Каждый член этого семейства узнаёт только одну определённую аминокислоту и те тРНК, которые способны связываться с этой аминокислотой. Из этого следует, что в группу тРНК синтетаз входит 20 различных ферментов. Они осуществляют активацию аминокислот в 2 стадии: на первой стадии аминокислота присоединяется к ферменту и реагирует с АТФ с образованием богатого энергией промежуточного соединения - аминоацил-АМФ. На второй стадии аминоацильный остаток аминоациладенилата, оставаясь связанным с ферментом, взаимодействует с молекулой соответствующей тРНК с образованием аминоацил-тРНК (рис. 4-36).
Рис. 4-36. Образование аминоацил-тРНК. Аминокислота взаимодействует с АТФ и активируется, образуя аминоациладенилат, который, не освобождаясь из связи с ферментом (Е), отдаёт активированную аминокислоту тРНК с образованием аминоацил-тРНК (аа-тРНК). Суммарную реакцию, катализируемую аминоацил-тРНК синтетазами в присутствии ионов Mg2+, можно представить следующим образом: Аминокислота +тРНК + АТФ -" аминоацил - тРНК + АМФ + PPi. Для каждой аминокислоты существует свой фермент - своя аминоацил тРНК синтетаза: для глутамата - глутамил-тРНК синтетаза, гистидина - гистидил-тРНК синтетаза и т.д. Аминокислоты присоединяются к 3'- или 2'-ОН группам рибозы на 3'-конце тРНК, где все тРНК имеют общую нуклеотидную последовательность -ССА. Энергия, заключённая в макроэргической сложноэфирной связи аминоацил-тРНК, впоследствии используется на образование пептидной связи в ходе синтеза белка. Пирофосфат, выделяющийся в ходе этой реакции, гидролитически расщепляется с образованием двух молекул ортофосфата и выделением энергии, что делает реакцию активации аминокислот необратимой. Чрезвычайно высокая специфичность аа-тРНК синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. В активном центре этих ферментов есть 4 специфических участка для узнавания: аминокислоты, тРНК, АТФ и четвёртый - для присоединения молекулы Н2О, которая участвует в гидролизе неправильных аминоациладенилатов. За счёт существования в активном центре этих ферментов корректирующего механизма, обеспечивающего немедленное удаление ошибочно присоединённого аминокислотного остатка, достигается поразительно высокая точность работы: на 1300 связанных с тРНК аминокислот встречается только одна ошибка. Аминокислота, присоединяясь к тРНК, в дальнейшем не определяет специфических свойств аа-тРНК, так как её структуру не узнаёт ни рибосома, ни мРНК. Участие в синтезе белка зависит только от структуры тРНК, а точнее, от комплементарного взаимодействия антикодона аминоацил-тРНК с кодоном мРНК. Антикодон расположен в центральной (антикодоновой) петле тРНК. Узнавание тРНК аа-тРНК синтетазами не всегда происходит по антикодоновой петле. Активный центр некоторых ферментов обнаруживает комплементарное соответствие другим участкам пространственной структуры тРНК.
16. Биосинтез белка. Реализация генетической информации в фенотипические признаки. Представление о коллинеарности. Трансляция: необходимые компоненты, химизм процесса, основные этапы. Пептидилтрансферазная активность рРНК. Функционирование рибосом. Синтез полипептидной цепи на рибосоме Синтез белка (трансляция) является самым сложным из биосинтетических процессов: он требует очень большого количества ферментов и других специфических макромолекул, общее количество которых, видимо, доходит до трёхсот. Часть из них к тому же объединены в сложную трёхмерную структуру рибосом. Но несмотря на большую сложность синтез протекает с чрезвычайно высокой скоростью (десятки аминокислотных остатков в секунду). Процесс может замедляться и даже останавливаться ингибиторами-антибиотиками. В пятидесятых годах XX века было установлено, что синтез белка происходит в рибонуклеопротеиновых частицах, называющихся рибосомами. Диаметр рибосомы бактерии E. coli составляет 18 нм, а их общее количество – десятки тысяч в клетке. Рибосомы эукариот несколько крупнее (21 нм). Сам процесс протекает в пять этапов. 1.Активация аминокислот. Каждая из 20 аминокислот белка соединяется ковалентными связями к определённой т-РНК, используя энергию АТФ. Реакция катализуется специализированными ферментами, требующими присутствия ионов магния. 2.Инициация белковой цепи. и-РНК, содержащая информацию о данном белке, связывается с малой частицей рибосомы и с инициирующей аминокислотой, прикреплённой к соответствующей т-РНК. т-РНК комплементарна с находящимся в составе и-РНК триплетом, сигнализирующим о начале белковой цепи. 3.Элонгация. Полипептидная цепь удлиняется за счёт последовательного присоединения аминокислот, каждая из которых доставляется к рибосоме и встраивается в определённое положение при помощи соответствующей т-РНК. В настоящее время генетический код полностью расшифрован, то есть всем аминокислотам поставлены в соответствие триплеты нуклеотидов. Элонгация осуществляется при помощи белков цитозоля (так называемые факторы элонгации). 4.Терминация. После завершения синтеза цепи, о чём сигнализирует ещё один специальный кодон и-РНК, полипептид высвобождается из рибосомы. 5.Сворачивание и процессинг. Чтобы принять обычную форму, белок должен свернуться, образуя при этом определённую пространственную конфигурацию. До или после сворачивания полипептид может претерпевать процессинг, осуществляющийся ферментами и заключающийся в удалении лишних аминокислот, присоединении фосфатных, метильных и других групп и т. п. В ходе синтеза белка прочтение информации мРНК идёт в направлении от 5'- к З'-концу, обеспечивая синтез пептида от N- к С-концу. Каждая эукариотическая мРНК кодирует строение только одной полипептидной цепи (т.е. она моноцистронна), в отличие от прокариотических мРНК, которые часто содержат информацию о нескольких пептидах (т.е. они поли-цистронны). Эти различия вызваны тем, что у прокариотов ДНК лишена интронов, и РНК-полимераза транскрибирует участки, прочтение информации с которых подчиняется общему регуляторному механизму. Кроме того, на полицистронных мРНК синтез белка начинается до того, как заканчивается их собственный синтез, так как процессы транскрипции и трансляции не разделены. У эукариотов трансляция протекает в цитоплазме, куда из ядра поступают уже "зрелые" мРНК. События на рибосоме включают этапы: инициации, элонгации и терминации. Инициация Инициация трансляции представляет собой событие, в ходе которого происходит образование комплекса, включающего Мет-тРНКiМет, мРНК и рибосому, где тРНКiМет - инициирующая метиониновая тРНК (рис. 4-37). В этом процессе участвуют не менее 10 факторов инициации, которые обозначают как elF (от англ. eukaryotic initiation factors) с указанием номера и буквы. Первоначально 40S субъединица рибосомы соединяется с фактором инициации, который препятствует ее связыванию с 60S субъединицей, но стимулирует объединение с тройным комплексом, включающим Мет-тРНКiМет, eIF-2 и ГТФ. Затем этот теперь уже более сложный комплекс связывается с 5'-концом мРНК при участии нескольких elF. Один из факторов инициации (eIF-4F) узнаёт и присоединяется к участку "кэп" на молекуле мРНК, поэтому он получил название кэпсвязывающего белка. Прикрепившись к мРНК, 40S субъединица начинает скользить по некодирующей части мРНК до тех пор, пока не достигнет инициирующего кодона AUG кодирующей нуклеотидной последовательности. Скольжение 40S субъединицы по мРНК сопровождается гидролизом АТФ, энергия которого затрачивается на преодоление участков спирализации в нетранслируемой части мРНК. В эукариотических клетках некодирующие участки мРНК имеют разную длину, но обычно от 40 до 80 нуклеотидов, хотя встречаются области с протяжённостью более 700 нуклеотидов.Достигнув начала кодирующей последовательности мРНК, 40S субъединица останавливается и связывается с другими факторами инициации, ускоряющими присоединение 60S субъединицы и образование 80S рибосомы за счёт гидролиза ГТФ до ГДФ и неорганического фосфата. При этом формируются А- и Р-центры рибосомы, причём в Р-центре оказывается AUG-кодон мРНК с присоединённым к нему Мет-тРНКiМет.В клетках есть 2 различающиеся по структуре тРНК, узнающие кодон AUG. Инициирующий кодон узнаёт тРНКiМет, а триплеты мРНК, кодирующие включение метионина во внутренние участки белка, прочитываются другой тЗРКМет Элонгация По завершении инициации рибосома располагается на мРНК таким образом, что в Р-центре находится инициирующий кодон AUG с присоединённой к нему Мет-тРНКшМет, а в А- центре – триплет,
Рис. 4-37. Образование инициирующего комплекса в ходе синтеза белка у эукариотов. Мет-тРНКМетобъединяется с малой субъединицей рибосомы в форме тройного комплекса: Мет-тРНКМет, elF-2 и ГТФ. Образовавшийся более сложный четырёхкомпонентный комплекс присоединяется к 5'-концу мРНК с помощью нескольких дополнительных факторов, и малая субъединица начинает скользить по мРНК до тех пор, пока антикодон Мет-тРНКМет не свяжется с инициирующим кодоном AUG. При этом в комплексе происходит изменение состава инициирующих факторов, и ускоряется присоединение 60S субъединицы рибосомы, сопровождающееся гидролизом ГТФ. Мет-тРНКiМет занимает на рибосоме Р-центр кодирующий включение первой аминокислоты синтезируемого белка. Далее начинается самый продолжительный этап белкового синтеза - элонгация, в ходе которого рибосома с помощью аа-тРНК последовательно "читает" мРНК в виде триплетов нуклеотидов, следующих за инициирующим кодоном в направлении от 5' к 3'-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот. Включение каждой аминокислоты в белок происходит в 3 стадии, в ходе которых:
Связывание аминоацил-тРНК в А-центре. Кодон мРНК, располагающийся в А-центре рядом с инициирующим кодоном, определяет природу аа1тРНКaa1, которая будет включена в А-центр. аа1тРНКaa1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1, аа1тРНКaa1 и ГТФ. Комплекс эффективно взаимодействует с рибосомой лишь в том случае, если антикодон аа-тРНКaa1 комплементарен и антипараллелен ко-дону мРНК в А-центре. Включение аа-тРНКaa1 в рибосому происходит за счёт энергии гидролиза ГТФ до ГДФ и неорганического фосфата (рис. 4-38). Образование пептидной связи происходит сразу же после отщепления комплекса EF-1 и ГДФ от рибосомы. Эта стадия процесса получила название реакции транспептидации (рис. 4-39). В ходе этой реакции остаток метионина Мет-тРНКIМет связывается с a-аминогругшой первой аминокислоты, присоединённой к тРНКaa1 и расположенной в А-центре, образуется первая пептидная связь. Установлено, что пептидилтрансферазная активность большой субъединицы рибосомы принадлежит 28S рРНК. К настоящему времени обнаружена целая группа РНК, обладающая свойствами ферментов. Эти каталитически активные РНК получили название рибозимов (см. раздел 2). Полагают, что рибозимы можно считать "реликтами" раннего периода эволюции, когда белки ещё не приобрели такого значения, как в последующие периоды.
Рис. 4-38. Включение аа1-тРНКaa1 в рибосому. aа1-тРНКaa1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1I, аа1-тРНKaa1 и ГТФ. Антикодон аа-тРНКаа1 комплементарен и антипараллелен кодону мРНК в А-центре. Связывание аа1-тРНКaa1 происходит за счёт энергии гидролиза ГТФ до ГДФ и Рi
Рис. 4-39. Реакция транспептидации. Метионин от Мет-тРНКiМет, находящегося в Р-центре, присоединяется к α-МН2 -группе аминоацильного остатка аа1-тРНКaa1 А-центра с образованием новой пептидной связи. Транслокация - третья стадия элонгации. К рибосоме присоединяется фактор элонгации EF-2 и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу. В результате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, из А-центра перемещается в Р-центр. Свободная от метионина тРНКiМет покидает рибосому, а в область А-центра попадает следующий кодон (рис. 4-40). По завершении третьей стадии элонгации рибосома в Р-центре имеет дипептидил-тРНК, а в А-центр попадает триплет, кодирующий включение в полипептидную цепь второй аминокислоты. Начинается следующий цикл стадии элонгации, в ходе которого на рибосоме снова проходят вышеописанные события. Повторение таких циклов по числу смысловых кодонов мРНК завершает весь этап элонгации.
Рис. 4-40. Стадия транслокации. К рибосоме присоединяется фактор элонгации EF-2, и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу. Пептидил-тРНК, не меняя своего положения относительно мРНК, из А-центра перемещается в Р-центр. Терминация Терминация трансляции наступает в том случае, когда в А-центр рибосомы попадает один из стоп-кодонов: UAG, UAA или UGA. Для стоп-кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых высвобождающих фактора RF (от англ, releasingfactor) или фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы на субъединицы (рис. 4-41). Интересно отметить, что факторы трансляции, реализующие эффекты за счёт гидролиза ГТФ, являются членами суперсемейства G-белков, в которое входят G-белки, участвующие в трансдукции сигналов гормонов и других биологически активных веществ, и Ras-белки, функционирующие как факторы роста (см. разделы 11, 15). Все G-белки связывают и гидролизуют ГТФ. Когда они связаны с ГТФ, то активны и участвуют в соответствующих метаболических процессах, а когда в активном центре в результате гидролиза ГТФ превращается в ГДФ, эти белки приобретают неактивную конформацию. Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК в рибосому для синтеза белка строго детерминирована мРНК, т.е. порядок расположения кодонов вдоль цепи мРНК однозначно задаёт структуру синтезируемого белка. Рибосома сканирует цепь мРНК в виде триплетов и последовательно отбирает из окружающей среды "нужные" аа-тРНК, освобождая в ходе элонгации деацилированные тРНК. Малая и большая субъединицы рибосомы в процессе трансляции выполняют разные функции: малая субъединица присоединяет мРНК и декодирует информацию с помощью тРНК и механизма транслокации, а большая субъединица ответственна за образование пептидных связей. Г. Полирибосомы В процессе синтеза белка рибосома присоединяется к 5'-концу мРНК и перемещается в направлении 3'-конца. При этом 5'-конец мРНК освобождается, и к нему может присоединиться новая рибосома, на которой начинается рост ещё одной полипептидной цепи. Как правило,
Рис. 4-41. Терминация синтеза белка. много рибосом одновременно участвует в синтезе белка на одной и той же мРНК, образуя комплекс, который называют полирибосомой, или полисомой (рис. 4-42). Каждая рибосома занимает на мРНК участок длиной около 80 нуклеотидов, поэтому рибосомы располагаются на мРНК с интервалом примерно в 100 нуклеотидов. Чем длиннее полипептидная цепочка синтезируемого белка, тем больше рибосом может одновременно осуществлять синтез этого белка, значительно увеличивая таким образом эффективность использования матрицы. Каждая рибосома способна катализировать образование около 100 пептидных связей в минуту. Полирибосомы могут существовать в виде частиц, плавающих в щггоплазме клеток, или могут быть связаны с ЭР. Свободные цитоготазматические полирибосомные частицы ответственны за синтез белков, выполняющих внутриклеточные функции. Полирибосомы, ассоциированные с ЭР, под электронным микроскопом имеют вид "шероховатой" поверхности. Белки, синтезируемые "шероховатым" ЭР, должны транспортироваться через мембрану для того, чтобы они достигли места окончательной локализации. Для
Рис. 4-42. Синтез белков на полирибосомном комплексе. Пять рибосом считывают информацию, содержащуюся в мРНК. них характерно присутствие на N-конце лидер-ной, или сигнальной, последовательности длиной от 15 до 30 аминокислотных остатков, которая содержит много аминокислот с гидрофобными радикалами и обеспечивает прохождение белка через липидный бислой мембран. Некоторые из этих белков для дальнейшего транспорта упаковываются аппаратом Гольджи в секреторные гранулы. Реализ ген инф в фенотипич признаки : генетическая информация программирует синтез специфических белков, определяющих в свою очередь специфичность структуры и функции клеток, органов и целостного организма. В природе, как известно, существует два типа биополимерных макромолекул: так называемые неинформативные биополимеры (они представлены повторяющимися мономерными единицами и/или разветвленными структурами, например полисахариды, поли-АДФ-рибоза, пеп-тидогликаны, гликопротеины) и информативные биополимеры, несущие первичную генетическую информацию (нуклеиновые кислоты) и вторичную генетическую, точнее фенотипическую, информацию (белки). Эти общие представления могут быть выражены следующей последовательностью событий (поток информации): ДНК –> РНК –> Белок –> Клетка –> Организм Значительный вклад в современные представления о месте, факторах и механизме синтеза белка внесли исследования Т. Касперсона, М. Хоглан-да, П. Берга, П. Замечника, С. Очоа, М. Ниренберга, Н. Горовица, Ф. Гауровица, С. Вейсса и российских биохимиков А.А. Баева, А.Н. Белозерского, А.С. Спирина и др. Не останавливаясь на всех исторических аспектах развития этой важнейшей проблемы, следует напомнить, что еще в 40-х годах было установлено, что ДНК локализована в ядре клетки, в то время как синтез белка протекает главным образом в микросомах цитоплазмы. Первые экспериментальные доказательства необходимости нуклеиновых кислот для синтеза белка были получены в лаборатории Т. Касперсона. Было показано также, что присутствующие в цитоплазме рибонуклеиновые кислоты контролируют синтез цитоплазматических белков. Таким образом, уже тогда вырисовывалась картина тесной связи между ДНК, локализованной в ядре, и синтезом белка, протекающим в цитоплазме и регулирующимсярибонуклеиновыми кислотами, которые были открыты как в цитоплазме, так и в ядре. На основании этих чисто морфологических данных было сделано заключение, полностью подтвержденное в настоящее время, что биосинтез белка, хотя непосредственно и регулируется рибонуклеиновыми кислотами, опосредованно связан с контролирующим влиянием ДНК ядра и что РНК сначала синтезируется в ядре, затем поступает в цитоплазму, где выполняет роль матрицы в синтезе белка. Полученные значительно позже экспериментальные данные подтвердили гипотезу о том, что основными функциями нуклеиновых кислот являются хранение генетической информации и реализация этой информации путем программированного синтеза специфических белков. В последовательности ДНК —> РНК —> Белок недоставало сведений о том, каким образом происходят расшифровка наследственной информации и синтез специфических белков, определяющих широкое разнообразие признаков живых существ. В настоящее время выяснены основные процессы, посредством которых осуществляется передача наследственной информации: репликация, т.е. синтез ДНК на матрице ДНК; транскрипция, т.е.синтез РНК на матрице ДНК или перевод языка и типа строения ДНК на молекулу РНК (см. ранее), и трансляция – процесс, в котором генетическая информация, содержащаяся в молекуле мРНК, направляет синтез соответствующей аминокислотной последовательности в белке. Напомним, однако, что многие тонкие механизмы транскрипции и трансляции окончательно еще неясны. Пептидилтрансфер активность Рибосомная «пептидилтрансфераза» катализирует (без потребления АТФ) перенос растущей пептидной цепи от тРНК, находящейся в Р-участке, на аминогруппу валинового остатка, присоединенного к тРНКVаl, связанной на А-участке. Пептидилтрансферазная активность рибосом зависит не от какого-либо рибосомного белка, а, скорее всего, связана с 28S-PHK. Каталитически активные РНК получили название рибозимов. Предполагают, что существующие рибозимы можно рассматривать как реликты «мира РНК», раннего периода биохимической эволюции, когда белки еще не получили такого распространения и не приобрели такого значения, как в последующие периоды. Функционирование рибосом Роль мРНК в трансляции аналогична роли телеграфной ленты в этом примере: аа-тРНК присоединяются антикодонами к соответствующим кодонам мРНК, в результате чего аминокислотные остатки оказываются расположенными в той последовательности, в которой расположены кодоны в мРНК. Теперь остается лишь соединить аминокислотные остатки пептидной связью, чтобы получилась пептидная цепь (белок) с определенной первичной структурой. Таким образом, последовательность кодонов мРНК коллинеарна последовательности аминокислотных остатков в соответствующем белке. Эта схема отражает лишь принципиальный механизм перевода нуклеотидной последовательности (точнее, последовательности кодонов) в аминокислотную последовательность. Реальный процесс синтеза белков совершается при участии рибосом и ряда других факторов. Рибосомы содержат ферменты и другие белки, обеспечивающие взаимодействие между мРНК и аа-тРНК, образование пептидной связи и отделение готового белка. Весь процесс образования пептидной цепи можно разделить на три стадии: инициация, элонгация и терминация.
17. Посттрансляционные изменения полипептидных цепей (посттрансляционный процессинг), значение. Ингибиторы матричных биосинтезов. Применение ингибиторов матричных биосинтезов как лекарств (дуаномицин, актиномицин D, тетрациклин, левомицетин и др.). Вирусы и бактериальные токсины как ингибиторы матричных биосинтезов в организме человека. Интерфероны. Полипептидные цепи могут подвергаться структурным модификациям, либо будучи ещё связанными с рибосомами, либо после завершения синтеза. Эти конформационные и структурные изменения полипептидных цепей получили название посттрансляционных изменений. Они включают удаление части полипептидной цепи, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации. Многие модификации осуществляются в ЭР. Здесь происходят фолдинг полипептидных цепей, формирование уникальной третичной или четвертичной структуры белков. Причём для поддержания нативной конформации молекул огромное значение имеет правильное формирование дисульфидных связей. Частичный протеолиз Многие белки, секретируемые из клеток, первоначально синтезируются в виде молекул-предшественников, функционально неактивных. Удаление части полипептидной цепи специфическими эндопротеазами приводит к образованию активных молекул. Некоторые белки-предшественники расщепляются в ЭР или аппарате Гольджи, другие - после секреции. Так, неактивные предшественники секретируемых ферментов - зимогены - образуют активный фермент после расщепления по определённым участкам молекулы: зимоген панкреатической железы трипсиноген превращается в активный трипсин после секреции в тонкий кишечник. Наглядным примером последовательного двухстадийного протеолиза служит образование активных форм пептидных гормонов (например, инсулина или глюкагона) из препрогормонов. Первоначально N-концевой сигнальный пептид молекулы-предшественника удаляется в ЭР в процессе синтеза белка и образуется неактивный прогормон. Затем прогормон в секреторных гранулах, формирующихся в аппарате Гольджи, подвергается действию эндо- и/или экзопротеаз и превращается в активный гормон. Ковалентные модификации Структурные белки и ферменты могут активироваться или инактивироваться в результате присоединения различных химических групп: фосфатных, ацильных, метальных, олигосахаридных и некоторых других. · Фосфорилирование белков осуществляется по гидроксильным группам серина, треонина и, реже, тирозина ферментами из группы протеинкиназ, тогда как дефосфорилирование катализируют гидролитические ферменты фосфопротеинфосфатазы. · Гликозилирование. Белки, входящие в состав плазматических мембран или секретирующиеся из клеток, подвергаются гликозилированию. Углеводные цепи присоединяются то гидроксильным группам серина или треонина (О-гликозилирование) либо аспарагина (N-гликозилирование). Последовательное наращивание углеводного фрагмента происходит в ЭР и аппарате Гольджи. · Многочисленным модификациям подвергаются боковые радикалы некоторых аминокислот: в тиреоглобулине йодируются остатки тирозина; в факторах свёртывания крови карбоксилируются остатки глутамата; в ЭР фибробластов гидроксилируются остатки пролина и лизина в цепях тропоколлагена.
|
||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 3563; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.465 с.) |