Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение изотермического процессаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
(закон Бойля – Мариотта) Согласно соотношению (1), уменьшение давления сопровождается увеличением объема в изотермическом процессе и наоборот. График зависимости р(1/V) будет представлять собой прямую. Тангенс угла наклона g прямой - это ее угловой коэффициент, определяемый как
С другой стороны, тангенс угла наклона можно определить по графику функции р(1/V) как
Используя соотношения (23), (24) можно экспериментальным путем определить газовую постоянную R при данном постоянном количестве воздуха n как
Количество вещества n, находящегося в шприце воздуха, можно определить следующим образом. В соответствии с уравнением (22) макропараметры исходного состояния (р1, V1, Т1) и состояния, соответствующего нормальным условиям (ро = 105 Па, Vо, То = 273 К) связаны между собой следующим образом:
Но Vо = n . Vm, где Vm – объем, занимаемый одним молем газа, при нормальных условиях (Vm = 22,4 л). Поэтому
Изучение изобарического процесса (закон Гей-Люссака) При изобарном изменении состояния воздуха в шприце коэффициент tgb = Поэтому, вычислив tgb, можно по формуле (4) рассчитать термический коэффициент объемного расширения как
где Vo – объем воздуха, соответствующий температуре 0оС. С другой стороны, исходя из уравнения (21) тангенс угла наклона b прямой, построенной в координатах V(Т), равен
где n определяется по формуле (27), р1 – давление в изобарическом процессе. Поэтому, рассчитав тангенс угла наклона b для графика функции V(Т) можно также определить и значение универсальной газовой постоянной R при данном постоянном количестве воздуха как
Изучение изохорического процесса (закон Шарля) Для изохорного изменения состояния воздуха коэффициент tgj = Поэтому, вычислив tgj, можно по формуле (7) рассчитать термический коэффициент давления газа как
где рo – значение давления воздуха при нормальных условиях (температуре 0оС). Из уравнения (21) следует, что тангенс угла наклона j прямой, построенной в координатах р(Т), равен также
где V1 – исходный объем воздуха в шприце, n определяется по формуле (27). Поэтому, рассчитав tgj для графика функции р(Т), можно определить также и значение универсальной газовой постоянной R при данном постоянном количестве воздуха, занимающего объем V1 как
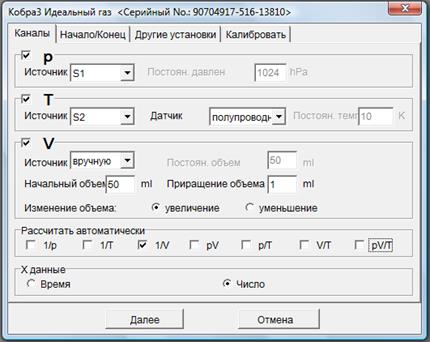
Таким образом, в ходе изучения изопроцессов можно различными способами по формулам (25), (31), (35) определить значение универсальной газовой постоянной R. Также можно по соотношениям (29) и (33) рассчитать значения термических коэффициентов объемного расширения и давления газа и проверить выполнение равенства (8) для воздуха. Упражнение 1. Подготовка к работе. 1. Соберите установку в соответствии с рис. 4. Не подключайте пока трубку-переходник (6) к датчику давления (4). 2. Поместив стеклянную воронку в отверстие (7), заполните стеклянную емкость дистиллированной водой, поместите в воду магнитную мешалку, выньте воронку и закройте отверстие крышкой. 3. Резиновую трубку, закрепленную на «отростке» отверстия (7), опустите в стеклянный стакан для стекания жидкости при последующем нагревании. 4. Смажьте поршень шприца глицерином, чтобы предотвратить утечку воздуха. Поршень должен быть покрыт сплошной пленкой глицерина на протяжении всего эксперимента. 5. Перемещая поршень (2), установите начальный объем шприца Vo = 50 мл. 6. Подключите трубку (6) к датчику давления (4). 7. Подключите устройство Cobra к USB – порту компьютера. Упражнение 2. Проверка закона Бойля – Мариотта. 1. Запустите программу для проведения измерений. Для этого на рабочем столе компьютера выберите ярлык программы Phywe Measure 4. В открывшемся окне в пункте меню Прибор > Кобра3 Идеальный газ. В появившемся диалоговом окне в закладке Каналы установите настройки измерений в соответствие с рис. 5.
Рис. 5. Окно настроек работы по изучению изотермического процесса
2. В закладке Начало/Конец выберите «по нажатию клавиши».
3. В закладке Другие установки поставьте флажки в поле Цифр. дисплей 1. В появившемся диалоговом окне в разделе Канал выберите Давление р в соответствии с рис. 6а, 6б. Поставьте флажок в поле Цифр. дисплей 2. В появившемся диалоговом окне в разделе Канал выберите Температура Т. 4. Поставьте флажок в поле Диаграмма 1, затем в появившемся диалоговом окне Параметры дисплея заполните поля в соответствии с рис. 7. В разделе Канал в поле давление р задается диапазон возможных значений давления. В разделе ось х в полях задается число возможных измерений. Рекомендуется в качестве максимального значения выбрать 20. В поле режим установите не автодиапазон.
5. Откалибруйте датчик. Для этого в закладке Калибровать введите в соответствующие поля значения комнатной температуры и давления, измеренные термометром и барометром соответственно. 6. Нажмите Далее взакладке Калибровать. На экране появится четыре окна: температура Т, давление р, Кобра3 - Измерение, окно для построения графика зависимости давления от числа измерений.
Рис. 9. Окно Измерение 7. Сохраните исходные данные измерения температуры То, давления ро, нажав на кнопку Сохранить значения в окне Измерение (рис. 9 ) илинажав Enter. 8. Рассчитайте число молей воздуха в шприце по (27) (V1 – начальный объем воздуха, равный 50 мл) 9. Перемещая вращательным движением поршень (2) шприца вправо, увеличьте объем на 1 мл. Давление воздуха в шприце изменится. Сохраните результаты измерения давления и температуры, нажав кнопку Сохранить значения или Enter. Результаты измерений автоматически отображаются на графике зависимости р(V) на экране монитора. 10. Постепенно увеличивайте количество воздуха с шагом в 1 мл до объема 70 мл. Сохраняйте результаты измерения давления и температуры, нажимая кнопку Сохранить значения или Enter. 11. По окончании измерений нажмите кнопку Закрыть в окне Измерение (рис. 9). На экране появится окно с графиками зависимостей р, V, T, 1/V от числа измерений. 12. Для сохранения данных измерений в другой программе в пункте меню выберите Измерение > Экспорт данных и поставьте метки в полях Копировать в буфер и Экспортировать как число (рис. 10). Откройте программу, в которой вы будете обрабатывать данные и выберите Вставить.
Рис. 10. Окно Экспорт данных Примечание: Для построения графиков можно воспользоваться возможностями программного обеспечения Phywe 4. Выберите пункт меню Измерение > Управление каналами. Например, для построения графика зависимости давления от объема, используя стрелки →, ←, →, ↓, заполните поля в окне Управление каналами в соответствии с рис.12. Нажмите Да, на экране появится график зависимости p(V)
Рис. 11. Окно Управление каналами 13. По экспериментальным данным на миллиметровой бумаге постройте график зависимости р(V). 14. Убедитесь, что график зависимости р(V) является гиперболой. Для этого линеаризируйте его, построив по экспериментальным данным график зависимости р(1/V) на миллиметровой бумаге. 15. Рассчитайте тангенс угла наклона g полученного графика методом парных точек или методом наименьших квадратов. Определите универсальную газовую постоянную по формуле (25), воспользовавшись результатами расчета числа молей воздуха, выполненными в п. 9. 16. Повторите измерения давления и объема 2-3 раза, используя указания пп. 1-15 (или пп. 1, 7-15, если настройки не нужно менять). 17. Проведите статистическую обработку результатов измерений R.
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 687; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.170.2 (0.009 с.) |

 (23).
(23). (24).
(24). (25).
(25).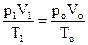 , или
, или  (26)
(26) (27).
(27). в выражении (4) соответствует тангенсу угла наклона b функции V(Т)
в выражении (4) соответствует тангенсу угла наклона b функции V(Т) (29),
(29), (30),
(30), (31).
(31). соответствует тангенсу угла наклона j функции p(Т)
соответствует тангенсу угла наклона j функции p(Т) (33),
(33),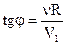 , (34),
, (34), (35).
(35).