
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодический закон Д. И. Менделеева.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Соли. Способы получения и свойства. Соли – это сложные вещества, образованные атомами металлов и кислотными остатками. С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков. Соли бывают средние (нормальные), кислые и основные. Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Получение 1. Взаимодействие металла с неметаллом: Fe + S
2. Взаимодействие металлов, расположенных в ряду напряжений левее водорода, с растворами кислот: Zn + H2SO4
3. Взаимодействие металлов с растворами солей:
Fe + CuSO4
4. Взаимодействие кислот с основаниями (реакция нейтрализации): HCI + NaOH
5. Взаимодействие кислот с основными оксидами:
H2SO4 + CaO Билет Характеристика химического элемента на основание его положения в Периодической системе химических элементов и строения атома Основания. Способы получения и свойства. Задача Билет Химические формулы. Относительная молекулярная масса веществ. Кислоты. Взаимодействие с металлами. Ряд активности металлов Осуществите цепочку превращения Билет Простые и сложные вещества Уравнение химических реакций Билет Химическая связь. Ковалентная связь. Кислоты их свойства. Билет Электроотрицательность атома. Кислоты. Способы получения кислот. Билет Закон постоянства состава. известно, что в сульфиде железа на один атом железа приходится один атом серы. Учитывая численные значения атомных масс железа и серы, нетрудно понять, почему эти элементы соединяются в массовых отношениях 7: 4, т. е. Ar(Fe): Ar(S) = 56: 32 = 7:4 Постоянным составом обладает большинство химических соединений. Закон постоянства состава веществ был открыт французским ученым Ж. Прустом в 1799 - 1806 гг. Закон был сформулирован так: Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав. (В настоящее время известны также соединения с переменным составом.) На основе закона постоянства состава можно производить различные расчеты. Амфотерные гидроксиды. Получение и свойства. Амфотерными называют гидроксиды, которые в зависимости от условий могут проявлять как кислотные, так и основные свойства.Примером амфотерного гидроксида может служить гидроксид цинка. Формула этого гидроксида в основной форме – Zn(OH)2. Но можно записать формулу гидроксида цинка в кислотной форме, поставив на первое место атомы водорода, как в формулах неорганических кислот: H2ZnO2 (Рис. 1). Тогда ZnO22- будет кислотным остатком с зарядом 2-. Особенностью амфотерного гидроксида является то, что в нем мало различаются по прочности связи О-Н и Zn-O. Отсюда и двойственность свойств. В реакциях с кислотами, готовыми отдать катионы водорода, гидроксиду цинка выгодно разрывать связь Zn-O, отдавая ОН-группу и выступая в роли основания. В результате таких реакций образуются соли, в которых цинк является катионом, поэтому их называют солями катионного типа: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Амфотерные гидроксиды – нерастворимые в воде соединения, поэтому их можно получить по реакции обмена между раствором соли переходного металла и щелочью. Например, гидроксид алюминия образуется при взаимодействии растворов хлорида алюминия и гидроксида натрия: AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Билет 1. Химическая связь. — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяетсявзаимодействием между заряженными частицами (ядрами и электронами). Современное описание химической связи проводится на основе квантовой механики [1]. Основные характеристики химической связи — прочность, длина, полярность. Структура периодической системы. Периодическая система химических элементов - естественная классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева. Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г. В 1870 г. В 1870 г. Менделеев назвал систему естественной, а в 1871 г. - периодической. Число элементов в современной Периодической системе почти вдвое больше, чем было известно 60-х годах XIX в. (на сегодняшний день - 113), однако ее структура со времен Менделеева почти не изменилась. Хотя за всю историю Периодической системы было опубликовано более 50 различных вариантов ее изображения, наиболее популярными являются предложенные Менделеевым короткопериодная и длиннопериодная формы. Главный принцип построения Периодической системы - выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы - 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство. Номер группы в Периодической системе определяет число валентных электронов а атомах элементов Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами. Номер периода = Число энергетических уровней, заполненных электронами = Обозначение последнего энергетического уровня
Билет
|
||
|
Последнее изменение этой страницы: 2016-08-25; просмотров: 635; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.5 (0.011 с.) |

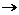 FeS.
FeS.



