Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет химия. Вещества и их смеси.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Оксиды. Способы получения и классификация. Билет 1.Чистые вещества и смеси. Способы разделения смесей. В природе вещества встречаются преимущественно в виде смесей. Однородным называют такие смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Например, растворы сахара или поваренной соли в воде. Неоднородным называют такие смеси, в которых невооруженным глазом или при помощи микроскопа можно заметить частицы веществ, составляющих смесь. Для химических лабораторий и промышленности часто требуются чистые вещества. Чистыми называют вещества, которые обладают постоянными физическими свойствами, например, дистиллированная вода. (Практически абсолютно чистые воды не получены.) Существует различные способы разделения смесей. Отстаивание Выделение веществ из неоднородной смеси, образованной нерастворимым в воде веществами с различной плотностью. Например, железные опилки от древесных можно отделить, взбалтывая эту смесь с водой, а затем отстаивая. Железные опилки опускается на дно сосуда, а древесные всплывают, и их вместе с водой можно слить. Фильтрование Выделение веществ из неоднородной смеси, образованной растворимыми и нерастворимыми в воде веществами. Для выделения поваренной соли смесь ее с песком взбалтывают в воде. Поваренная соль растворяется, а песок оседает.Чтобы ускорить отделение нерастворимых частиц из раствора, смесь фильтруют. Песок остается на фильтровальной бумаге, а прозрачный раствор поваренной соли проходит через фильтр. Выпаривание. Кристаллизация Чтобы растворное вещество, например поваренную соль, выделить из раствора, последний выпаривают. Вода испаряется, а фарфоровой чашке остается поваренная соль. Иногда применяют упаривание, т. е. частичное испарение воды. В результате образуется более концентрированный раствор, при охлаждении которого растворенное вещество выделяется в виде кристаллов. Этот способ очистки веществ называется кристаллизацией. Дис тилляция Этот способ разделения смесей основан на различии в температурах кипения растворимых друг в друге компонентов.Дистилляция (перегонка) прием разделения однородных смесей путем испарения летучих жидкостей с последующей конденсацией их паров. Например, получение дистиллированной воды. Для этого воду с растворенными в ней веществами кипятят в одном сосуде. Образующиеся водяные пары конденсируются в другом сосуде в виде дистиллированной воды 2.Соли их состав и свойства. Соли – это сложные вещества, образованные атомами металлов и кислотными остатками. С точки зрения теории электролитической диссоциации соли - это электролиты, диссоциирующие в водных растворах на катионы металлов и анионы кислотных остатков. Соли бывают средние (нормальные), кислые и основные. Средние соли – это продукты полного замещения водорода в кислоте на атомы металла или гидроксогруппы ОН- в основании на кислотный остаток. Кислые соли можно рассматривать как продукты неполного замещения атомов водорода кислоты на атомы металлов. Основные соли можно рассматривать как продукты неполного замещения ионов ОН- основания на ионы кислотных остатков. Получение 1. Взаимодействие металла с неметаллом: Fe + S
2. Взаимодействие металлов, расположенных в ряду напряжений левее водорода, с растворами кислот: Zn + H2SO4
3. Взаимодействие металлов с растворами солей:
Fe + CuSO4
4. Взаимодействие кислот с основаниями (реакция нейтрализации): HCI + NaOH
5. Взаимодействие кислот с основными оксидами:
H2SO4 + CaO Билет Изотопы У большинства элементов существуют изотопы, атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса. На этом рисунке вы видите три изотопа углерода. У изотопа С12есть 6 нейтронов и 6 протонов. С13 имеет 7 нейтронов. В ядре изотопа С12 восемь нейтронов и 6 протонов. Физические свойства изотопов различны, но они обладают одинаковыми химическими свойствами. Обычно большая часть атомов элемента (вещества, состоящего из атомов одного вида) принадлежит к одному изотопу, а другие изотопы встречаются в меньших количества 2. Реакции обмена Реакциями обмена называют реакции между двумя соединениями, которые обмениваются между собой своими составными частями: АВ + СD = АD + СВ. Если при реакциях замещения протекают окислительно-восстановительные процессы, то реакции обмена всегда происходят без изменения валентного состояния атомов. Это наиболее распространенная группа реакций между сложными веществами — оксидами, основаниями, кислотами и солями: ZnO + Н2SО4 = ZnSО4 + Н2О, AgNО3 + КВr = АgВr + КNО3, Билет 1.Структура Периодической системы элементов Периодическая система химических элементов - естественная классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева. Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г. В 1870 г. В 1870 г. Менделеев назвал систему естественной, а в 1871 г. - периодической. Число элементов в современной Периодической системе почти вдвое больше, чем было известно 60-х годах XIX в. (на сегодняшний день - 113), однако ее структура со времен Менделеева почти не изменилась. Хотя за всю историю Периодической системы было опубликовано более 50 различных вариантов ее изображения, наиболее популярными являются предложенные Менделеевым короткопериодная и длиннопериодная формы. Главный принцип построения Периодической системы - выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом). Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы - 18 групп, имеющих те же обозначения, что и в короткопериодном. Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство. Номер группы в Периодической системе определяет число валентных электронов а атомах элементов Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами. Номер периода = Число энергетических уровней, заполненных электронами = Обозначение последнего энергетического уровня Реакции разложения
Задача Билет
|
||
|
Последнее изменение этой страницы: 2016-08-25; просмотров: 1827; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.01 с.) |

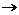 FeS.
FeS.