Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Властивості складних речовин залежать від якісного і кількісного складу і від хімічної будови, а також від взаємного впливу атомів в молекулі.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Предмет органічної хімії.
Органічна хімія – це хімія атома Карбону та всіх елементів періодичної системи. Проте не всі сполуки Карбону належать до органічних. Такі найпростіші речовини, як оксид Карбону (II) СО, оксид Карбону (IV) СО2, карбонатна кислота Н2СО3 та її солі, наприклад СаСО3, К2СО3 належать до неорганічних речовин. До складу органічних речовин крім Карбону можуть входити і інші елементи найчастіше - це Гідроген, галогени, Оксиген, Нітроген, Сульфур та Фосфор. Існують також органічні сполуки, що містять інші елементи, в тому числі метали – металоорганічні сполуки. З початку об'єктом вивчення органічної хімії були лише речовини, виділені з рослинних або тваринних організмів. У 1828 р. німецький хімік Ф.Велер вперше добув штучно (синтезував) органічну сполуку - сечовину. З цього часу почався бурхливий розвиток органічного синтезу: добуто велику кількість сполук, які не зустрічаються у природі. Предметом вивчення сучасної органічної хімії є всі органічні речовини - як природні, так і синтетичні. Органічна хімія має велике наукове і практичне значення. Вона сприяє розвитку суміжних галузей науки - біології, медицини, біохімії, агрохімії тощо. Сучасна хімічна промисловість виробляє важливі для народного господарства продукти - органічні речовини: пластмаси, волокна, каучук, гуму, смоли, бензин, мастила, спирти, розчинники, клеї, фарби тощо. Органічну сировину використовують численні галузі промисловості: нафтохімічна і нафтопереробна, фармацевтична, лісохімічна, харчова. Велике значення має органічна хімія для сільського господарства. Органічні добрива, засоби боротьби з шкідниками рослин, засоби, що прискорюють або сповільнюють ріст рослин і розвиток плодів, - все це органічні речовини.
1. Атоми, що входять до складу молекули органічних сполук, зв’язані між собою в суворо визначеному порядку, згідно з їх валентністю. Послідовність зв’язування атомів у молекулі називається хімічною будовою. 2. Властивості речовини залежать не тільки від того, які атоми і в якій кількості входять до складу її молекули, але й від того, в якій послідовності вони зв’язані між собою, тобто від хімічної будови молекули. 3. Атоми або групи атомів, які утворюють молекулу, як зв’язані безпосередньо, так і зв’язані через інші атоми, взаємно впливають одні на других, від чого залежить реакційна здатність молекули. 4. Вивчаючи реакційну здатність речовини, можна встановити її будову, і навпаки, за будовою речовини можна судити про її властивості. СКЛАД – БУДОВА – ВЛАСТИВОСТІ Сучасне трактування: Ізомери органічних сполук. Види ізомерії. Ізомери - це речовини, що мають однаковий якісний і кількісний склад, але різні властивості. Вперше це явище було виявлено на прикладі ціанової НО-С?N і гримучої НО-N=C кислот. Ціанову кислоту в 1822 р. відкрив Ф. Веллер. На рік пізніше Ю. Лібіх, вивчаючи гримучу кислоту, встановив, що, не дивлячись на різкі відмінності у властивостях, вона має такий самий склад, як і ціанова. Через кілька років Я. Берцеліус виявив ще одну пару ізомерів серед карбонових кислот і запропонував термін "ізомерія". Явище ізомерії чітко пояснила теорія хімічної будови органічних сполук О. М. Бутлерова. Дальший розвиток цієї теорії дав змогу обгрунтувати нові типи ізомерії (оптичну, геометричну), доповнити її стереохімічними уявленнями. 9. Структурна ізомерія. Структурна ізомерія у насичених вуглеводнів пов’язана з ізомерією карбонового скелета.
Кислотність і основність органічних сполук.Амфотерність. Переважно лікарські препарати проникають через ліпідну оболонку в неіонізованому стані, а тому знання їх кислотності і основності відіграє важливу роль в процесі вивчення їх метаболізму. Ефективність дії багатьох лікарських засобів обумовлюється їх здатністю проникати до рецептора. Для речовин, здатних до іонізації, біологічна активність може визначатися часткою неіонізованих молекул, або Наприклад, фенол і ацетатна кислота припиняють ріст різних плісеневих грибів; їх біологічна дія обумовлена неіонізованими молекулами, і тому найбільша ефективність ацетатної кислоти проявляється при рН нижче 4, а для фенолу – при рН нижче 9. Також тільки неіонізований теофілін стимулює діяльність серця черепахи, а не його аніон. В той же час антибактеріальна дія сульфаніламідних препаратів обумовлена аніонами. Оптимальне значення рКа сульфаніламідів знаходиться в інтервалі 6 – 8. Або антибактеріальна (бактеріостатична) дія аміноакридинів проявляється тільки в катіонній формі цих сполук і зростає при підвищенні ступеня їх катіонної іонізації. За головний вуглецевий ланцюг обирають той, котрий містить максимальне (у порядку убиваючої значимості) число: 1) функціональних груп; 2) кратних зв’язків; 3) атомів Карбону; 4) замісників. Замісником називають будь-який атом або групу атомів, котрі не входять до родоначальної структури. Поняття “замісник” включає у себе функціональну групу і радикал. Радикал – це залишок молекули вуглеводню, що утворюється в результаті видалення одного або декількох атомів Гідрогену. Утворену вільну валентність позначають рискою. За кількістю вільних валентностей розрізняють одно- дво- і тривалентні радикали: В залежності від природи атома Карбону розрізняють первинні, вторинні і третинні радикали. 4. Визначивши родоначальну структуру, нумерують її атоми таким чином, щоб старша дістала, по можливості, найменший номер. Якщо старшої групи немає, перевагу надають кратним зв’язкам, а при їх відсутності – замісникам. 5. Складають назву сполуки, дотримуючись такої послідовності: - алфавітний порядок функціональних груп, окрім старшої, та вуглеводневих радикалів (префікс); - назва родоначальної структури (корінь); - кратні зв’язки і старшу функціональну групу (суфікс). = зв’язок – “ен”, зв’язок – “ин (ін)” Кількість замісників: ди – (два), три – (три), тетра – (чотири), пента – п’ять.
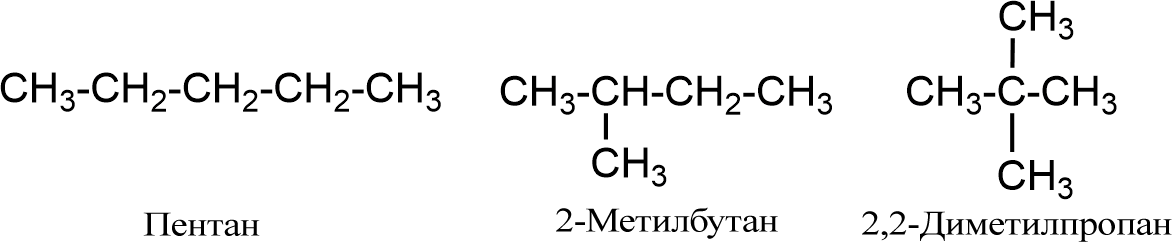
Алкани Алкани або аліфатичні насичені вуглеводні - сполуки з відкритим (нециклічним) ланцюгом, у молекулах яких атоми вуглецю сполучені між собою σ-зв'язком. Атом вуглецю в алканах знаходиться у стані sp3-гібридизації. Алкани утворюють гомологічний ряд, в якому кожен член відрізняється на постійну структурну одиницю -CH2-, що називається гомологічною різницею. Найпростіший представник - метан CH4. Загальна формула алканів: CnH2n+2 Ізомерія Починаючи з бутану C4H10 для алканів характерна структурна ізомерія. Кількість структурних ізомерів зростає зі збільшенням кількості вуглецевих атомів у молекулі алканів. Так, для пентану C5H12 відомо три ізомери, для октану C8H18 - 18, для декану C10H22 - 75.
Номенклатура IUPAC У назвах алканів використовують префікси н-, втор-, ізо, трет-, нео: н- означає нормальну (нерозгалужену) будову вуглеводневого ланцюга; втор- застосовується лише для вторинного бутилу; трет- означає алкіл третинної структури; ізо розгалуження на кінці ланцюга; нео використовується для алкілу з четвертинним атомом вуглецю. Префікси ізо і нео пишуться разом, а н-, втор-, трет- через дефіс. Номенклатура розгалужених алканів побудована заснована на таких основних правилах: Для побудови назви вибирають найдовший ланцюг атомів вуглецю й нумерують його арабськими цифрами (локантами), починаючи з кінця, ближче до якого розміщений замісник, наприклад:
Якщо у бокових відгалуженнях головного ланцюга розміщені різні алкіли-замісники, то їх переразовують за алфавітом (при цьому помножуючі префікси ди-, тетра- тощо, а також префікси н-, втор-, трет- не беруть до уваги), наприклад: Якщо можливі два або більше варіантів найдовшого ланцюга, то обирають той, який має максимальну кількість бічних розгалужень. Назви складніших алкільних груп будуються за тим же принципам, що і назви алканів, але нумерація ланцюга алкілу завжди автономна і починається з того атому вуглецю, який має вільну валентність.
Одержання з галогеналкілів
1.1. Взаємодія з металічним натрієм (Вюрц, 1855 р.). Реакція полягає у взаємодії лужного металу з галогеналкілом та застосовується для синтезу вищих симетричних алканів: 2CH3-I + 2Na ⇄ CH3-CH3 + 2NaI У разі участі у реакції двох різних галогеналкілів утворюється суміш алканів: 3CH3-I + 3CH3CH2-I + 6Na → CH3-CH3 + CH3CH2CH3 + CH3CH2CH2CH3 + 6NaI 1.2 Взаємодія з літійдіалкілкупратами. Метод (інколи називають реакцією Е. Корі - Х. Хауса) полягає у взаємодії реакційноздатних літійдіалкілкупратів R2CuLi з галогеналкілами. Спочатку відбувається взаємодія металічного літію з галогеналканом у середовищі етеру. Далі відповідний алкіллітій реагує з галогенідом міді(I) з утворенням розчинного літійдіалкілкупрату: CH3Cl + 2Li → CH3Li + LiCl 2CH3Li + CuI → (CH3)2CuLi + LiI При взаємодії такого літійдіалкілкупрату з відповідним галогеналкілом утворюється кінцева сполука: (CH3)2CuLi + 2CH3(CH2)6CH2-I → 2CH3(CH2)6CH2-CH3 + LiI + CuI Метод дозволяє досягти виходу алканів майже 100% при застосуванні первинних галогеналкілів. При їх вторинній або третинній будові вихід складає лише 30-55%. Природа алкільної складової в літійдіалкілкупраті мало впливає на вихід алкану.
1.3 Відновлення галогеналкілів. Відновлювати галогеналкіли можливо каталітично збудженим молекулярним воднем, атомарним воднем, йодоводнем тощо: CH3I + H2 → CH4 + HI (каталізатор Pd) CH3CH2I + 2H → CH3CH3 + HI CH3I + HI → CH4 + I2 Метод має препаративне значення, часто використовують сильний відновник - йодоводень. 2. Одержання з солей карбонових кислот. R-COONa ⇄ R-COO- + Na+ На аноді аніон карбонової кислоти окиснюється, утворюючи вільний радикал, і легко декарбоксилюється чи відщеплює CO2. Алкільні радикали далі внаслідок рекомбінації перетворюються в алкани: R-COO- → R-COO• + e- R-COO• → R• + CO2 R• + R• → R-R Препаративний метод Кольбе вважається ефективним при наявності відповідних карбонових кислот і неможливості застосувати інші методи синтезу. CH3CH2COONa + NaOH → Na2CO3 + CH3CH3 3. Відновлення кисневмісних сполук (спиртів, кетонів, карбонових кислот). Відновниками виступають вищезгадані сполуки. Найчастіше застосовують йодоводень, який здатен відновлювати навіть кетони: R-OH + 2HI → R-H + I2 + H2O CH3-CO-CH3 + 4HI → CH3-CH2-CH2 + 2I2 + H2O У препаративному плані часто використовують відновлення карбонільних сполук за Е. Клемменсеном та М. Кіжнером. 4. Гідрування ненасичених вуглеводнів. Реакція гідрування ненасичених сполук широко застосовується при переході від одного класу вуглеводнів до іншого.
16. Хімічні властивості алканів За звичайних умов алкани хімічно інертні. Вони стійкі до дії багатьох реагентів: не взаємодіють із концентрованими сульфатною та нітратною кислотами, з концентрованими й розплавленими лугами, не окиснюються сильними окисниками — калій перманганатом KMnO4 тощо. Хімічна стійкість алканів пояснюється високою міцністю зв’язків C − C та C − H, а також їхньою неполярністю. 1. Галогенування. При взаємодії алканів з галогенами (хлором і бромом) під дією ультрафіолетового випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогензаміщених алканів. Загальна схема цієї реакції показана на прикладі метану:
2. Нітрування (реакція Коновалова). Під час дії нітратної кислоти на алкани при температурі +140°С та невеликому тиску протікає радикальна реакція:
3. Ізомеризація. Нормальні алкани за певних умов можуть перетворюватися в алкани з розгалуженим ланцюгом:
Ці реакції мають велике промислове значення. Таким шляхом висококиплячі фракції нафти (мазут) перетворюють у бензин, гас та інші цінні продукти. 5. Окиснення. При м’якому окисненні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
М’яке каталітичне окиснення бутану киснем повітря — один із промислових способів добування оцтової кислоти:
На повітрі алкани згорають до CO2 та H2O:
Застосування алканів Основним природним джерелом цих речовин є настільки цінні продукти, як природний газ і нафту. Області застосування алканів на сьогоднішній день дуже широкі і різноманітні. Наприклад, газоподібні речовини використовують як цінне джерело палива. Прикладом може служити метан, з якого і складається природний газ, а також пропанобутанової суміш. Ще одне джерело алканів – нафту, значення якої для сучасного людства переоцінити важко. До нафтовим продуктам відносять: бензини – використовуються в якості палива; гас; дизельне паливо, або легкий газойль; важкий газойль, який застосовують в якості мастильного олії; залишки нафтової перегонки використовують для виготовлення асфальту. Нафтові продукти також використовуються для отримання пластмас, синтетичних волокон, каучуків і деяких миючих засобів. Але застосування алканів набагато ширше. Деякі рідкі форми цих речовин використовуються як розчинники, а також в якості ракетного палива. Вазелін і вазелінове масло – продукти, які складаються з суміші алканів. Їх використовують у медицині і косметології (в основному для приготування мазей і кремів), а також у парфумерії. Парафін – ще один всім відомий продукт, які представляє собою суміш твердих алканів. Це тверда біла маса, температура топлення якої становить 50 – 70 градусів. У сучасному виробництві парафін використовується для виготовлення свічок. Цим же речовиною просочують сірники. У медицині за допомогою парафіну проводять різного роду теплові процедури.
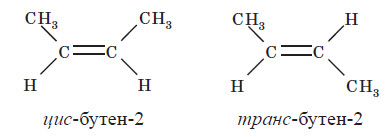
17. Ізомерія алкенів Структурна ізомерія алкенів обумовлена ізомерією карбонового ланцюга (наприклад, бутен-1 і 2-метилпропен) та ізомерією положення подвійного зв’язку (бутен-1 і бутен-2). Просторова ізомерія, або цис-транс-ізомерія, обумовлена різним положенням замісників щодо площини подвійного зв’язку. Якщо кожен з атомів Карбону при зв’язку C = C пов’язаний із двома різними замісниками, то ці замісники можуть розташовуватися з одного боку від площини подвійного зв’язку (цис-ізомер) або по обидва боки (транс-ізомер), наприклад:
Ці два ізомери не можна перевести один в одного без обертання навколо подвійного зв’язку C = C, а це обертання вимагає його розриву й витрати великої кількості енергії, тому цис- і транс-ізомери являють собою різні індивідуальні речовини, які відрізняються одна від одної фізичними й хімічними властивостями. Алкени, в яких хоча б один з атомів Карбону при зв’язку C = C має два однакових замісники, не мають цис-транс-ізомерів. Номенклатура алкенів У алкенах з нерозгалуженим карбоновим ланцюгом нумерацію атомів Карбону починають із того кінця, до якого ближче перебуває подвійний зв’язок. У назві відповідного алкану закінчення -ан замінюється на -ен. У розгалужених алкенах головний ланцюг вибирають так, щоб він містив подвійний зв’язок, навіть якщо він при цьо му й не буде найдовшим. Перед назвою головного ланцюга вказують номер атома Карбону, при якому перебуває замісник, і назву цього замісника. Номер після назви головного ланцюга вказує положення подвійного зв’язку, наприклад:
Будова алкенів Атоми Карбону при подвійному зв’язку перебувають у стані sp2-гібридизації. Три σ-зв’язки, утворені гібридними орбіталями, розташовуються в одній площині під кутом 120° один щодо одного. Утворений Добування алкенів 1. Основним промисловим джерелом алкенів є крекінг алканів, які входять до складу нафти:
Крекінг протікає за вільнорадикальним механізмом при високих температурах (+400—700 °С). 2. Інший промисловий спосіб добування алкенів — дегідрування алканів:
У лабораторних умовах алкени добувають за реакціями відщеплення (елімінування), при яких від сусідніх атомів Карбону відщеплюються два атоми або дві групи атомів, і утворюється додатковий зв’язок. До таких реакцій належать наступні: а) Дегідратація спиртів відбувається при їхньому нагріванні з водовідіймальними засобами, наприклад із сульфатною кислотою при температурі понад +150 °С:
б) Відщеплення галогеноводнів проводять при дії розчинів лугів на моноалкілгалогеніди:
3. Дегалогенування відбувається при нагріванні дигалогеналканів, які мають атоми галогену в сусідніх атомів Карбону, з активними двовалентними металами:
18. Промислові методи одержання алкенів 1. Виділення з продуктів крекінгу нафти та природного газу Основним промисловим методом отримання алкенів є каталітичний і високотемпературний крекінг вуглеводнів нафти і природного газу. Таким чином добувають основну кількість етилену, пропілену, бутиленів. 2. Дегідрування алканів Це один з промислових способів отримання алкенів. Для запобігання розриву C–C зв'язків реакцію проводять за температури 350-450 °C з каталізатором - Cr2O3. Також використовуються алюмомолібденові і алюмоплатінові каталізатори. II. Лабораторні методи одержання алкенів 1. Дегідратація спиртів Дегідратацію спиртів проводять при підвищеній температурі в присутності сильних мінеральних кислот та інших водовідбірних речовин: H2SO4, H3PO4, P2O5, KHSO4, Al2O3тощо. CH3–CH2–OH → CH2=CH2 + H2O Найлегше дегідратуються третинні спирти. Відщеплення води від спиртів з розгалуженою структурою підпорядковується правилу О. Зайцева Алкадієни Дієнові вуглеводні або алкадієни - це ненасичені вуглеводні, містять два подвійні карбон - карбонові зв'язки. Загальна формула алкадієнів CnH2n-2. Номенклатура алкадієнів За правилами IUPAC головний ланцюг молекули алкадієну повинен включати два подвійних зв'язки. Нумерація атомів Карбону в ланцюзі проводиться так, щоб подвійні зв'язки отримали найменші номери. Назви алкадієнів утворюють від назв відповідних алканів (з тим же числом атомів Карбону), в яких остання буква замінюється закінченням -дієн. За систематичною номенклатурою назва алканів має наступну структуру: замісники + головний ланцюг + закінчення -дієн Класифікація Відповідно до розміщення подвійних зв'язків один відносно одного алкадієни поділяються на три типи: 1) кумульовані - подвійні зв'язки містяться біля одного атома Карбону =C=. 2) спряжені - подвійні зв'язки розділені одним простим =С–C= 3) ізольовані - подвійні зв'язки розділені двома і більше простими =C–(C)n–C=, де n – 1,2 і т. д. Будова дієнів
4π-електронна система: перекривання p-орбіталей чотирьох Карбонів у молекулі з утворенням трьох π-зв'язків над і під площиною пласкої молекули Дієни мають кратні зв'язки, та мають відкритий карбоновий кістяк, тобто є ненасиченими аліфатичними вуглеводнями. Загальна формула — CnH2n-2, відповідно, дієнові вуглеводні є структурними ізомерами алкінів. Алкіни Алкіни або ацетиленові вуглеводні - це аліфатичні ненасичені вуглеводні, в молекулах яких між атомами Карбону міститься один потрійний зв'язок –C≡C–. Алкіни утворюють гомологічний ряд загальної формули CnH2n-2, родоначальником ряду є ацетилен НС≡СН. Як видно із загальної формули, алкіни є ізомерами алкадієнів. Електронна будова Вуглецеві атоми в молекулі ацетилену перебувають у стані sp-гібридизації. Це означає, що кожен атом Карбону володіє двома гібридними sp-орбиталями, осі яких розташовані на одній лінії під кутом 180° один до одного, а дві p-орбіталі залишаються негібридними. По одній гібридній орбіталі кожного атома Карбону взаємно перекриваються з утворенням σ-зв'язку. Інша гібридна орбіталь перекривається з s-орбиталлю атома Гідрогену, утворюючи σ-зв'язок С-Н. Дві негібридні π-орбіталі кожного атома Карбону, розташовані перпендикулярно одиа одномій і перпендикулярно напрямку σ-зв'язків, взаємно перекриваються і утворюють два π-зв'язки. Таким чином, потрійний зв'язок характеризується поєднанням одніого σ-і двох π-зв'язків. Довжина потрійного зв'язку становить 0,120 нм, і значно коротша за довжину C–C (0,154 нм) для алкану і C=C (0,133 нм) для алкену. Номенклатура та ізомерія алкінів Назва алкінів за номенклатурою IUPAC утворюються з назв аналогічно побудованих алканів заміною суфіксу -ан на -ин (-ін) із зазначенням цифрою місця розташування потрійного зв'язку. Головний карбоновий ланцюг повинен включати потрійний зв'язок, навіть якщо він не найдовший. Нумерацію ланцюга починають з того кінця, ближче до якого знаходиться потрійний C≡C зв'язок.
Для алкінів характерна міжкласова ізомерія, ізомерія карбонового ланцюга та місця положення потрійного зв'язку.
1. Карбідний метод. Метод започаткований Ф. Велером 1862 р. Метод потребує значних енергетичних затрат і не є економічно вигідним. Метод базується на випалі вапняку та його подальшому спіканні з вугіллям (коксом) при 2000°C. В результаті реакції утворюється карбід кальцію CaC2, який гідролізують до ацетилену:
CaCO3 → CaO + CO2 CaO + 3C → CaC2 + CO CaC2 + 2H2O → Ca(OH)2 + HC≡CH
Mg2C3 + 4H2O → CH3-C≡CH + 2Mg(OH)2
2CH4 → HC≡CH + 3H2
Перспективним методом є окиснювальний піроліз або електрокрекінг метану (температура близько 1500°C) з виходом ацетилену до 15%:
4CH4 + O2 → HC≡CH + 2CO + 7H2
C6H14 → 3HC≡CH + 4H2
1. Відщеплення галогеноводню від дигалогеналканів або галогеналкенів (дегідрогалогенування). При підвищених температурах у присутності спиртових розчинів концентрованого лугу або інших сильних основ (алкоголятів, амідів натрію) утворюються алкіни:
CH2Br-CH2Br
2. Реакції алкілування. Атоми водню в ацетилені заміщуються атомами металів з утворенням ацетиленідів, які при дії алкілгалогенідів перетворюються у відповідні алкіни:
HC≡CH + NaNH2 → HC≡C-Na + NH3 HC≡C-Na + CH3Br → HC≡C-CH3 + NaBr Хімічні властивості алкінів Хімічні властивості алкінів схожі з алкенами, що обумовлено їхньою ненасиченістю. Однак, внаслідок особливостей будови потрійного зв'язку алкіни проявляють меншу здатність до реакцій електрофільного приєднання Ae порівняно з алкенами і вступають в реакції нуклеофільного приєднання An, в яку алкени не вступають. Для алкінів характерні реакції приєднання, окиснення, полімеризації, ізомеризації та заміщення. I. Реакції приєднання 1. Гідрування Гідрування алкінів здійснюється при нагріванні з тими ж металічними каталізаторами (Ni, Pd або Pt), що й у випадку алкенів, але з меншою швидкістю. На першій стадії алкін гідрується до алкену, а на другій швидко перетворюється на алкан CH3–C≡CH + H2 → CH3–CH=CH2 CH3–CH=CH2+ H2 → CH3–CH2–CH3 Реакцію можна зупинити на першій стадії використовующи меньш активний каталізатор [Pd/CaCO3/Pb(CH3COO)2] 2. Галогенуванння Електрофільне приєднання галогенів до алкінів проходить повільніше ніж до алкенів і проходить у дві стадії, які відрізняються між собою швидкістю HC≡CH + Cl2 → CHCl=CHCl (1,2-дихлороетен) CHCl=CHCl + Cl2 → CHCl2–CHCl2 (1,1,2,2-тетрахлороетан) Галогенування алкінів проходить як транс -приєднання
3. Гідрогалогенування Взаємодія алкінів з галогеноводнями також проходить за електрофільним механізмом. Реакція йде в дві стадії: спершу утворюється галогеналкен, який далі переходить в дигалогеналкан. Взаємодія галогеноводнів з несиметричними алкінами здійснюється за правилом Марковнікова і відбувається в транс -положення CH3–C≡CH2+ HCl → CH3–CCl=CH2 (2-хлоропропен) CH3–CCl=CH2+ HCl → CH3–CCl2–CH3 (2,2-дихлоропропан) Даною реакцією у промисловості добувають вінілхлорид, який є вихідною речовиною для добування полівінілхлориду (ПВХ) HC≡CH + HCl → CH2=CH–Cl (хлороетен, вінілхлорид) 4. Гідратація алкінів (реакція М. Кучерова) Приєднання води до алкінів відбувається у присутності 10%-ної сульфатної кислоти H2SO4та 3%-го меркурій (ІІ) сульфату HgSO4. Реакція проходить через утвореня нестійкого ненасиченого спирту (енолу) який внаслідок кето-енольної таутомерії переходить в етаналь (у випадку ацетилену) або в кетон (у випадку будь-яких інших алкінів)
5. Приєднання кислот Для проведення реакції алкінів з кислотами як каталізатори використовують солі меркурію (ІІ), купруму (І), кислоти Льюіса тощо Взаємодією ацетилену з етановою кислотою синтезують вінілацетат або вініловий естер оцтової кислоти, який використовують для виробництва полівінілацетату (ПВА).
Взаємодією ціанідної кислоти з ацетиленом синтезують інший важливий продукт нітрил акрилової кислоти (акрилонітрил)
II. Реакції окиснення Ацетилен і його гомологи легко окиснюються різними окисниками (перманганатом калію в кислому і лужному середовищі, дихроматом калію в кислому середовищі, озоном та ін.), але важче ніж алкени. Будова продуктів окиснення залежить від природи окисників і умов проведення реакцій. Алкіни згоряють у кисні з утворення вуглекислого газу і води. При горіння ацетилену виділяється велика кількість теплоти (Q = 1300 кДж/моль) 2HC≡CH + 5O2 → 4CO2+ 2H2O + Q В жорстких умовах (нагрівання, концентрований розчин, кисле середовище) відбувається розщеплення алкіну по потрійному зв'язку з утворенням карбонових кислот В м'яких умовах можливе окиснення без рочеплення карбонового ланцюга. Як окисник може виступати озон (з подальшим відновленням і гідролізом озонідів), KMnO4 в слаболужному або нейтральному середовищі і деякі інші речовини. Таким чином можна одержати α-дикетони III. Полімеризація алкінів 1. Димеризація У присутності солей купруму (I) і амоній хлориду у водному середовищі ацетилен вступає в реакцію димеризації з утворенням вінілацетилену: HC≡CH + HC≡CH → CH2=CH–C≡CH (вінілацетилен, бут-1-ен-3-ін) Реакція може йти далі з утворенням дівінілацетілену CH2=CH–C≡CH + HC≡CH → CH2=CH–C≡C–CH=CH2 (дивінілацетилен, гекса-1,5-дієн-3-ін) 2. Циклізація При нагріванні ацетилену при температурі 500 °С над активованим вугіллям відбувається його тримеризація з утворенням бензолу (реакція Бертло)
Використовуючи каталізатор нікель (II) ціанід утворюється цикло-1,3,5,7-тетраєн
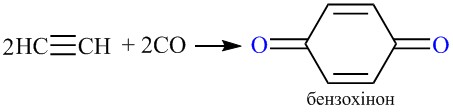
Циклізація у присутності карбон (ІІ) оксиду призводить до утворення бензохінону
3. Полімеризація Внаслідок полімеризація ацетилену можна одержати полієн nHC≡CH → (–CH=CH–)n Спряжені полієни цікаві тим, що з нього можна зробити електропровідний полімер. IV. Ізомеризація Під дією сильних основ алкіни здатні ізомеризуватись. Дана реакція називається реакція О. Фаворського CH3–CH2–C≡CH ↔ CH3–CH=C=CH2 ↔ CH3–C≡C–CH3 V. Реакції заміщення Завдяки "кислому" характеру атома Гідрогену біля потрійного зв'язку алкіни здатні вступати в реакції заміщення. В алкінів кислотні властивості проявлені сильніше ніж в амоніаку і алкенах, але слабше ніж в спиртах. 1. Утворення алкінідів Алкіни здатні реагувати з багатьма металами з утворенням алкінідів або ацетиленідів. Ацетиленід d-металів нестійки і вибухають від удару HC≡CH + 2NaNH2 → NaC≡CNa + 2NH3 (динатрій ацетиленід) 2HC≡CH + 2K → 2HC≡CK + H2 (калій ацетиленід) CH3-C≡CH + C2H5MgBr → CH3-C≡CMgBr + C2H6 (пропінілмагнійбромід або комплекс Йоцича) Реакція алкінів з аміакатами аргентуму або купруму (І) є якісною на наявність кінцевого потрійного зв'язку CH3-C≡CH + [Ag(NH3)2]OH → CH3–C≡CAg + H2O + 2NH3 CH3-C≡CH + [Ag(NH3)2]OH → CH3–C≡CAg + H2O + 2NH3 CH3-C≡C–CH3+ [Cu(NH3)2]OH → реакція не проходить Аргентум пропінід осад білого кольору, купрум (І) пропінід - осад жовтого кольору, нарешті, купрум (І) діацетіленід - осад червоного кольору. 2. Утворення алкінгалогенідів Ацетилен і його термальні гомологи у лужному середовищі галогенуються гіпогалогенідами CH3-C≡CH + Br2+ NaOH → CH3-C≡C–Br + NaBr + H2O ЗАСТОСУВАННЯ АЛКІНІВ Хімія алкинов настільки багата й різноманітна, що ацетилен розглядається в багатьох країнах, що не мають власних запасів нафти, як найважливіша сировина для хімічної промисловості. Найбільші успіхи в цьому відношенні були досягнуті в Німеччині та Росії, незважаючи на те що наша країна має багатющими запасами нафти. Численні синтези практично важливих речовин в наших країнах пов’язані з іменами видатних хіміків Вальтера Реппе, Олексія Евграфовича Фаворського і його учня Михайла Федоровича Шостаковского. Найважливіші галузі застосув
|
||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1069; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.019 с.) |



 4. Крекінг — це гомолітичний розрив зв’язків C − C, що протікає при нагріванні й під дією каталізаторів. При крекінгу алканів утворюються алкени й нижчі алкани, при крекінгу метану й етану утворюється ацетилен:
4. Крекінг — це гомолітичний розрив зв’язків C − C, що протікає при нагріванні й під дією каталізаторів. При крекінгу алканів утворюються алкени й нижчі алкани, при крекінгу метану й етану утворюється ацетилен:








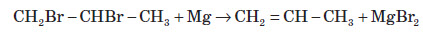


 CH2=CHBr + HBr
CH2=CHBr + HBr  HC≡CH + HBr
HC≡CH + HBr