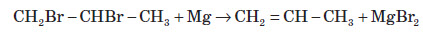Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
За головний вуглецевий ланцюг обирають той, котрий містить максимальне (у порядку убиваючої значимості) число: 1) функціональних груп; 2) кратних зв’язків; 3) атомів Карбону; 4) замісників.Содержание книги
Поиск на нашем сайте Замісником називають будь-який атом або групу атомів, котрі не входять до родоначальної структури. Поняття “замісник” включає у себе функціональну групу і радикал. Радикал – це залишок молекули вуглеводню, що утворюється в результаті видалення одного або декількох атомів Гідрогену. Утворену вільну валентність позначають рискою. За кількістю вільних валентностей розрізняють одно- дво- і тривалентні радикали: В залежності від природи атома Карбону розрізняють первинні, вторинні і третинні радикали. 4. Визначивши родоначальну структуру, нумерують її атоми таким чином, щоб старша дістала, по можливості, найменший номер. Якщо старшої групи немає, перевагу надають кратним зв’язкам, а при їх відсутності – замісникам. 5. Складають назву сполуки, дотримуючись такої послідовності: - алфавітний порядок функціональних груп, окрім старшої, та вуглеводневих радикалів (префікс); - назва родоначальної структури (корінь); - кратні зв’язки і старшу функціональну групу (суфікс). = зв’язок – “ен”, зв’язок – “ин (ін)” Кількість замісників: ди – (два), три – (три), тетра – (чотири), пента – п’ять.
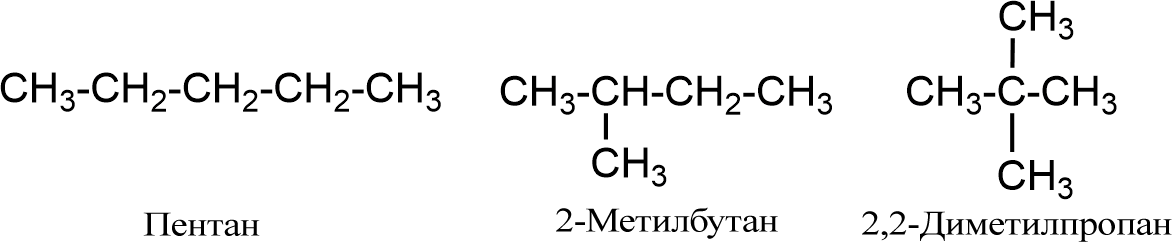
Алкани Алкани або аліфатичні насичені вуглеводні - сполуки з відкритим (нециклічним) ланцюгом, у молекулах яких атоми вуглецю сполучені між собою σ-зв'язком. Атом вуглецю в алканах знаходиться у стані sp3-гібридизації. Алкани утворюють гомологічний ряд, в якому кожен член відрізняється на постійну структурну одиницю -CH2-, що називається гомологічною різницею. Найпростіший представник - метан CH4. Загальна формула алканів: CnH2n+2 Ізомерія Починаючи з бутану C4H10 для алканів характерна структурна ізомерія. Кількість структурних ізомерів зростає зі збільшенням кількості вуглецевих атомів у молекулі алканів. Так, для пентану C5H12 відомо три ізомери, для октану C8H18 - 18, для декану C10H22 - 75.
Номенклатура IUPAC У назвах алканів використовують префікси н-, втор-, ізо, трет-, нео: н- означає нормальну (нерозгалужену) будову вуглеводневого ланцюга; втор- застосовується лише для вторинного бутилу; трет- означає алкіл третинної структури; ізо розгалуження на кінці ланцюга; нео використовується для алкілу з четвертинним атомом вуглецю. Префікси ізо і нео пишуться разом, а н-, втор-, трет- через дефіс. Номенклатура розгалужених алканів побудована заснована на таких основних правилах: Для побудови назви вибирають найдовший ланцюг атомів вуглецю й нумерують його арабськими цифрами (локантами), починаючи з кінця, ближче до якого розміщений замісник, наприклад:
Якщо у бокових відгалуженнях головного ланцюга розміщені різні алкіли-замісники, то їх переразовують за алфавітом (при цьому помножуючі префікси ди-, тетра- тощо, а також префікси н-, втор-, трет- не беруть до уваги), наприклад: Якщо можливі два або більше варіантів найдовшого ланцюга, то обирають той, який має максимальну кількість бічних розгалужень. Назви складніших алкільних груп будуються за тим же принципам, що і назви алканів, але нумерація ланцюга алкілу завжди автономна і починається з того атому вуглецю, який має вільну валентність.
Промислові та лабораторні методи добування анканів 1. Добування алканів газу. Природний газ складається головним чином з метану та невеликих домішок етану, пропану, бутану. Газ під тиском при знижених при знижених температурах розділяють на відповідні фракції. nC + (n+1)H2 = CnH2n+2 4. Оксосинтез алканів (метод Ф. Фішера - Г. Тропша, 1922 р.). За методом Фішера - Тропша алкани одержують з синтез-газу. Синтез газ являє собою суміш CO та H2 з різним співвідношенням. Його отримують з метану однією з реакцій, які відбуваються при 800-900°C в присутності оксиду нікелю NiO, нанесеного на Al2O3:
CH4 + H2O ⇄ CO + 3H2 CH4 + CO2 ⇄ 2CO + 2H2 2CH4 + O2 ⇄ 2CO + 4H2 5. Суха перегонка. У відносно невеликих кількостях алкани одержують за допомогою сухої перегонки або нагрівання вугілля, сланців, деревини, торфу без доступу повітря. Приблизний склад отриманої суміші при цьому становить 60% водню, 25% метану та 3-5% етилену. Лабораторні методи добування Одержання з галогеналкілів
1.1. Взаємодія з металічним натрієм (Вюрц, 1855 р.). Реакція полягає у взаємодії лужного металу з галогеналкілом та застосовується для синтезу вищих симетричних алканів: 2CH3-I + 2Na ⇄ CH3-CH3 + 2NaI У разі участі у реакції двох різних галогеналкілів утворюється суміш алканів: 3CH3-I + 3CH3CH2-I + 6Na → CH3-CH3 + CH3CH2CH3 + CH3CH2CH2CH3 + 6NaI 1.2 Взаємодія з літійдіалкілкупратами. Метод (інколи називають реакцією Е. Корі - Х. Хауса) полягає у взаємодії реакційноздатних літійдіалкілкупратів R2CuLi з галогеналкілами. Спочатку відбувається взаємодія металічного літію з галогеналканом у середовищі етеру. Далі відповідний алкіллітій реагує з галогенідом міді(I) з утворенням розчинного літійдіалкілкупрату: CH3Cl + 2Li → CH3Li + LiCl 2CH3Li + CuI → (CH3)2CuLi + LiI При взаємодії такого літійдіалкілкупрату з відповідним галогеналкілом утворюється кінцева сполука: (CH3)2CuLi + 2CH3(CH2)6CH2-I → 2CH3(CH2)6CH2-CH3 + LiI + CuI Метод дозволяє досягти виходу алканів майже 100% при застосуванні первинних галогеналкілів. При їх вторинній або третинній будові вихід складає лише 30-55%. Природа алкільної складової в літійдіалкілкупраті мало впливає на вихід алкану.
1.3 Відновлення галогеналкілів. Відновлювати галогеналкіли можливо каталітично збудженим молекулярним воднем, атомарним воднем, йодоводнем тощо: CH3I + H2 → CH4 + HI (каталізатор Pd) CH3CH2I + 2H → CH3CH3 + HI CH3I + HI → CH4 + I2 Метод має препаративне значення, часто використовують сильний відновник - йодоводень. 2. Одержання з солей карбонових кислот. R-COONa ⇄ R-COO- + Na+ На аноді аніон карбонової кислоти окиснюється, утворюючи вільний радикал, і легко декарбоксилюється чи відщеплює CO2. Алкільні радикали далі внаслідок рекомбінації перетворюються в алкани: R-COO- → R-COO• + e- R-COO• → R• + CO2 R• + R• → R-R Препаративний метод Кольбе вважається ефективним при наявності відповідних карбонових кислот і неможливості застосувати інші методи синтезу. CH3CH2COONa + NaOH → Na2CO3 + CH3CH3 3. Відновлення кисневмісних сполук (спиртів, кетонів, карбонових кислот). Відновниками виступають вищезгадані сполуки. Найчастіше застосовують йодоводень, який здатен відновлювати навіть кетони: R-OH + 2HI → R-H + I2 + H2O CH3-CO-CH3 + 4HI → CH3-CH2-CH2 + 2I2 + H2O У препаративному плані часто використовують відновлення карбонільних сполук за Е. Клемменсеном та М. Кіжнером. 4. Гідрування ненасичених вуглеводнів. Реакція гідрування ненасичених сполук широко застосовується при переході від одного класу вуглеводнів до іншого.
16. Хімічні властивості алканів За звичайних умов алкани хімічно інертні. Вони стійкі до дії багатьох реагентів: не взаємодіють із концентрованими сульфатною та нітратною кислотами, з концентрованими й розплавленими лугами, не окиснюються сильними окисниками — калій перманганатом KMnO4 тощо. Хімічна стійкість алканів пояснюється високою міцністю зв’язків C − C та C − H, а також їхньою неполярністю. 1. Галогенування. При взаємодії алканів з галогенами (хлором і бромом) під дією ультрафіолетового випромінювання або високої температури утворюється суміш продуктів від моно- до полігалогензаміщених алканів. Загальна схема цієї реакції показана на прикладі метану:
2. Нітрування (реакція Коновалова). Під час дії нітратної кислоти на алкани при температурі +140°С та невеликому тиску протікає радикальна реакція:
3. Ізомеризація. Нормальні алкани за певних умов можуть перетворюватися в алкани з розгалуженим ланцюгом:
Ці реакції мають велике промислове значення. Таким шляхом висококиплячі фракції нафти (мазут) перетворюють у бензин, гас та інші цінні продукти. 5. Окиснення. При м’якому окисненні метану киснем повітря в присутності різних каталізаторів можуть бути отримані метиловий спирт, формальдегід, мурашина кислота:
М’яке каталітичне окиснення бутану киснем повітря — один із промислових способів добування оцтової кислоти:
На повітрі алкани згорають до CO2 та H2O:
Застосування алканів Основним природним джерелом цих речовин є настільки цінні продукти, як природний газ і нафту. Області застосування алканів на сьогоднішній день дуже широкі і різноманітні. Наприклад, газоподібні речовини використовують як цінне джерело палива. Прикладом може служити метан, з якого і складається природний газ, а також пропанобутанової суміш. Ще одне джерело алканів – нафту, значення якої для сучасного людства переоцінити важко. До нафтовим продуктам відносять: бензини – використовуються в якості палива; гас; дизельне паливо, або легкий газойль; важкий газойль, який застосовують в якості мастильного олії; залишки нафтової перегонки використовують для виготовлення асфальту. Нафтові продукти також використовуються для отримання пластмас, синтетичних волокон, каучуків і деяких миючих засобів. Але застосування алканів набагато ширше. Деякі рідкі форми цих речовин використовуються як розчинники, а також в якості ракетного палива. Вазелін і вазелінове масло – продукти, які складаються з суміші алканів. Їх використовують у медицині і косметології (в основному для приготування мазей і кремів), а також у парфумерії. Парафін – ще один всім відомий продукт, які представляє собою суміш твердих алканів. Це тверда біла маса, температура топлення якої становить 50 – 70 градусів. У сучасному виробництві парафін використовується для виготовлення свічок. Цим же речовиною просочують сірники. У медицині за допомогою парафіну проводять різного роду теплові процедури.
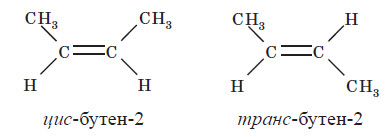
17. Ізомерія алкенів Структурна ізомерія алкенів обумовлена ізомерією карбонового ланцюга (наприклад, бутен-1 і 2-метилпропен) та ізомерією положення подвійного зв’язку (бутен-1 і бутен-2). Просторова ізомерія, або цис-транс-ізомерія, обумовлена різним положенням замісників щодо площини подвійного зв’язку. Якщо кожен з атомів Карбону при зв’язку C = C пов’язаний із двома різними замісниками, то ці замісники можуть розташовуватися з одного боку від площини подвійного зв’язку (цис-ізомер) або по обидва боки (транс-ізомер), наприклад:
Ці два ізомери не можна перевести один в одного без обертання навколо подвійного зв’язку C = C, а це обертання вимагає його розриву й витрати великої кількості енергії, тому цис- і транс-ізомери являють собою різні індивідуальні речовини, які відрізняються одна від одної фізичними й хімічними властивостями. Алкени, в яких хоча б один з атомів Карбону при зв’язку C = C має два однакових замісники, не мають цис-транс-ізомерів. Номенклатура алкенів У алкенах з нерозгалуженим карбоновим ланцюгом нумерацію атомів Карбону починають із того кінця, до якого ближче перебуває подвійний зв’язок. У назві відповідного алкану закінчення -ан замінюється на -ен. У розгалужених алкенах головний ланцюг вибирають так, щоб він містив подвійний зв’язок, навіть якщо він при цьо му й не буде найдовшим. Перед назвою головного ланцюга вказують номер атома Карбону, при якому перебуває замісник, і назву цього замісника. Номер після назви головного ланцюга вказує положення подвійного зв’язку, наприклад:
Будова алкенів Атоми Карбону при подвійному зв’язку перебувають у стані sp2-гібридизації. Три σ-зв’язки, утворені гібридними орбіталями, розташовуються в одній площині під кутом 120° один щодо одного. Утворений Добування алкенів 1. Основним промисловим джерелом алкенів є крекінг алканів, які входять до складу нафти:
Крекінг протікає за вільнорадикальним механізмом при високих температурах (+400—700 °С). 2. Інший промисловий спосіб добування алкенів — дегідрування алканів:
У лабораторних умовах алкени добувають за реакціями відщеплення (елімінування), при яких від сусідніх атомів Карбону відщеплюються два атоми або дві групи атомів, і утворюється додатковий зв’язок. До таких реакцій належать наступні: а) Дегідратація спиртів відбувається при їхньому нагріванні з водовідіймальними засобами, наприклад із сульфатною кислотою при температурі понад +150 °С:
б) Відщеплення галогеноводнів проводять при дії розчинів лугів на моноалкілгалогеніди:
3. Дегалогенування відбувається при нагріванні дигалогеналканів, які мають атоми галогену в сусідніх атомів Карбону, з активними двовалентними металами:
18. Промислові методи одержання алкенів 1. Виділення з продуктів крекінгу нафти та природного газу Основним промисловим методом отримання алкенів є каталітичний і високотемпературний крекінг вуглеводнів нафти і природного газу. Таким чином добувають основну кількість етилену, пропілену, бутиленів. 2. Дегідрування алканів Це один з промислових способів отримання алкенів. Для запобігання розриву C–C зв'язків реакцію проводять за температури 350-450 °C з каталізатором - Cr2O3. Також використовуються алюмомолібденові і алюмоплатінові каталізатори. II. Лабораторні методи одержання алкенів 1. Дегідратація спиртів Дегідратацію спиртів проводять при підвищеній температурі в присутності сильних мінеральних кислот та інших водовідбірних речовин: H2SO4, H3PO4, P2O5, KHSO4, Al2O3тощо. CH3–CH2–OH → CH2=CH2 + H2O Найлегше дегідратуються третинні спирти. Відщеплення води від спиртів з розгалуженою структурою підпорядковується правилу О. Зайцева
|
||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 748; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.013 с.) |



 4. Крекінг — це гомолітичний розрив зв’язків C − C, що протікає при нагріванні й під дією каталізаторів. При крекінгу алканів утворюються алкени й нижчі алкани, при крекінгу метану й етану утворюється ацетилен:
4. Крекінг — це гомолітичний розрив зв’язків C − C, що протікає при нагріванні й під дією каталізаторів. При крекінгу алканів утворюються алкени й нижчі алкани, при крекінгу метану й етану утворюється ацетилен: