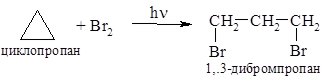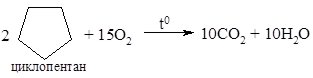Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
При дегідратації вторинних і третинних спиртів і при дегідрогалогенуванні вторинних і третинних галогенідів Гідроген відщеплюється переважно від найменш гідрогенізованого атома КарбонуСодержание книги
Поиск на нашем сайте 2. Дегідрогалогенування і дегалогенування галогеналканів Дегідрогалогенування - процес відщеплення галогеноводню Алкени утворюються при кип'ятінні галогеналканів у спиртовиму розчині лугу
Під дією цинку або солей Cr(II) тримують алкени з дигалогенпохідних
3. Гідрування алкінів та алкадієнів Часткове гідрування алкінів вимагає спеціальних умов і наявність каталізатора (наприклад, дезактивованого паладію - каталізатора Ліндлар) C2H2+ H2 → C2H4
19. Хімічні властивості алкенів Хімічні властивості алкенів визначаються наявністю в їхній молекулі подвійного зв’язку. При приєднанні полярних молекул типу HX (X: Hal, OH, CN) до несиметричних алкенів Гідроген переважно приєднується до більш гідрогенізованого атома Карбону, що примикає до подвійного зв’язку (правило Марковникова). 1. Гідрогалогенування. При взаємодії алкенів з галогеноводнями (HCl, HBr) утворюються галогеналкани:
2. Гідратація. При взаємодії алкенів з водою в присутності мінеральних кислот (сульфатної, фосфатної) утворюютьсяспирти. Мінеральні кислоти виконують роль каталізаторів і є джерелом протонів. Приєднання води також відбувається за правилом Марковникова:
3. Галогенування. Алкени знебарвлюють бромну воду:
Ця реакція є якісною на подвійний зв’язок. 4. Гідрування. Приєднання водню відбувається під дією металевих каталізаторів, найчастіше нікелю:
5. Полімеризація алкенів та їхніх похідних:
6. Окрім приєднання, для алкенів характерні також реакції окиснення.
7. Як і всі інші вуглеводні, алкени горять і при широкому доступі кисню утворюють карбон діоксид та воду:
При обмеженому доступі повітря горіння алкенів може призводити до утворення карбон монооксиду та води:
Будова подвійного зв'язку С=С Подвійний зв'язок є поєднанням - і -зв'язків (хоча вони зображаються двома однаковими рисками, завжди слід враховувати їх нерівноцінність). -зв'язоквиникає при осьовому перекритті sp2-гібридизованих орбіталей, а -зв'язок – при бічному перекритті р-орбіталей сусідніх до sp2-гібридизованих атомів Карбону (лекція 2). Утворення зв'язків в молекулі етилену можна зобразити наступною схемою: Алкадієни Дієнові вуглеводні або алкадієни - це ненасичені вуглеводні, містять два подвійні карбон - карбонові зв'язки. Загальна формула алкадієнів CnH2n-2. Номенклатура алкадієнів За правилами IUPAC головний ланцюг молекули алкадієну повинен включати два подвійних зв'язки. Нумерація атомів Карбону в ланцюзі проводиться так, щоб подвійні зв'язки отримали найменші номери. Назви алкадієнів утворюють від назв відповідних алканів (з тим же числом атомів Карбону), в яких остання буква замінюється закінченням -дієн. За систематичною номенклатурою назва алканів має наступну структуру: замісники + головний ланцюг + закінчення -дієн Класифікація Відповідно до розміщення подвійних зв'язків один відносно одного алкадієни поділяються на три типи: 1) кумульовані - подвійні зв'язки містяться біля одного атома Карбону =C=. 2) спряжені - подвійні зв'язки розділені одним простим =С–C= 3) ізольовані - подвійні зв'язки розділені двома і більше простими =C–(C)n–C=, де n – 1,2 і т. д. Будова дієнів
4π-електронна система: перекривання p-орбіталей чотирьох Карбонів у молекулі з утворенням трьох π-зв'язків над і під площиною пласкої молекули Дієни мають кратні зв'язки, та мають відкритий карбоновий кістяк, тобто є ненасиченими аліфатичними вуглеводнями. Загальна формула — CnH2n-2, відповідно, дієнові вуглеводні є структурними ізомерами алкінів. Алкіни Алкіни або ацетиленові вуглеводні - це аліфатичні ненасичені вуглеводні, в молекулах яких між атомами Карбону міститься один потрійний зв'язок –C≡C–. Алкіни утворюють гомологічний ряд загальної формули CnH2n-2, родоначальником ряду є ацетилен НС≡СН. Як видно із загальної формули, алкіни є ізомерами алкадієнів. Електронна будова Вуглецеві атоми в молекулі ацетилену перебувають у стані sp-гібридизації. Це означає, що кожен атом Карбону володіє двома гібридними sp-орбиталями, осі яких розташовані на одній лінії під кутом 180° один до одного, а дві p-орбіталі залишаються негібридними. По одній гібридній орбіталі кожного атома Карбону взаємно перекриваються з утворенням σ-зв'язку. Інша гібридна орбіталь перекривається з s-орбиталлю атома Гідрогену, утворюючи σ-зв'язок С-Н. Дві негібридні π-орбіталі кожного атома Карбону, розташовані перпендикулярно одиа одномій і перпендикулярно напрямку σ-зв'язків, взаємно перекриваються і утворюють два π-зв'язки. Таким чином, потрійний зв'язок характеризується поєднанням одніого σ-і двох π-зв'язків. Довжина потрійного зв'язку становить 0,120 нм, і значно коротша за довжину C–C (0,154 нм) для алкану і C=C (0,133 нм) для алкену. Номенклатура та ізомерія алкінів Назва алкінів за номенклатурою IUPAC утворюються з назв аналогічно побудованих алканів заміною суфіксу -ан на -ин (-ін) із зазначенням цифрою місця розташування потрійного зв'язку. Головний карбоновий ланцюг повинен включати потрійний зв'язок, навіть якщо він не найдовший. Нумерацію ланцюга починають з того кінця, ближче до якого знаходиться потрійний C≡C зв'язок.
Для алкінів характерна міжкласова ізомерія, ізомерія карбонового ланцюга та місця положення потрійного зв'язку.
1. Карбідний метод. Метод започаткований Ф. Велером 1862 р. Метод потребує значних енергетичних затрат і не є економічно вигідним. Метод базується на випалі вапняку та його подальшому спіканні з вугіллям (коксом) при 2000°C. В результаті реакції утворюється карбід кальцію CaC2, який гідролізують до ацетилену:
CaCO3 → CaO + CO2 CaO + 3C → CaC2 + CO CaC2 + 2H2O → Ca(OH)2 + HC≡CH
Mg2C3 + 4H2O → CH3-C≡CH + 2Mg(OH)2
2CH4 → HC≡CH + 3H2
Перспективним методом є окиснювальний піроліз або електрокрекінг метану (температура близько 1500°C) з виходом ацетилену до 15%:
4CH4 + O2 → HC≡CH + 2CO + 7H2
C6H14 → 3HC≡CH + 4H2
1. Відщеплення галогеноводню від дигалогеналканів або галогеналкенів (дегідрогалогенування). При підвищених температурах у присутності спиртових розчинів концентрованого лугу або інших сильних основ (алкоголятів, амідів натрію) утворюються алкіни:
CH2Br-CH2Br
2. Реакції алкілування. Атоми водню в ацетилені заміщуються атомами металів з утворенням ацетиленідів, які при дії алкілгалогенідів перетворюються у відповідні алкіни:
HC≡CH + NaNH2 → HC≡C-Na + NH3 HC≡C-Na + CH3Br → HC≡C-CH3 + NaBr Хімічні властивості алкінів Хімічні властивості алкінів схожі з алкенами, що обумовлено їхньою ненасиченістю. Однак, внаслідок особливостей будови потрійного зв'язку алкіни проявляють меншу здатність до реакцій електрофільного приєднання Ae порівняно з алкенами і вступають в реакції нуклеофільного приєднання An, в яку алкени не вступають. Для алкінів характерні реакції приєднання, окиснення, полімеризації, ізомеризації та заміщення. I. Реакції приєднання 1. Гідрування Гідрування алкінів здійснюється при нагріванні з тими ж металічними каталізаторами (Ni, Pd або Pt), що й у випадку алкенів, але з меншою швидкістю. На першій стадії алкін гідрується до алкену, а на другій швидко перетворюється на алкан CH3–C≡CH + H2 → CH3–CH=CH2 CH3–CH=CH2+ H2 → CH3–CH2–CH3 Реакцію можна зупинити на першій стадії використовующи меньш активний каталізатор [Pd/CaCO3/Pb(CH3COO)2] 2. Галогенуванння Електрофільне приєднання галогенів до алкінів проходить повільніше ніж до алкенів і проходить у дві стадії, які відрізняються між собою швидкістю HC≡CH + Cl2 → CHCl=CHCl (1,2-дихлороетен) CHCl=CHCl + Cl2 → CHCl2–CHCl2 (1,1,2,2-тетрахлороетан) Галогенування алкінів проходить як транс -приєднання
3. Гідрогалогенування Взаємодія алкінів з галогеноводнями також проходить за електрофільним механізмом. Реакція йде в дві стадії: спершу утворюється галогеналкен, який далі переходить в дигалогеналкан. Взаємодія галогеноводнів з несиметричними алкінами здійснюється за правилом Марковнікова і відбувається в транс -положення CH3–C≡CH2+ HCl → CH3–CCl=CH2 (2-хлоропропен) CH3–CCl=CH2+ HCl → CH3–CCl2–CH3 (2,2-дихлоропропан) Даною реакцією у промисловості добувають вінілхлорид, який є вихідною речовиною для добування полівінілхлориду (ПВХ) HC≡CH + HCl → CH2=CH–Cl (хлороетен, вінілхлорид) 4. Гідратація алкінів (реакція М. Кучерова) Приєднання води до алкінів відбувається у присутності 10%-ної сульфатної кислоти H2SO4та 3%-го меркурій (ІІ) сульфату HgSO4. Реакція проходить через утвореня нестійкого ненасиченого спирту (енолу) який внаслідок кето-енольної таутомерії переходить в етаналь (у випадку ацетилену) або в кетон (у випадку будь-яких інших алкінів)
5. Приєднання кислот Для проведення реакції алкінів з кислотами як каталізатори використовують солі меркурію (ІІ), купруму (І), кислоти Льюіса тощо Взаємодією ацетилену з етановою кислотою синтезують вінілацетат або вініловий естер оцтової кислоти, який використовують для виробництва полівінілацетату (ПВА).
Взаємодією ціанідної кислоти з ацетиленом синтезують інший важливий продукт нітрил акрилової кислоти (акрилонітрил)
II. Реакції окиснення Ацетилен і його гомологи легко окиснюються різними окисниками (перманганатом калію в кислому і лужному середовищі, дихроматом калію в кислому середовищі, озоном та ін.), але важче ніж алкени. Будова продуктів окиснення залежить від природи окисників і умов проведення реакцій. Алкіни згоряють у кисні з утворення вуглекислого газу і води. При горіння ацетилену виділяється велика кількість теплоти (Q = 1300 кДж/моль) 2HC≡CH + 5O2 → 4CO2+ 2H2O + Q В жорстких умовах (нагрівання, концентрований розчин, кисле середовище) відбувається розщеплення алкіну по потрійному зв'язку з утворенням карбонових кислот В м'яких умовах можливе окиснення без рочеплення карбонового ланцюга. Як окисник може виступати озон (з подальшим відновленням і гідролізом озонідів), KMnO4 в слаболужному або нейтральному середовищі і деякі інші речовини. Таким чином можна одержати α-дикетони III. Полімеризація алкінів 1. Димеризація У присутності солей купруму (I) і амоній хлориду у водному середовищі ацетилен вступає в реакцію димеризації з утворенням вінілацетилену: HC≡CH + HC≡CH → CH2=CH–C≡CH (вінілацетилен, бут-1-ен-3-ін) Реакція може йти далі з утворенням дівінілацетілену CH2=CH–C≡CH + HC≡CH → CH2=CH–C≡C–CH=CH2 (дивінілацетилен, гекса-1,5-дієн-3-ін) 2. Циклізація При нагріванні ацетилену при температурі 500 °С над активованим вугіллям відбувається його тримеризація з утворенням бензолу (реакція Бертло)
Використовуючи каталізатор нікель (II) ціанід утворюється цикло-1,3,5,7-тетраєн
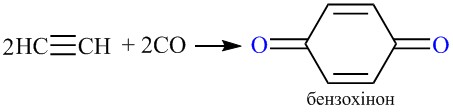
Циклізація у присутності карбон (ІІ) оксиду призводить до утворення бензохінону
3. Полімеризація Внаслідок полімеризація ацетилену можна одержати полієн nHC≡CH → (–CH=CH–)n Спряжені полієни цікаві тим, що з нього можна зробити електропровідний полімер. IV. Ізомеризація Під дією сильних основ алкіни здатні ізомеризуватись. Дана реакція називається реакція О. Фаворського CH3–CH2–C≡CH ↔ CH3–CH=C=CH2 ↔ CH3–C≡C–CH3 V. Реакції заміщення Завдяки "кислому" характеру атома Гідрогену біля потрійного зв'язку алкіни здатні вступати в реакції заміщення. В алкінів кислотні властивості проявлені сильніше ніж в амоніаку і алкенах, але слабше ніж в спиртах. 1. Утворення алкінідів Алкіни здатні реагувати з багатьма металами з утворенням алкінідів або ацетиленідів. Ацетиленід d-металів нестійки і вибухають від удару HC≡CH + 2NaNH2 → NaC≡CNa + 2NH3 (динатрій ацетиленід) 2HC≡CH + 2K → 2HC≡CK + H2 (калій ацетиленід) CH3-C≡CH + C2H5MgBr → CH3-C≡CMgBr + C2H6 (пропінілмагнійбромід або комплекс Йоцича) Реакція алкінів з аміакатами аргентуму або купруму (І) є якісною на наявність кінцевого потрійного зв'язку CH3-C≡CH + [Ag(NH3)2]OH → CH3–C≡CAg + H2O + 2NH3 CH3-C≡CH + [Ag(NH3)2]OH → CH3–C≡CAg + H2O + 2NH3 CH3-C≡C–CH3+ [Cu(NH3)2]OH → реакція не проходить Аргентум пропінід осад білого кольору, купрум (І) пропінід - осад жовтого кольору, нарешті, купрум (І) діацетіленід - осад червоного кольору. 2. Утворення алкінгалогенідів Ацетилен і його термальні гомологи у лужному середовищі галогенуються гіпогалогенідами CH3-C≡CH + Br2+ NaOH → CH3-C≡C–Br + NaBr + H2O ЗАСТОСУВАННЯ АЛКІНІВ Хімія алкинов настільки багата й різноманітна, що ацетилен розглядається в багатьох країнах, що не мають власних запасів нафти, як найважливіша сировина для хімічної промисловості. Найбільші успіхи в цьому відношенні були досягнуті в Німеччині та Росії, незважаючи на те що наша країна має багатющими запасами нафти. Численні синтези практично важливих речовин в наших країнах пов’язані з іменами видатних хіміків Вальтера Реппе, Олексія Евграфовича Фаворського і його учня Михайла Федоровича Шостаковского. Найважливіші галузі застосування ацетилену в плані «властивості? застосування» даються в контексті підручника. Здійснюючи диференційований підхід до контролю засвоєння знань, учням загальноосвітніх класів пропонується записати рівняння реакції між зазначеними речовинами; в профільних класах учні отримують завдання на ланцюжка перетворень, у тому числі з пропусками. Продовжуючи закріплення навичок вирішення завдань різних типів, вчитель в даному розділі може запропонувати завдання на масову частку виходу продукту реакції. 25. Методи синтезу насичених циклів: - з дигалогеналканів за реакцією Вюрца - взаємодія діазометану з алкенами - синтези на основі малонового естеру та похідних дикарбонових кислот - дієновий синтез - гідрування ароматичних вуглеводнів. Хімічні властивості. Більшість циклоалканів малореакційноздатні сполуки і нагадують за хімічними властивостями насичені вуглеводні; подібно до них вступають в основному у реакції заміщення. Виняток становлять циклопропан та циклобутан, які виявляють значну хімічну активність, особливо перший. Для них поряд із реакціями заміщення характерні також і реакції приєднання, які супроводжуються розкриттям циклу. 1. Взаємодія з воднем. Циклопропан та циклобутан у присутності каталізатора вступають у взаємодію з воднем з утворенням відповідно пропану чи бутану.
Циклоалкани з більшим розміром циклу в реакцію гідрування не вступають. Така хімічна поведінка три- та чотиричленних циклів обумовлена їх будовою. На відміну від алканів, молекули яких мають значний ступінь свободи завдяки можливості вільного обертання навколо зв’язку С–С, молекули циклоалканів за рахунок того, що утворюють цикл є жорсткими утвореннями. Для циклоалканів характерна “циклічна напруга”, яка для малих циклів є найбільшою. 2. Взаємодія з галогенами. Циклопропан в умовах УФ-опромінення по-різному реагує з хлором та бромом. Реакція з бромом супроводжується розривом зв’язку С–С та утворенням 1,3-дибромпропану:
З хлором поведінка циклопропану схожа з алканами – він вступає в реакцію заміщення з утворенням хлорциклопропану:
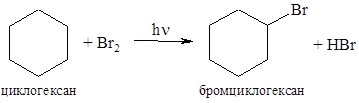
Усі інші циклоалкани як з бромом так і з хлором вступають тільки у реакції заміщення.
3. Горіння. Циклоалкани горять з утворенням карбон (IV) оксиду (вуглекислого газу) та води:
ЦИКЛОАЛКАНИ Циклоалканами або аліціклічними вуглеводнями називають насичені вуглеводні, молекули яких утворюють замкнуті цикли. більше двох заступників мають просторову изомерию. Цей вид ізомерії розглянуто в розділі «Изомерия органічних сполук». Циклоалкани згідно своїй формулі мають велику схожість з алкенами (межклассовая ізомерія). Так звана просторова ізомерія характерна для циклоалканов, які містять два і більше заступника. Номенклатура. Назви конкретних сполук, згідно з номенклатурними правилами IUPAC, утворюють з грецької назви числівника, який вказує число атомів Карбону в головній ланцюжку з додаванням приставок цикло- і на початку ан. Фізичні та хімічні властивості: за своїми властивостями цоіклоалкани дуже схожі на алкани. Істотно відрізняються тільки сполуки, які містять малі цикли (тричленні або четирехчленние). Ці цикли мають достатньо велике напруження через велику відхилення від нормального валентного кута атома Карбону, який знаходиться в стані sp3- гібридизації. Тому на відміну від великих циклів вони можуть вступати в реакції з’єднання: Циклопропан використовують в медицині як наркотичний препарат (у з’єднанні з киснем), циклопентан – у промисловості як розчинник і в органічному синтезі, циклогексан – є сировиною для синтезування поліамідних волокон (капрону, нейлону), з нього також добувають бензен. Насичені вуглеводні мають відносно низьку реакційну здатність. Це обумовлено високою міцністю з’єднань С-С і С-Н, а також їх слабкої полярністю. Більшість реакцій цих сполук супроводжується гомологическом розривом хімічних сполук та виникненням вільних радикалів. Циклоалкани отримують декількома способами: Гідрування бензолу. Під час його гідрування і гомологів бензолу утворюються циклогексан і його похідні.
27.Особливості будови бензену. Поняття про ароматичність. Бензе́н (також бензо́л) — перший представник гомологічного ряду ароматичних вуглеводнів, молекулярна формула C6H6. Безбарвна летка рідина з характерним запахом. Вперше отриманий Майклом Фарадеєм з конденсату піролізу китового жиру в 1825 році. Молекулярна формула — C6H6. Рентгенографічними методами встановлено, що молекула бензену має форму плоского шестикутника з атомами Карбону у вершинах. Усі C—C зв'язки мають однакову довжину, що становить 0.140 нм. Всі атоми Карбону в молекулі бензену перебувають у стані sp2-гібридизації. Tри гібридні орбіталі розташовані під кутом 120°, утворюючи C—C та C—H σ-зв'язки. Hегібридні p-орбіталі розташовані перпендикулярно до площини молекули, утворюючи суцільне електронне кільце. Утворення суцільної π-хмари, що містить шість електронів, надає молекулі бензену так званого ароматичного характеру. Карбоновий скелет молекули бензену з таким характером зв'язку називають бензеновим кільцем, або бензеновим ядром.
28.Бензен:промислові та лабораторні методи синтезу, хімічні властивсті. На сьогоднішній день існує кілька принципово різних способів виробництва бензолу.
Коксування кам’яного вугілля. Цей процес історично був першим та служив основним джерелом бензолу до Другої світової війни. Останнім часом частка бензолу, одержуваного цим способом, становить менше 10 %. Слід додати, що бензол, одержуваний з кам’яновугільної смоли, містить значну кількість тіофена, що робить такий бензол сировиною, непридатним для ряду технологічних процесів. Каталітичний риформінг (аромайзинг) бензинових фракцій нафти. Цей процес є основним джерелом бензолу в США. У Західній Європі, Росії та Японії цим способом отримують 40—60 % від загальної кількості сполуки. У цьому процесі крім бензолу утворюються толуол та ксилоли. З огляду на те, що толуол утворюється в кількостях, що перевищують попит на нього, його також частково переробляють в: бензол — методом гідродеалкілірування; суміш бензолу та ксилолів — методом диспропорціонування; Піроліз бензинових та більш важких нафтових фракцій. До 50 % бензолу виробляється цим методом. Поряд з бензолом утворюються толуол та ксилоли. У деяких випадках всю цю фракцію направляють на стадію деалкілірування, де і толуол, і ксилоли перетворюються на бензол. Тримеризація ацетилену При пропущенні ацетилену при 600 °C над активованим вугіллям з хорошим виходом утворюється бензол та інші ароматичні вуглеводні (реакція М. Д. Зелінського): 3С2Н2 → С6H6 Хімічні властивості Реакції електрофільного заміщення Бензен вступає в реакції електрофільного заміщення, що відбуваються за таким механізмом: на першій стадії відбувається утворення π-комплексу між електрофілом (у формі катіону або сильно поляризованої молекули Eσ+-Nuσ−) та молекулою бензену, внаслідок перекривання НСМО електрофілу із ВЗМО (π-хмарою) бензену. Після цього пара p -електронів виходить із спряженого бензольного кільця і бере участь в утворенні σ-зв'язку із електрофілом, таким чином π-комплекс перетворюється у σ-комплекс або інтермедіат Уелланда. Ця проміжна сполука має позитивний заряд і позбавлена ароматичного характеру, через що є менш стійкою порівняно із ароматичним кільцем, в яке зазвичай швидко перетворюється внаслідок відщеплення протона (цей етап відбувається через ще один проміжний π-комплекс).[4]
Алкілювання та ацилювання за Фріделем-Крафтсом[ред. • ред. код] Докладніше у статті Реакція Фріделя — Крафтса Алкілювання бензену здійснюється алкілгалогенідами, алкенами та спиртами, ацилювання — карбоновими кислотами, галогенангідридами та ангідридами, обидва типи реакцій каталізуються кислотами Люїса. Ці реакції названо в честь їх першовідкривачів Шарля Фріделя та Джеймса Крафтса. Роль каталізатора в цьому типі реакцій полягає у тому, що він взаємодіє із алкілюючим чи ацилюючим реагентом і забезпечує утворення карбкатіону або поляризованого комплексу. Наприклад при взаємодії хлорметану та алюміній хлориду утворюється комплекс із підсиленою електрофільністю атома карбону:
Прикладом реакції алкілювання може бути етилювання бензену хлоретаном.
Проте у промисловості етилбензен частіше отримують реакцією з етиленом, яка також проходить за присутності оксиду алюмінію, фосфатної або сульфатної кислоти:
Продуктами реакцій ацилювання бензену є ароматичні кетони. Прикладом може бути реакція із ацетилхлоридом, продуктом якої є метиларилкетон:
Галогенування На відміну від ненасичених вуглеводнів бензен не знебарвлює бромну воду. Але для нього характерні реакції галогенування, що відбуваються за механізмом електрофільного заміщення, у присутності кислот Льюїса. Наприклад при взаємодії із бромом утворюється бромбензен:
Нітрування Характерною для бензену є реакція нітрування для якої використовують нітруючу суміш, яка складається із концентрованої нітратної кислоти та концентрованої сульфатної кислоти як водовіднімаючого засобу. В цій реакції утворюється нітробензен, що є попередником у синтезі аніліну
Сульфування При дії на бензен концентрованої сульфатної кислоти відбувається його сульфування з утворенням бензосульфонової кислоти, що може бути попередником у синтезі фенолу:
Реакції приєднання Бензен вступає і в реакції приєднання, але значно важче, ніж у реакції заміщення. При цьому він виявляє властивості ненасичених вуглеводнів. Так, у присутностінікелевого каталізатора і при нагріванні відбувається реакція гідрування бензену з утворенням циклогексану:
При цьому атоми Гідрогену приєднуються молекулою бензену за рахунок розриву подвійних зв'язків. Бензен вступає також у реакцію приєднання однієї, двох або трьох молекул хлору. Ця реакція відбувається за вільнорадикальним механізмом, для утворення радикалів хлору необхідне ультрафіолетове світло (досягається опроміненням ртутно-кварцевою лампою). Продуктом повного приєднання є гексахлорциклогексан:
Реакції окиснення На повітрі бензен горить сильно кіптявим полум'ям, оскільки вміст Карбону у ньому значний. Суміш пари бензену з повітрям вибухова. Завдяки ароматичному характеру бензен стійкий до дії окисників: не окиснюється розчином перманганату калію і нітратною кислотою. У присутності каталізатора ванадій(V) оксиду реагує із молекулярним киснем, внаслідок чого утворюється малеїновий ангідрид:
Також бензен окиснюється озоном, ця реакція історично використовувалась для встановлення його будови.
29. Гомологи бензену.6 номенклатура і методи одержаня. Бензен, як і інші вуглеводні, утворює свій гомологічний ряд, що має загальну формулу CnH2n-6. Гомологи бензену можна розглядати як продукти заміщення одного або кількох атомів Гідрогену в молекулі бензену різними вуглеводневими радикалами, що утворюють бічні ланцюги. Найпростішим гомологом бензену є метилбензен — продукт заміщення атома водню в молекулі бензену метильною групою — СН3
Метилбензен, що має технічну назву толуен, являє собою безбарвну рідину з характерним запахом. Температура кипіння 110,6 °C. Густина 0,867 г/см³ За своїми хімічними властивостями метилбензен, або толуен, як інші гомологи бензену, дуже близький до бензену. Так, при дії концентрованої нітратної кислоти, в присутності сульфатної кислоти він легко піддається нітруванню з утворенням тринітротолуену — сильно вибухової речовини
Метилбензен (толуен) добувають з кам'яновугільної смоли і коксового газу разом з бензеном, а потім відокремлюють шляхом дробної перегонки. Метилбензен, або толуен застосовують головним чином для виробництва вибухових речовин — тринітротолуену, який називають ще тротилом і толом. Крім того, толуен служить сировиною для виробництва барвників і інших органічних продуктів.
Коксування кам'яного вугілля. Цей процес історично був першим та служив основним джерелом бензолу до Другої світової війни. Останнім часом частка бензолу, одержуваного цим способом, становить менше 10 %. Слід додати, що бензол, одержуваний з кам'яновугільної смоли, містить значну кількість тіофена, що робить такий бензол сировиною, непридатним для ряду технологічних процесів. Каталітичний риформінг (аромайзинг) бензинових фракцій нафти. Цей процес є основним джерелом бензолу в США. У Західній Європі, Росії та Японії цим способом отримують 40—60 % від загальної кількості сполуки. У цьому процесі крім бензолу утворюються толуол та ксилоли. З огляду на те, що толуол утворюється в кількостях, що перевищують попит на нього, його також частково переробляють в: бензол — методом гідродеалкілірування; суміш бензолу та ксилолів — методом диспропорціонування; Піроліз бензинових та більш важких нафтових фракцій. До 50 % бензолу виробляється цим методом. Поряд з бензолом утворюються толуол та ксилоли. У деяких випадках всю цю фракцію направляють на стадію деалкілірування, де і толуол, і ксилоли перетворюються на бензол. тримеризація ацетилену При пропущенні ацетилену при 600 °C над активованим вугіллям з хорошим виходом утворюється бензол та інші ароматичні вуглеводні (реакція М. Д. Зелінського): 3С2Н2 → С6H6
30.Хімічні властивості гомологів бензену. Галогенування (на прикладі бензолу): Реакція відбувається за умови каталізатора FeCl3 і простої речовини Br2 у чистому вигляді до утворення хлорбензолу і бромідної кислоти. На прикладі толуену: C6H5CH3 + 3 Br2 (водний розчин) → C6H5Br3CH3 + 3 HBr
Окиснення (на прикладі толуену): C6H5CH3 + 3 [O] C6H5COOH + H2O
У великій кількості присутній у кам’яновугільній смолі та продуктах нафтопереробки. Виділяють з продуктів каталітичного риформінгу бензинів послідовною селективною екстракцією та ректифікацією. Його отримують з продуктів сухої перегонки кам'яного вугілля і в процесі дегідроциклізації гептану.
31.Правила орієнтації при електрофільному заміщенні у бензеновому ядрі. (лекційний зошит)
32. Багатоядерні арени: загальна характеристика.
Багатоядерні арени – це органічні сполуки, які складаються з кіль-кох конденсованих або ізольованих бензенових кілець. У складі молекули ароматичних вуглеводнів є одна або кілька груп з 6 атомів вуглецю(Карбону), сполучених у кільце (бензенове ядро) простими і подвійними зв'язками (формула Кекуле). За сучасними уявленнями, атоми Карбону в бензеновому ядрі сполучені електронами двох типів: одні електрони містяться в площині молекули, інші розміщені перпендикулярно до неї. Найпростішим представником ароматичних вуглеводнів є бензен, складнішими — нафтален, антрацен, які мають кілька бензенових ядер.
У великій кількості вони містяться в кам'яновугільній смолі, яку одержують при коксуванні вугілля.
Назва «ароматичні» виникла в зв'язку з тим, що перші сполуки цього класу добували з природних запашних речовин.
33.Галогенопохідні вуглеводнів: класифікаціяі номенклатура.
Галогенопохідними вуглеводнями називають сполуки, які можна розглядати як продукти заміщення одного або декількох атомів водню в молекулі вуглеводню атомами галогенів. Прикладами сполук цього класу можуть служить хлороформ, чотирихлористий вуглець та інші речовини. У залежності від природи вуглеводневого радикала галогенопохідні підрозділяють на аліфатичні, аліциклічні та ароматичні.
Серед аліфатичних розрізняють насичені (галогеналкани) та ненасичені (галогеналкени, галогеналкіни). Ароматичні галогенопохідні поділяють на сполуки, у яких атом галогену безпосередньо зв’язаний з ароматичним ядром (галогенарени), та речовини, що містять атом галогену в боковому ланцюзі (арилалкілгалогеніди).
|
||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 891; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.014 с.) |



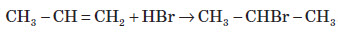


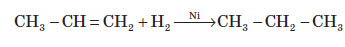



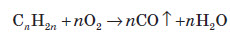


 CH2=CHBr + HBr
CH2=CHBr + HBr  HC≡CH + HBr
HC≡CH + HBr