
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні закономірності фазових переходів у чистій речовиніСодержание книги
Поиск на нашем сайте
Із повсякденного досвіду відомо, що будь-яка речовина в звичайних умовах може знаходитись у одному з трьох агрегатних станів – твердому, рідкому або газоподібному. Вид стану визначається зовнішніми умовами (тиском і температурою), у яких знаходиться речовина. Перехід речовини з одного агрегатного стану в інший відбувається неперервно при зміні зовнішніх умов. Під час такого переходу можливе співіснування різних агрегатних станів, наприклад, речовина одночасно може знаходитись у твердому та рідкому станах, або в рідкому та газоподібному станах. У цьому разі області, де речовина знаходиться в різних агрегатних станах, відокремлені одна від одної поверхнею розділу, при переході через яку раптово змінюються фізичні властивості речовини, у першу чергу її густина. Через можливість такого співіснування доцільно різні агрегатні стани речовини називати фазами, зважаючи на те, що таку назву мають однорідні або гомогенні області в складних або гетерогенних системах, що складаються з різних гомогенних частин. Отже, коли мова йде про різні агрегатні стани чистої речовини, говорять про тверду, рідинну або газоподібну фази речовини. Перехід речовини з однієї фази в іншу, яка співіснує з першою, називається фазовим переходом. Розглянемо основні закономірності фазових переходів чистої речовини, які встановлені експериментально. Для цього зручно користуватися графіками, що, ілюструють ці переходи і які називаються фазовими діаграмами.
На рис. 8.1 показана типова фазова діаграма речовини, що побудована в координатній системі Уявимо, що в циліндрі під поршнем знаходиться речовина в твердому стані (рис. 8.1). Зверху на поршень покладено вагу На першому етапі підведення тепла до тіла, що знаходиться в циліндрі (процес 1-2), буде підвищуватися температура тіла без зміни його агрегатного стану, тобто в циліндрі буде знаходитись тверда фаза речовини
Під час плавлення співіснують дві фази речовини – тверда та рідинна, тобто при плавленні має місце двофазний стан речовини і в циліндрі буде знаходитись суміш Плавлення речовини завершиться в момент, коли в циліндрі зникне тверда фаза і залишиться лише рідинна (т. 3 на рис. 8.1). Для того, щоб це сталося, до речовини в процесі 2-3 необхідно підвести тепло Подальше підведення тепла до рідини викликатиме її нагрівання без зміни агрегатного стану (процес 3-4 на рис. 8.1), тобто в циліндрі в цей час буде знаходитись лише рідинна фаза речовини У процесі кипіння (процес 4-5 на рис. 8.1) до речовини підводиться тепло, яке витрачається на розширення речовини та на долання сил міжмолекулярної взаємодії. Температура речовини при кипінні не змінюється. У цьому процесі в циліндрі знаходиться суміш киплячої рідини та пари Процес кипіння завершується в момент, коли в циліндрі зникає рідина та залишиться лише пара (т. 5 на рис. 8.1). Для того, щоб відбувся перехід рідинної фази в газоподібну, до речовини в процесі 4-5 необхідно підвести тепло
Подальше підведення тепла до пари в процесі 5-6 приводить до її нагрівання. У цьому процесі в циліндрі знаходиться лише пара Якщо виконати відведення тепла від пари в зворотному процесі 6-5, то при її охолодженні до температури необхідно відвести тепло При відведенні тепла від рідини в процесі 4-3 та охолодженні її до температури Відведення тепла від твердого тіла в процесі 2-1 повертає тіло у вихідний стан. Із наведеного опису фазових переходів у чистій речовині випливає, що визначальними закономірностями цих явищ є такі: – при заданому тиску фазові переходи відбуваються при певній температурі, яка не змінюється впродовж цього переходу, тобто, фазові переходи – це ізобаро-ізотермічні процеси; – здійснення фазового переходу можливе при підведенні до речовини певної кількості тепла, або відведенні цього тепла від речовини при протилежному напряму переходу. Це тепло називається теплотою фазового переходу;
Для практики важливим є знання закономірностей, яким підпорядковуються фазові переходи в чистій речовині при зміні тиску, що діє на неї. Ці закономірності зручно встановити за допомогою фазової Припустимо, що до певної речовини, яка при температурі
На рис. 8.2 наведено якісний графік. Для конкретної речовини такі графіки будуються за експериментальними даними. Якщо подібні експерименти провести при різних тисках, то з’ясовується, що при зміні тиску вигляд графіка для всіх речовин міняється. Зокрема, переміна тиску супроводжується незначною зміною температури плавлення речовин. Для абсолютної їх більшості при зростанні тиску температура плавлення дещо збільшується. Подібні речовини називають нормальними. У той же час існують речовини, температура плавлення яких при зростанні тиску стає меншою. До таких аномальних речовин відноситься, зокрема, вода. Отже, в разі, коли тиск Загальною закономірністю для всіх речовин є суттєве зростання їхньої температури кипіння при збільшенні тиску. Через це точка кипіння Важливою закономірністю, якій підпорядковуються всі відомі речовини, є залежність від тиску різниці між їхніми температурами кипіння та плавлення – різниця Побудувавши розглянутий графік фазових переходів речовини для різних тисків і з’єднавши між собою точки плавлення, отримують криву, яка називається лінією плавлення. Вона являє собою залежність З’єднуючи між собою точки кипіння при різних тисках отримують криву, яка називається лінією кипіння або лінією насичення. Вона дає залежність На рис. 8.3, а наведена типова фазова
Лінія
Якщо до твердого тіла підводити тепло при тиску, меншому ніж Зворотний процес переходу речовини з газоподібного стану зразу в твердий називається десублімацією. Для процесів сублімації та десублімації характерне велике значення теплоти фазового переходу, що суттєво перевищує скриті теплоти плавлення та пароутворення. Температура сублімації для всіх речовин зростає при підвищенні тиску. Через це точка сублімації Точка Лінії фазових переходів на Лінія плавлення Маючи фазову діаграму можна легко визначити стан речовини. Для цього достатньо нанести на діаграму точку, координати якої відповідають відомим параметрам її стану. При аналізі фазових рівноваг і процесів фазових переходів важливу роль відіграє так зване правило фаз Гіббса. Воно встановлює залежність між кількістю незалежних перемінних, що визначають стан термодинамічної системи, яка знаходиться в рівновазі (ці незалежні перемінні часто називають ступенями свободи системи), кількістю фаз і кількістю компонентів системи. У разі коли складові системи хімічно не взаємодіють між собою, то кількість компонентів системи дорівнює кількості чистих речових, що входять до неї.
Правило фаз формулюється так:
де Стосовно до чистої речовини (однокомпонентна система,
Звідси випливає, що для чистих речовин у однофазній системі ( Розглянемо систему, що являє собою чисту речовину, але має не одну, а дві фази, що знаходяться в рівновазі. Такою система є при фазових переходах. У цьому разі Розглядаючи однокомпонентну трифазну систему (
Водяна пара
Серед розглянутих фазових переходів особливе місце в гірничих технологічних процесах займає перехід речовини з рідинного стану в газоподібний. Такі переходи відбуваються, зокрема, у різних частинах систем кондиціонування повітря, що використовуються на глибоких шахтах, вони спостерігаються також при вентиляції шахт. Через це більш докладно розглянемо закономірності цього фазового переходу і зробимо це на прикладі води. Як відмічалося, газоподібна фаза речовини, що співіснує з рідинною або твердою, називається парою. Тому процес перетворення речовини з рідкого стану в газоподібний називається пароутворенням. Якщо рідина частково заповнює резервуар, то з її вільної поверхні весь час при будь якій температурі відбувається процес переходу в газоподібний стан. Це пояснюється тим, що окремі молекули рідини, що хаотично рухаються з великими швидкостями, долають сили притягання сусідніх молекул і вилітають в оточуюче середовище. Процес пароутворення, що відбувається з вільної поверхні рідини, називається випаровуванням. Інтенсивність випаровування зростає при підвищенні температури рідини. У разі, коли рідина випаровується в необмежений простір, то вся вона може перетворитися на пару. Якщо ж випаровування відбувається в закритому резервуарі, то молекули, що вилітають із рідини, заповнюють вільний простір над нею. При цьому частина молекул, що рухаються над рідиною в цьому просторі, повертаються назад у рідину. Кількість молекул, що повертаються в рідину, буде зростати при збільшенні їх чисельності над поверхнею рідини. Через це кількість молекул, що вилітає з рідини, поступово стане рівною кількості молекул, що повертаються назад. У цей момент у вільному просторі над рідиною буде знаходитись максимально можлива кількість молекул речовини і пара над рідиною матиме найбільшу густину. Зважаючи на те, що швидкість хаотичного руху молекул визначається температурою речовини, можна зробити висновок, що максимальна кількість молекул у паровому просторі над рідиною буде залежати від її температури. Така пара, що контактує з рідиною та знаходиться з нею в термічній рівновазі, називається насиченою. По іншому відбувається процес пароутворення у випадку, коли над рідиною відсутній вільний простір і вона повністю заповнює резервуар. У цьому разі фазовий перехід проходить кілька стадій коли стан речовини поступово міняється. Особливості такого процесу проілюстровано на рис. 8.4. На рис. 8.5 наведено графічний аналіз фазового переходу в координатах
 Припустимо, що в циліндр, у яком може вільно переміщуватись поршень, налито 1 кг води при температурі 0° С, яка ще не замерзла. Через поршень на рідину передається тиск Припустимо, що в циліндр, у яком може вільно переміщуватись поршень, налито 1 кг води при температурі 0° С, яка ще не замерзла. Через поршень на рідину передається тиск  , де , де  – тиск у потрійній точці. Цей стан води відображається на рис. 8.5 точкою – тиск у потрійній точці. Цей стан води відображається на рис. 8.5 точкою  , яка знаходиться на перетині ізобари , яка знаходиться на перетині ізобари  та ізотерми потрійної точки та ізотерми потрійної точки  0° C. Початковий питомий об’єм речовини 0° C. Початковий питомий об’єм речовини  Через те, що вода – практично нестискувана речовина, її об’єм майже не міняється при зростанні тиску, як- Через те, що вода – практично нестискувана речовина, її об’єм майже не міняється при зростанні тиску, як-
Хай через стінку циліндра до води весь час підводиться тепло Подальше підведення тепла до рідини, нагрітої до температури кипіння, викликає початок в ній процесу пароутворення. При цьому пара буде утворюватись одразу в усьому об’ємі рідини у вигляді парових бульбашок. Саме цим відрізняється процес пароутворення в системі, що розглядається, від випаровування. Такий фазовий перехід називається кипінням рідини. Отже можна стверджувати, що кипіння – це процес випаровування рідини, що відбувається в усьому її об’ємі. Густина пари набагато менша від густини рідини тому парові бульбашки будуть підніматися до гори і створювати над водою паровий простір. Через те, що питомий об’єм пари значно перевищує питомий об’єм рідини, поява цього простору змусить поршень підніматися та приведе до зростання загального об’єму системи. Зважаючи на те, що маса речовини в циліндрі в процесі пароутворення не міняється, збільшення об’єму обумовить нарощування питомого об’єму речовини вздовж ізобари, при чому чим довшим буде процес кипіння, тим більший об’єм займатиме пара і меншим ставатиме об’єм рідини. Такий проміжний стан процесу показано на рис. 8.4, б. На рис. 8.5 цьому стану відповідає точка
|
|||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 789; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.185.28 (0.014 с.) |


 , де
, де  це тепло, що підводиться до речовини, а
це тепло, що підводиться до речовини, а  температура речовини.
температура речовини. , чим забезпечується сталість тиску, що діє на речовину. Через стінку циліндра до речовини зовні підводиться тепло
, чим забезпечується сталість тиску, що діє на речовину. Через стінку циліндра до речовини зовні підводиться тепло  . Початкова температура речовини
. Початкова температура речовини 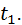
 Це буде спостерігатися до тих пір, поки температура тіла не зросте до рівня, при якому розпочнеться фазовий перехід речовини з твердого стану в рідинний. Цей фазовий перехід називається плавленням і розпочинається він після підвищення температури речовини до температури плавлення
Це буде спостерігатися до тих пір, поки температура тіла не зросте до рівня, при якому розпочнеться фазовий перехід речовини з твердого стану в рідинний. Цей фазовий перехід називається плавленням і розпочинається він після підвищення температури речовини до температури плавлення 
 . Після початку процесу плавлення подальше підведення тепла до речовини не буде викликати підвищення її температури (процес 2-3 на рис. 8.1). Тепло, що підводиться в цьому процесі, буде витрачатися на руйнування кристалічної гратки речовини. Незмінність температури речовини впродовж фазового переходу – це одна з головних властивостей цих переходів. Слід запам’ятати, що підведення тепла до речовини не завжди викликає зростання її температури – якщо речовина знаходиться в двофазному стані то її температура не буде змінюватися при підведенні до неї тепла.
. Після початку процесу плавлення подальше підведення тепла до речовини не буде викликати підвищення її температури (процес 2-3 на рис. 8.1). Тепло, що підводиться в цьому процесі, буде витрачатися на руйнування кристалічної гратки речовини. Незмінність температури речовини впродовж фазового переходу – це одна з головних властивостей цих переходів. Слід запам’ятати, що підведення тепла до речовини не завжди викликає зростання її температури – якщо речовина знаходиться в двофазному стані то її температура не буде змінюватися при підведенні до неї тепла. , яке називається скритою теплотою плавлення. Величина його залежить від роду речовини.
, яке називається скритою теплотою плавлення. Величина його залежить від роду речовини. У момент досягнення температури речовини певного значення, розпочнеться її фазовий перехід із рідинного стану в газоподібний. Цей фазовий перехід називається кипінням і відбувається він при температурі кипіння
У момент досягнення температури речовини певного значення, розпочнеться її фазовий перехід із рідинного стану в газоподібний. Цей фазовий перехід називається кипінням і відбувається він при температурі кипіння  . Газоподібна фаза речовини, яка співіснує з рідинною, називається парою. Через це кипіння називають також процесом пароутворення.
. Газоподібна фаза речовини, яка співіснує з рідинною, називається парою. Через це кипіння називають також процесом пароутворення. , тобто при кипінні стан речовини двофазний.
, тобто при кипінні стан речовини двофазний. , яке називається скритою теплотою пароутворення. Величина його визначається родом речовини.
, яке називається скритою теплотою пароутворення. Величина його визначається родом речовини. Чим вищою стане температура пари, тим ближчою за своїми властивостями вона буде до газу.
Чим вищою стане температура пари, тим ближчою за своїми властивостями вона буде до газу. , яке називається скритою теплотою конденсації. Експериментально встановлено, що
, яке називається скритою теплотою конденсації. Експериментально встановлено, що 
 розпочнеться перехід рідини в твердий стан. Цей фазовий перехід називається кристалізацією у випадку, коли речовина в твердому стані має кристалічну будову, або процесом затверднення, якщо в твердому стані речовина ізотропна. Для повного переходу рідини в твердий стан необхідно в процесі 3-2 від речовини відвести тепло
розпочнеться перехід рідини в твердий стан. Цей фазовий перехід називається кристалізацією у випадку, коли речовина в твердому стані має кристалічну будову, або процесом затверднення, якщо в твердому стані речовина ізотропна. Для повного переходу рідини в твердий стан необхідно в процесі 3-2 від речовини відвести тепло  , яке називається скритою теплотою кристалізації. Встановлено, що
, яке називається скритою теплотою кристалізації. Встановлено, що 
 – при фазових переходах співіснують, тобто знаходяться в рівновазі, дві фази речовини, отже стан речовини при фазовому переході двофазний.
– при фазових переходах співіснують, тобто знаходяться в рівновазі, дві фази речовини, отже стан речовини при фазовому переході двофазний. - діаграми, на осі ординат якої вказується тиск, що діє на речовину, а на осі абсцис – температура речовини. Порядок побудови цієї діаграми показано на рис. 8.2, де зображені процеси та фазові переходи, що відбуваються при зміні агрегатного стану речовини із твердого в рідинний, а потім в газоподібний.
- діаграми, на осі ординат якої вказується тиск, що діє на речовину, а на осі абсцис – температура речовини. Порядок побудови цієї діаграми показано на рис. 8.2, де зображені процеси та фазові переходи, що відбуваються при зміні агрегатного стану речовини із твердого в рідинний, а потім в газоподібний. і тиску
і тиску  на рис. 8.2), підводиться тепло при постій-ному тиску. Внаслідок цього речовина буде нагріватися, поки не розпочнеться її плавлення. Процес нагрівання на діаграмі відобразиться відрізком горизонтальної прямої і завершиться він у момент досягнення речовиною температури плавлення (т.
на рис. 8.2), підводиться тепло при постій-ному тиску. Внаслідок цього речовина буде нагріватися, поки не розпочнеться її плавлення. Процес нагрівання на діаграмі відобразиться відрізком горизонтальної прямої і завершиться він у момент досягнення речовиною температури плавлення (т.  на рис. 8.2), тобто при тиску
на рис. 8.2), тобто при тиску 
 У процесі плавлення температура речовини незмінна, тому цей процес на діаграмі відображатиметься точкою
У процесі плавлення температура речовини незмінна, тому цей процес на діаграмі відображатиметься точкою  , яка називається точкою плавлення. Після повного розплавлення подальше підведення тепла до речовини викликатиме її нагрівання. Процес нагрівання рідини відображається на діаграмі відрізком горизонтальної прямої і завершується він у момент досягнення речовиною температури кипіння (т.
, яка називається точкою плавлення. Після повного розплавлення подальше підведення тепла до речовини викликатиме її нагрівання. Процес нагрівання рідини відображається на діаграмі відрізком горизонтальної прямої і завершується він у момент досягнення речовиною температури кипіння (т.  на рис. 8.2), тобто при тиску
на рис. 8.2), тобто при тиску  Під час кипіння температура речовини не міняється тому цей процес на діаграмі відображається точкою
Під час кипіння температура речовини не міняється тому цей процес на діаграмі відображається точкою  , то процес перегріву пари відобразиться на діаграмі відрізком горизонтальної прямої
, то процес перегріву пари відобразиться на діаграмі відрізком горизонтальної прямої  .
. , точка плавлення
, точка плавлення  , то точка плавлення буде зміщуватись ліворуч для нормальних речовин, і праворуч – для аномальних.
, то точка плавлення буде зміщуватись ліворуч для нормальних речовин, і праворуч – для аномальних. для всіх речовин зростає при збільшенні тиску і стає меншою при його зниженні. Через це відстань на графіку між точками плавлення та кипіння при зниженні тиску буде зменшуватись і при певному тиску ці точки співпадуть.
для всіх речовин зростає при збільшенні тиску і стає меншою при його зниженні. Через це відстань на графіку між точками плавлення та кипіння при зниженні тиску буде зменшуватись і при певному тиску ці точки співпадуть. Ця залежність зазвичай близька до прямолінійної.
Ця залежність зазвичай близька до прямолінійної.

 на рис. 8.3 – це лінія плавлення; лінія
на рис. 8.3 – це лінія плавлення; лінія  – це лінія кипіння. При тиску
– це лінія кипіння. При тиску  відображається процес нагрівання речовини в твердому стані, а точкою
відображається процес нагрівання речовини в твердому стані, а точкою  – процес її сублімації, під час якого співіснують тверда та газоподібна фази речовини. Точка
– процес її сублімації, під час якого співіснують тверда та газоподібна фази речовини. Точка  . Відрізок
. Відрізок  відображає ізобарний процес нагрівання пари.
відображає ізобарний процес нагрівання пари. на рис. 8.3. Вона дає залежність
на рис. 8.3. Вона дає залежність  Природно, що лінія сублімації виходить із точки
Природно, що лінія сублімації виходить із точки  .
. , в якій сходяться лінії плавлення, кипіння та сублімації, називається потрійною точкою речовини. Параметри цієї точки є важливими константами речовини. Наприклад, для води параметри потрійної точки такі: тиск
, в якій сходяться лінії плавлення, кипіння та сублімації, називається потрійною точкою речовини. Параметри цієї точки є важливими константами речовини. Наприклад, для води параметри потрійної точки такі: тиск  4,579 мм рт. ст.
4,579 мм рт. ст.  611,2 Па; температура
611,2 Па; температура  0, 0076° С
0, 0076° С  0,01° С; питомий об’єм
0,01° С; питомий об’єм  0,001 м3/кг.
0,001 м3/кг. знаходиться область твердого стану речовини. Праворуч від лінії
знаходиться область твердого стану речовини. Праворуч від лінії  розташована область газоподібного стану. Лінії
розташована область газоподібного стану. Лінії  обмежують область існування рідинної фази. Точки, що лежать безпосередньо на лініях фазових переходів, характеризують рівноважний стан двох співіснуючих фаз. У потрійній точці в рівновазі одночасно співіснують три фази речовини.
обмежують область існування рідинної фази. Точки, що лежать безпосередньо на лініях фазових переходів, характеризують рівноважний стан двох співіснуючих фаз. У потрійній точці в рівновазі одночасно співіснують три фази речовини. , яка називається критичною точкою. Параметри цієї точки характеризують особливий стан речовини, коли зникає відмінність між рідинною та газоподібною фазами. Цей стан називається критичним.
, яка називається критичною точкою. Параметри цієї точки характеризують особливий стан речовини, коли зникає відмінність між рідинною та газоподібною фазами. Цей стан називається критичним. ,
, – кількість ступенів свободи термодинамічної системи;
– кількість ступенів свободи термодинамічної системи;  – кількість фаз у системі.
– кількість фаз у системі. ) правило фаз набуває такого виду:
) правило фаз набуває такого виду: .
. кількість ступенів свободи
кількість ступенів свободи  Такими незалежними перемінними можуть бути, наприклад, тиск і температура. Це означає, що якщо для такої системи довільно задати, наприклад, тиск і температуру, то всі інші параметри системи (питомий об’єм, ентальпія, ентропія та т. і.) будуть визначені однозначно. Отже, будь які три термодинамічні величини, що визначають стан даної речовини, являють собою групу перемінних, із якої дві перемінні незалежні, а третя є однозначною функцією цих двох перемінних.
Такими незалежними перемінними можуть бути, наприклад, тиск і температура. Це означає, що якщо для такої системи довільно задати, наприклад, тиск і температуру, то всі інші параметри системи (питомий об’єм, ентальпія, ентропія та т. і.) будуть визначені однозначно. Отже, будь які три термодинамічні величини, що визначають стан даної речовини, являють собою групу перемінних, із якої дві перемінні незалежні, а третя є однозначною функцією цих двох перемінних. і система має лише один ступінь свободи, тобто незалежною перемінною, яка повністю визначає рівноважний стан кожної фази системи, є один будь який параметр. Із цього випливає, що якщо відома, наприклад, температура фазового переходу, то вона однозначно визначає собою всі інші термодинамічні параметри кожної з фаз – тиск у точці переходу, питомий об’єм речовини в кожній із співіснуючих фаз, ентальпію, ентропію і т. ін.
і система має лише один ступінь свободи, тобто незалежною перемінною, яка повністю визначає рівноважний стан кожної фази системи, є один будь який параметр. Із цього випливає, що якщо відома, наприклад, температура фазового переходу, то вона однозначно визначає собою всі інші термодинамічні параметри кожної з фаз – тиск у точці переходу, питомий об’єм речовини в кожній із співіснуючих фаз, ентальпію, ентропію і т. ін. , отримуємо, що кількість ступенів свободи такої системи дорівнює нулю. Відсутність у цьому випадку ступенів свободи означає, що в однокомпонентній системі три фази можуть знаходитись у рівновазі лише при цілком визначених температурі та тиску, характерних для даної конкретної речовини. Подібне співіснування фаз має місце в потрійній точці речовини. Деякі речовини в твердому стані можуть мати не одну, а декілька фаз, зокрема для води відомі шість різновидів льоду. У цьому разі в речовині є декілька потрійних точок і ту з них, у якій речовина співіснує в трьох агрегатних станах, називають головною.
, отримуємо, що кількість ступенів свободи такої системи дорівнює нулю. Відсутність у цьому випадку ступенів свободи означає, що в однокомпонентній системі три фази можуть знаходитись у рівновазі лише при цілком визначених температурі та тиску, характерних для даної конкретної речовини. Подібне співіснування фаз має місце в потрійній точці речовини. Деякі речовини в твердому стані можуть мати не одну, а декілька фаз, зокрема для води відомі шість різновидів льоду. У цьому разі в речовині є декілька потрійних точок і ту з них, у якій речовина співіснує в трьох агрегатних станах, називають головною. (тиск – питомий об’єм речовини).
(тиск – питомий об’єм речовини). що температура рідини залишається сталою. Це означає, що залежності об’єму рідини від тиску при
що температура рідини залишається сталою. Це означає, що залежності об’єму рідини від тиску при  або, іншими словами, ізотерми речовини в області існування рідинної фази, в координатах
або, іншими словами, ізотерми речовини в області існування рідинної фази, в координатах  від зовнішнього джерела. При нагріванні об’єм води спочатку буде зменшуватися. Це відрізняє воду від абсолютної більшості речовин, об’єми яких зростають при підвищенні їхньої температури. Найменший об’єм вода займатиме при температурі 3,98° С і подальше нагрівання викликатиме її розширення. Найбільшого об’єму вода досягає при температурі кипіння. На рис. 8.4, а зображено стан системи в той момент, коли рідина вже нагріта до температури кипіння при заданому тиску, однак процес пароутворення ще не розпочався. Цьому стану на рис. 8.5 відповідає точка
від зовнішнього джерела. При нагріванні об’єм води спочатку буде зменшуватися. Це відрізняє воду від абсолютної більшості речовин, об’єми яких зростають при підвищенні їхньої температури. Найменший об’єм вода займатиме при температурі 3,98° С і подальше нагрівання викликатиме її розширення. Найбільшого об’єму вода досягає при температурі кипіння. На рис. 8.4, а зображено стан системи в той момент, коли рідина вже нагріта до температури кипіння при заданому тиску, однак процес пароутворення ще не розпочався. Цьому стану на рис. 8.5 відповідає точка  і питомий об’єм такої води
і питомий об’єм такої води  . Процес нагрівання води від 0° С до температури кипіння при тиску
. Процес нагрівання води від 0° С до температури кипіння при тиску  .
.



