
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні властивості газових сумішейСодержание книги
Поиск на нашем сайте
Окремі гази, що входять до складу суміші, називаються її компонентами. Кожен газ у суміші розподіляється по всьому об’єму, який займає суміш, повністю зберігає всі свої властивості та поводиться так, ніби він один займає весь об’єм суміші. Гази, що входять до складу атмосферного повітря в гірничих виробках, за своїми властивостями близькі до ідеальних газів, тому будемо вважати, що кожен компонент суміші є ідеальним газом, тобто для кожного окремого газу з цієї суміші справедливе рівняння стану Клайперона. Суміш ідеальних газів підпорядковується закону Дальтона, у якому стверджується, що загальний тиск суміші газів дорівнює сумі парціальних тисків її компонентів:
де Парціальний тиск компонента – це тиск, який би мав кожен газ, що входить до складу суміші, якби він один займав увесь об’єм суміші при температурі суміші. Рівняння стану для кожного компонента суміші через його парціальний тиск таке:
де
Способи визначення складу газової суміш Суміш газів характеризують масовим або об’ємним складом. Масовий склад суміші визначається масовими частками компонентів. Масовою часткою компонента називається відношення маси окремого компонента
Зважаючи на те, що
Об’ємний склад суміші визначається об’ємними частками компонентів. Об’ємна частка компонента – це відношення парціального (приведеного) об’єму компонента
Парціальним або приведеним називається об’єм, який займав би компонент газової суміші, якби його тиск і температура дорівнювали тиску та температурі суміші. Рівняння стану для кожного компонента суміші через його парціальний об’єм таке:
Порівнюючи рівняння (2.2) і (2.5) отримуємо
Звідси
Складаючи за рівнянням (2.7) парціальні об’єми всіх компонентів суміші та враховуючи співвідношення (2.1), отримуємо
Із рівняння (2.7) маємо
Існує принципова можливість визначати склад газової суміші мольними частками компонентів, але таке представлення суміші рівнозначне визначенню її об’ємними частками. Описуючи склад газової суміші, користуються також масовими та об’ємними процентами компонентів – це відповідні частки компонентів, помножені на 100%.
Газова стала суміші газів Якщо кожен компонент суміші є ідеальним газом, то і суміш у цілому можна розглядати як ідеальний газ, тобто для неї буде справедливим рівняння стану:
де Для знаходження газової сталої суміші визначимо за рівняння (2.2) парціальні тиски кожного компонента суміші:
Складаючи парціальні тиски компонентів, отримуємо:
З іншого боку за рівнянням (2.9)
тобто
Звідси
Якщо суміш задана об’ємними частками, то
Уявна молекулярна маса суміші Формально розглядаючи газову суміш як ідеальний газ, визначимо його молекулярну масу, тобто знайдемо уявну молекулярну масу суміші, яка являє собою молекулярну масу такого уявного газу, властивості якого співпадають із властивостями суміші. Згідно зі співвідношенням (1.8)
Беручи до уваги рівняння (2.10), отримуємо
Але газова стала кожного компонента де Тоді з (2.11) маємо
Для суміші, що задана об’ємними частками,
Співвідношення між масовими та об’ємними частками компонентів Розділимо рівняння стану для компонента суміші (2.2) на рівняння стану для суміші в цілому (2.9):
Згідно з (2.8)
З урахуванням (2.10)
З урахуванням співвідношення (1.8)
Якщо суміш задана об’ємними частками, то
Парціальний тиск компонентів суміші З рівняння стану для компонента суміші (2.2) парціальний тиск
Але з рівняння стану суміші
Тоді
Якщо суміш задана об’ємними частками, то з рівняння (2.6)
ПРШИЙ ЗАКОН ТЕРМОДИНАМІКИ Способи передачі енергії У термодинамічному процесі передача енергії від одного тіла до іншого може відбуватися двома способами. Перший спосіб передачі енергії реалізується при безпосередньому контакті тіл, що мають різну температуру, шляхом обміну кінетичною енергією між молекулами контактуючих тіл. При цьому енергія передається від більш нагрітого тіла до менш нагрітого, тобто від тіла, у якого середня кінетична енергія молекул більша, до тіла, середня кінетична енергія молекул якого менша. Такий спосіб передачі енергії називається передачею енергії у формі теплоти. Кількість енергії, що передається у вигляді теплоти від одного тіла до іншого, називають кількістю теплоти. При цьому кількість енергії, що отримує тіло у формі теплоти, називають підведеною теплотою, а кількість енергії, що віддається тілом у формі теплоти, – відведеною теплотою. Теплота, як і будь яка інша енергія, вимірюється в джоулях. Довільну кількість теплоти будемо позначати через Другий спосіб передачі енергії пов’язаний із наявністю зовнішнього силового впливу на тіло. Для передачі енергії у цей спосіб тіло повинне або переміщуватись у силовому полі, або змінювати свій об’єм під дією зовнішнього тиску. Іншими словами, передача енергії в цьому випадку відбувається за умови переміщення всього тіла або його частини в просторі. Цей спосіб передачі енергії називається передачею енергії у формі роботи, а кількість енергії, переданої в процесі, – роботою. Кількість енергії, отриманої тілом у формі роботи, називають роботою, що здійснена над тілом, а кількість енергії, відданою тілом у формі роботи, називають роботою, що виконана (витрачена) тілом. Виконана тілом робота вважається додатною, а робота, що здійснена над тілом, – від’ємною. Робота теж вимірюється в джоулях. Довільну кількість енергії, переданої в процесі у формі роботи, будемо позначати через У загальному випадку передача енергії у формі теплоти і у формі роботи може відбуватися одночасно. Отже, теплота і робота характеризують якісно та кількісно дві різні форми передачі енергії від одного тіла до іншого. Робота являє собою макрофізичну форму передачі енергії, а теплота є сукупністю мікрофізичних процесів, що відбуваються на молекулярному рівні без видимого руху тіл. Важливим є розуміння того, що поняття «теплота» і «робота» виникають лише в зв’язку з термодинамічним процесом. Якщо немає процесу, то нема ні теплоти, ні роботи. Тому неможна вести мову про запас теплоти або роботи в будь-якому тілі.
Внутрішня енергія Будь-яке тіло в конкретних умовах володіє певним запасом так званої внутрішньої енергії, яка являє собою всю енергію, що міститься в тілі або в системі тіл, що входять до термодинамічної системи. Внутрішню енергію будемо позначати У термодинамічних процесах три останні види енергії не змінюються. У той же час саме зміна внутрішньої енергії характеризує ці процеси. Тому в термодинаміці під внутрішньою енергією тіла розуміють лише суму кінетичної та потенціальної енергій його частинок, тобто
Внутрішня кінетична енергія складається з таких частин:
де Кінетична енергія хаотичного теплового руху молекул залежить від абсолютної температуру та від кількості атомів у молекулі:
Потенціальна енергія міжмолекулярної взаємодії залежить від середньої відстані між молекулами, тобто від питомого об’єму
Отже, в загальному випадку повна внутрішня енергія
тобто вона є функцією двох параметрів стану, а, отже, і сама вона – параметр стану або функція стану. Для ідеального газу Внутрішня енергія – це екстенсивний параметр стану. Вона вимірюється в джоулях. Питома внутрішня енергія, тобто внутрішня енергія, що віднесена до одиниці маси, набуває властивостей інтенсивного параметра стану і вимірюється в Дж/кг. Її будемо позначати
Зміна внутрішньої енергії в термодинамічному процесі, як і зміна інших параметрів стану, не залежить від виду процесу, а визначається лише її величиною в початковому та кінцевому станах процесу, тобто при будь-якому переході термодинамічної системи із стану 1 у стан 2 зміна внутрішньої енергії
Через те, що термодинамічні процеси характеризуються зміною внутрішньої енергії, а не абсолютним її значенням, при розрахунках треба визначати саме цю зміну. а не абсолютне значення внутрішньої енергії. Це дозволяє вести відлік внутрішньої енергії від будь-якого прийнятого рівня. Зокрема, для ідеального газу приймають внутрішню енергію рівною нулю при температурі
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 1523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.159.223 (0.008 с.) |


 – загальний тиск суміші;
– загальний тиск суміші;  – парціальний тиск
– парціальний тиск  -того компонента суміші.
-того компонента суміші. (2.2)
(2.2)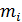 та
та  – маса компонента суміші та його газова стала;
– маса компонента суміші та його газова стала;  та
та  – об’єм і температура суміші.
– об’єм і температура суміші. :
: . (2.3)
. (2.3)
 до загального об’єму суміші
до загального об’єму суміші 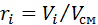 . (2.4)
. (2.4) (2.5)
(2.5)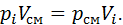 (2.6)
(2.6)

 . (2.8)
. (2.8)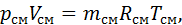 (2.9)
(2.9) – газова стала суміші.
– газова стала суміші.

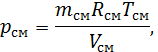





 . Звідси
. Звідси

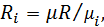
 – молекулярна маса компонента.
– молекулярна маса компонента.


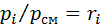 , а відповідно до (2.3)
, а відповідно до (2.3)  Отже
Отже







 , а питому, тобто теплоту, віднесену до 1 кг тіла, – через
, а питому, тобто теплоту, віднесену до 1 кг тіла, – через 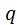 . Одиниця виміру питомої теплоти – Дж/кг. Підведену теплоту вважають додатною, відведену – від’ємною.
. Одиниця виміру питомої теплоти – Дж/кг. Підведену теплоту вважають додатною, відведену – від’ємною. , а питому, тобто роботу, віднесену до 1 кг тіла, – через
, а питому, тобто роботу, віднесену до 1 кг тіла, – через 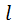 . Одиниця виміру питомої роботи – Дж/кг.
. Одиниця виміру питомої роботи – Дж/кг.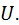 Вона складається з кінетичної енергії хаотичного теплового руху молекул тіла та потенціальної енергії їхньої взаємодії, енергії внутрішньомолекулярних коливань, потенціальної енергії зчеплення між молекулами, енергії електронних оболонок атомів, внутрішньоядерної енергії.
Вона складається з кінетичної енергії хаотичного теплового руху молекул тіла та потенціальної енергії їхньої взаємодії, енергії внутрішньомолекулярних коливань, потенціальної енергії зчеплення між молекулами, енергії електронних оболонок атомів, внутрішньоядерної енергії.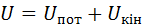 .
.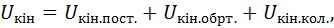
 – кінетична енергія поступального, обертального та коливального руху молекул і атомів, відповідно.
– кінетична енергія поступального, обертального та коливального руху молекул і атомів, відповідно.
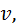 та від маси молекули
та від маси молекули  :
:
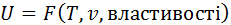 ,
,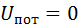 і з цього випливає, що для ідеального газу внутрішня енергія є однозначною функцією температури.
і з цього випливає, що для ідеального газу внутрішня енергія є однозначною функцією температури.






