
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні поняття термодинамікиСодержание книги
Поиск на нашем сайте
ВСТУП Термодинаміка – це наука про закономірності перетворення різних видів енергії одна в одну, що відбуваються в макроскопічних системах. Макросистеми складаються з тіл, що безпосередньо нас оточують. Ці тіла утворюються величезною кількістю мікроструктурних частинок (молекул, атомів, іонів), які безперервно рухаються та взаємодіють між собою. Існує два методи вивчення фізичних властивостей таких систем. При загальній кількості мікроструктурних частинок 1020…1025 неможливо встановити властивості системи через поведінку окремої частинки. Тут стає в нагоді статистичний метод, оснований на використанні теорії ймовірностей і певних моделей будови систем. Цей метод покладений в основу статистичної фізики. У той же час значна кількість властивостей макросистем, важливих для практики, може бути описаною без урахування її мікроструктури, а розглядаючи систему як єдине ціле, тобто як феномен. Такий феноменологічний метод аналізу лежить в основі термодинаміки. При цьому зв’язок між макроскопічними параметрами, що визначають поведінку системи, встановлюється двома основними законами, сформульованими на основі величезної кількості експериментальних даних, – першим і другим законами термодинаміки. Перший закон термодинаміки дає кількісну характеристику процесів перетворення енергії і являє собою кількісний вираз закону збереження та перетворення енергії, який має загальний характер. Другий закон термодинаміки встановлює якісний бік (спрямованість) процесів, що відбуваються в фізичних системах. Ні перший, ні другий закони не спираються на будь-які уявлення про будову речовини, що обумовлює велику поширеність методів термодинаміки – вони можуть використовуватися для всіх систем, для яких справедливі закони, що лежать у її основі. Ця наука розглядає різноманітні явища природи та охоплює величезну область хімічних, механічних і фізико-хімічних явищ. Термодинаміку поділяють на три частини: загальну або фізичну термодинаміку, яка вивчає процеси енергоперетворювань у твердих, рідких і газоподібних тілах; хімічну термодинаміку, в якій на основі законів загальної термодинаміки встановлюються закономірності теплових ефектів при хімічних перетвореннях; технічну термодинаміку, в якій встановлюються закономірності взаємного перетворення теплоти і роботи на основі вивчення процесів, що відбуваються в газах і парі, та вивчення властивостей цих середовищ. Для напряму підготовки 6.050301 Гірництво «Термодинаміка» – це нормативна дисципліна, що забезпечує вивчення ряду спеціальних дисциплін: «Рудникова аерологія», «Провітрювання шахт», «Установки для кондиціонування повітря», «Технологічне обладнання для транспортування та акумулювання газу», «Стаціонарні машини». З огляду на це визначені розділи термодинаміки, що викладаються в цьому курсі та які знайшли своє відображення в цьому виданні.
ОСНОВНІ ПОНЯТТЯ ТЕРМОДИНАМІКИ Термодинамічна система Об’єктом вивчення в термодинаміці є термодинамічна система. Під нею розуміють сукупність матеріальних тіл, що виділені з навколишнього світу за певною ознакою, і які обмінюються між собою енергією. Усе, що лежить за межами термодинамічної системи, називається її зовнішнім середовищем. Склад термодинамічної системи встановлюється довільно і визначається умовою завдання, що вирішується. Від зовнішнього середовища система може відокремлюватися поверхнею, що фізично існує, або є уявною. Прикладом першої системи може бути газ, що заповнює балон, другої – умовно виділений стовп атмосферного повітря. У загальному випадку частини термодинамічної системи взаємодіють не лише між собою, а й із зовнішнім середовищем. Якщо термодинамічна система обмінюється із зовнішнім середовищем як енергією, так і речовиною, то вона називається відкритою. Якщо їхня взаємодія обмежується лише енергообміном, а речовина не виходить за межі системи, то таку систему називають закритою. Термодинамічна система, яка не може обмінюватися із зовнішнім середовищем теплом, називають теплоізольованою або адіабатною. Якщо між термодинамічною системою та зовнішнім середовищем не існує ніякої взаємодії, то таку систему називають ізольованою або замкнутою. Про інші різновиди термодинамічних систем мова буде йти далі.
Термодинамічний стан Термодинамічні параметри однозначно характеризують термодинамічну систему лише в її рівноважному стані – такому, коли в усіх точках системи однакові всі інтенсивні параметри і коли вони незмінні в часі. Якщо в окремих точках системи різні температури, тиски або питомі об’єми, то такий її стан називається нерівноважним. Для такого стану часто неможливо визначити термодинамічні параметри системи. Наприклад, при швидкому стисканні або розширенні газу в циліндрі в ньому розповсюджуються хвилі стискання та розширення, через що в різних частинах циліндра тиск і температура будуть різними, тобто в цих процесах тиск і температура не являються параметром стану для всієї системи. При відсутності рівноваги в термодинамічній системі в ній під дією перепадів між значеннями параметрів стану виникають макроскопічні перетоки речовини та енергії, які поступово переводять систему до рівноважного стану. Тривалість цього переходу залежить від властивостей системи. Досвід показує, що ізольована термодинамічна система з плином часу завжди переходить до стану рівноваги і самостійно вийти з цього стану не може. У класичній термодинаміці розглядаються лише рівноважні системи.
Рівняння стану Досвід показує, що основні термодинамічні параметри стану будь-якої термодинамічної системи залежать один від одного. Для рівноважного стану найпростіших систем ця взаємозалежність описується рівнянням виду
яке в термодинаміці називається термічним рівнянням стану. Рівнянню стану можна надати іншого вигляду:
Ці рівняння вказують на те, що з трьох основних параметрів стану, які визначають стан простих термодинамічних систем, незалежними є будь-які два. Для вирішення завдань методами термодинаміки необхідно знати вид функціональної залежності між параметрами стану. Ця залежність різна для різних речовин і вона не може бути встановленою методами самої термодинаміки – рівняння стану можуть бути визначеними експериментально або методами статистичної фізики. Найпростіше їх встановити для ідеального газу. Сумісно вирішуючи рівняння (1) і (2), отримуємо
Розглядаючи 1 кг газу, приймаємо, що він містить у собі
і
Позначимо сталу величину, що віднесена до 1 кг газу,
Її називають газовою сталою. З урахуванням цього
Отримане співвідношення являє собою термічне рівняння стану ідеального газу та називається рівнянням Клайперона за прізвищем французького фізика, який першим його вивів у 1834 році. Газова стала Помноживши рівняння (1.3) на
де Рівнянню Клайперона можна надати універсальну форму, якщо газову сталу віднести не до 1 кг газу, а до одного його кіломоля, тобто до такої кількості газу, маса якого в кілограмах чисельно дорівнює його молекулярній масі Запишемо рівняння (1.4) для одного кіломоля газу. У цьому разі
Звідси
Із закону Авогадро, який стверджує, що рівні об’єми різних ідеальних газів при однакових тисках і температурах мають однакову кількість молекул, випливає, що за певних умов об’єм одного кіломоля різних ідеальних газів однаковий. Слід запам’ятати, що порівнювати між собою об’єми різних газів можна за умови, якщо ці об’єми виміряні при однакових тисках і температурах. У термодинаміці об’єми газів зводять, зазвичай, до так званих нормальних фізичних умов, параметри яких такі:
За цих умов
Добуток Уводячи до рівняння стану (1.5) значення
Рівняння (1.7) називають рівнянням Клайперона – Менделєєва, зважаючи на те, що його вперше запропонував Д.І. Менделєєв у 1874 р. Знаючи універсальну газову сталу, можна підрахувати газову сталу будь якого ідеального газу за формулою:
Наведені рівняння стану справедливі лише для ідеальних газів. Але вони дають достатню точність і при розрахунках реальних газів у великій кількості практичних завдань. Реальні гази тим ближчі за своїми властивостями до ідеальних, чим вища їхня температура та менший тиск. Якщо стан газу близький до його зрідження, то ці рівняння використовувати неможна – у цьому разі розрахунки виконують за допомогою спеціальних параметричних таблиць і діаграм.
Термодинамічний процес
Якщо хоча б один із параметрів стану термодинамічної системи змінюється в часі, то в системі відбувається термодинамічний процес, що являє собою неперервну послідовність нових станів системи, що змінюються. Усі процеси, що відбуваються в термодинамічних системах, поділяються на рівноважні та нерівноважні. Рівноважними називаються процеси, у яких усі проміжні стани, через які проходить система, є рівноважними. У разі невиконання цієї умови процеси називаються нерівноважними.

 . Але використовувати для розрахунків просторову систему координат незручно, тому на практиці, зазвичай, користуються площинними координатними системами . Але використовувати для розрахунків просторову систему координат незручно, тому на практиці, зазвичай, користуються площинними координатними системами 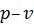 , ,  або або  . У цьому разі координати точок на площині будуть відповідати значенням двох параметрів стану, а величина третього параметру може бути знайденою за рівнянням стану. Найбільше поширення має координатна система . У цьому разі координати точок на площині будуть відповідати значенням двох параметрів стану, а величина третього параметру може бути знайденою за рівнянням стану. Найбільше поширення має координатна система 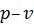 , у якій на осі абсцис відкладають питомий об’єм , у якій на осі абсцис відкладають питомий об’єм  , а на осі ординат – абсолютний тиск , а на осі ординат – абсолютний тиск  . .
 і питомим об’ємом і питомим об’ємом  . .
 і питомий об’єм і питомий об’єм  . Лінія 1-2, що відображає цей перехід, називається кривою процесу. Кожна точка цієї кривої характеризує рівноважний стан системи. Лише рівноважні термодинамічні процеси можуть бути зображені графічно. . Лінія 1-2, що відображає цей перехід, називається кривою процесу. Кожна точка цієї кривої характеризує рівноважний стан системи. Лише рівноважні термодинамічні процеси можуть бути зображені графічно.
Рівноважні процеси є процесами оборотними. Це означає, що при проходженні процесу в зворотному напрямку система пройде в зворотному порядку через усі стани, у яких вона перебувала в прямому процесі, і повернеться до початкового стану, не викликаючи ніяких змін його параметрів і змін у навколишньому середовищі. Прикладом оборотних процесів є процеси 1-2 і 2-1, що відмічені на рис. 4 стрілками. Нерівноважні процеси являють собою необоротні процеси. При проведенні таких процесів у прямому та зворотному напрямках або система, або зовнішнє середовище не повертаються до початкового стану. Якщо кінцевим станом системи є стан 2 з певними параметрами, то з цього випливає, що зміна параметрів у процесі переходу системи із стану 1 до стану 2, зокрема, зміна тиску або зміна питомого об’єму в процесі, становить, відповідно,
і вона не залежить від виду процесу – ця зміна буде однаковою як у процесі 1-2, так і в процесі 1- а -2, зображених на рис. 4. Незалежність зміни параметрів стану в термодинамічному процесі від виду процесу або, іншими словами, від шляху переходу з початкового до кінцевого стану, є головною ознакою параметрів стану – ця зміна визначається лише початковим і кінцевим станами системи. Це дає підставу стверджувати, що параметри стану, значення яких залежать лише від початкового та кінцевого станів системи, являються функціями стану.
СУМІШІ ІДЕАЛЬНИХ ГАЗІВ Газовою сумішшю називають механічну суміш окремих газів, які не вступають між собою ні в які хімічні реакції. Такою сумішшю є, зокрема, атмосферне повітря, яке складається з кисню, азоту, вуглекислого газу, водяної пари, інертних газів. У підземних виробках склад повітря змінюється через те, що з гірничих порід виділяються такі гази, як метан, вуглекислий газ, сірководень та інші. При певній концентрації цих домішок повітря в гірничих виробках може стати вибухонебезпечним або отруйним. Тому важливим завданням для гірничого інженера є вміння підтримувати безпечний склад рудникового повітря, а для цього він повинен мати чітку уяву про властивості газових сумішей.
Газова стала суміші газів Якщо кожен компонент суміші є ідеальним газом, то і суміш у цілому можна розглядати як ідеальний газ, тобто для неї буде справедливим рівняння стану:
де Для знаходження газової сталої суміші визначимо за рівняння (2.2) парціальні тиски кожного компонента суміші:
Складаючи парціальні тиски компонентів, отримуємо:
З іншого боку за рівнянням (2.9)
тобто
Звідси
Якщо суміш задана об’ємними частками, то
ПРШИЙ ЗАКОН ТЕРМОДИНАМІКИ Способи передачі енергії У термодинамічному процесі передача енергії від одного тіла до іншого може відбуватися двома способами. Перший спосіб передачі енергії реалізується при безпосередньому контакті тіл, що мають різну температуру, шляхом обміну кінетичною енергією між молекулами контактуючих тіл. При цьому енергія передається від більш нагрітого тіла до менш нагрітого, тобто від тіла, у якого середня кінетична енергія молекул більша, до тіла, середня кінетична енергія молекул якого менша. Такий спосіб передачі енергії називається передачею енергії у формі теплоти. Кількість енергії, що передається у вигляді теплоти від одного тіла до іншого, називають кількістю теплоти. При цьому кількість енергії, що отримує тіло у формі теплоти, називають підведеною теплотою, а кількість енергії, що віддається тілом у формі теплоти, – відведеною теплотою. Теплота, як і будь яка інша енергія, вимірюється в джоулях. Довільну кількість теплоти будемо позначати через Другий спосіб передачі енергії пов’язаний із наявністю зовнішнього силового впливу на тіло. Для передачі енергії у цей спосіб тіло повинне або переміщуватись у силовому полі, або змінювати свій об’єм під дією зовнішнього тиску. Іншими словами, передача енергії в цьому випадку відбувається за умови переміщення всього тіла або його частини в просторі. Цей спосіб передачі енергії називається передачею енергії у формі роботи, а кількість енергії, переданої в процесі, – роботою. Кількість енергії, отриманої тілом у формі роботи, називають роботою, що здійснена над тілом, а кількість енергії, відданою тілом у формі роботи, називають роботою, що виконана (витрачена) тілом. Виконана тілом робота вважається додатною, а робота, що здійснена над тілом, – від’ємною. Робота теж вимірюється в джоулях. Довільну кількість енергії, переданої в процесі у формі роботи, будемо позначати через У загальному випадку передача енергії у формі теплоти і у формі роботи може відбуватися одночасно. Отже, теплота і робота характеризують якісно та кількісно дві різні форми передачі енергії від одного тіла до іншого. Робота являє собою макрофізичну форму передачі енергії, а теплота є сукупністю мікрофізичних процесів, що відбуваються на молекулярному рівні без видимого руху тіл. Важливим є розуміння того, що поняття «теплота» і «робота» виникають лише в зв’язку з термодинамічним процесом. Якщо немає процесу, то нема ні теплоти, ні роботи. Тому неможна вести мову про запас теплоти або роботи в будь-якому тілі.
Внутрішня енергія Будь-яке тіло в конкретних умовах володіє певним запасом так званої внутрішньої енергії, яка являє собою всю енергію, що міститься в тілі або в системі тіл, що входять до термодинамічної системи. Внутрішню енергію будемо позначати У термодинамічних процесах три останні види енергії не змінюються. У той же час саме зміна внутрішньої енергії характеризує ці процеси. Тому в термодинаміці під внутрішньою енергією тіла розуміють лише суму кінетичної та потенціальної енергій його частинок, тобто
Внутрішня кінетична енергія складається з таких частин:
де Кінетична енергія хаотичного теплового руху молекул залежить від абсолютної температуру та від кількості атомів у молекулі:
Потенціальна енергія міжмолекулярної взаємодії залежить від середньої відстані між молекулами, тобто від питомого об’єму
Отже, в загальному випадку повна внутрішня енергія
тобто вона є функцією двох параметрів стану, а, отже, і сама вона – параметр стану або функція стану. Для ідеального газу Внутрішня енергія – це екстенсивний параметр стану. Вона вимірюється в джоулях. Питома внутрішня енергія, тобто внутрішня енергія, що віднесена до одиниці маси, набуває властивостей інтенсивного параметра стану і вимірюється в Дж/кг. Її будемо позначати
Зміна внутрішньої енергії в термодинамічному процесі, як і зміна інших параметрів стану, не залежить від виду процесу, а визначається лише її величиною в початковому та кінцевому станах процесу, тобто при будь-якому переході термодинамічної системи із стану 1 у стан 2 зміна внутрішньої енергії
Через те, що термодинамічні процеси характеризуються зміною внутрішньої енергії, а не абсолютним її значенням, при розрахунках треба визначати саме цю зміну. а не абсолютне значення внутрішньої енергії. Це дозволяє вести відлік внутрішньої енергії від будь-якого прийнятого рівня. Зокрема, для ідеального газу приймають внутрішню енергію рівною нулю при температурі
Закону термодинаміки Перший закон термодинаміки являє собою окремий випадок загального закону збереження та перетворення енергії стосовно до теплових явищ, що відбуваються в термодинамічних системах. Закон збереження та перетворення енергії є фундаментальним законом природи, який встановлено на основі узагальнення величезної кількості експериментальних даних. Він стверджує, що енергія не зникає і не виникає заново, вона лише переходить із однієї форми в іншу, причому зменшення енергії одного виду супроводжується еквівалентним зростанням енергії іншого виду. Цей закон застосовний до всіх явищ природи. Стосовно до термодинамічних процесів із цього закону випливає, що зміна енергії тіл, що беруть участь у процесі, дорівнює підведеній або відведеній від системи енергії.
Розглянемо довільний об’єм газу Г, що рухається. Хай у певний момент часу його швидкість
де
де
де
Якщо під впливом певних чинників швидкість газу змінилася до
тобто вона змінилася на
Але зміна енергії тіла дорівнює енергії, що підведена або відведена від нього. Пам’ятаючи, що енергія може передаватися у формі тепла
Як відмічалося в п. 3.1., у термодинаміці прийняте таке правило знаків при енергообміних процесах: – підведене тепло вважають додатним, відведене – від’ємним; – підведену роботу, тобто роботу, що виконана над тілом, вважають від’ємною, відведену, тобто роботу, що виконана тілом, вважають додатною. Використовуючи це правило знаків, із (3.3) отримуємо:
Для нерухомого газу це рівняння записується простіше:
Рівняння (3.4) і (3.5) є математичним виразом першого закону термодинаміки. Для нерухомого газу цей закон формулюється так: тепло, що підведене до газу, витрачається на зміну його внутрішньої енергії та на виконання газом зовнішньої роботи. Рівняння (3.5), записане для питомих величин, набуває такого вигляду:
а в диференціальній формі воно записується так:
Отримане рівняння першого закону термодинаміки вірне для будь-яких газів, зокрема, для ідеальних. Воно описує як оборотні, так і необоротні процеси. Усі величини, що входять до рівняння (3.5), можуть бути як додатними, так і від’ємними, а також можуть приймати нульові значення.
ТЕПЛОЄМНІСТЬ ГАЗІВ Теплоємністю називається кількість тепла, яке необхідно підвести до будь-якого тіла, щоб підвищити його температуру на один градус. На практиці зазвичай користуються питомими теплоємностями, які дорівнюють кількості тепла, необхідного для підвищення на один градус одиниці кількості речовини. Залежно від прийнятої одиниці кількості речовини теплоємність поділяють на масову, об’ємну та мольну. Теплоємність, що віднесена до 1 кг газу, називають масовою та позначають Теплоємність, що віднесена до 1 м3 газу при нормальних фізичних умовах (до 1нм3), називають об’ємною та позначають Теплоємність, що віднесена до 1 кіломоля газу, називають мольною та позначають Між названими теплоємностями існує такий зв’язок:
Зміна температури тіла при одній і тій же кількості підведеної теплоти залежить від характеру процесу, який при цьому відбувається, тому теплоємність є функцією процесу. Це означає, що одне й те саме робоче тіло для підвищення своєї температури на один градус потребує різної кількості тепла залежно від виду процесу, у якому це тепло підводиться. Ця обставина вимагає вище названі теплоємності додатково розділяти за видом процесів. Особливе значення в термодинаміці мають теплоємність при сталому об’ємі та теплоємність при сталому тиску. Перша називається ізохорною теплоємністю та позначається індексом
Теплоємність реальних газів Теплоємність реальних газів залежить у загальному випадку від тиску та температури, тобто
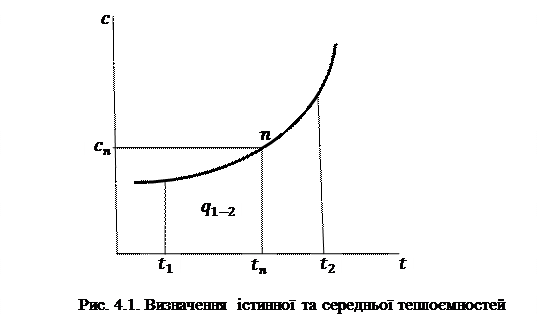
Для газів, стан яких далекий від області насичення, залежність теплоємності від тиску проявляється слабо і на практиці нею часто нехтують. У той же час залежність теплоємності від температури є доволі суттєвою і при точних розрахунках повинна враховуватись. Аналітичний вираз цієї залежності складний і вимагає експериментального визначення ряду констант для кожного газу. Тому теплоємності реальних газів визначають експериментально. Цими експериментами встановлено, що залежність теплоємності реального газу від температури криволінійна (рис. 4.1). Через це існують поняття про істинну та середню теплоємності.
Під істинною теплоємністю
Для реальних газів кожному значенню температури процесу відповідає конкретне значення теплоємності. Визначення теплоти процесу за допомогою істинної теплоємності виконується шляхом інтегрування:
Це тепло еквівалентне площі 1-2-3-4-1 на рис. 4.1. Середньою теплоємністю
При розрахунках в основному користуються середніми теплоємностями, визначаючи теплоту, що підведена до газу в процесі, за формулою:
Сумісно вирішуючи рівняння (4.7) і (4.8) отримуємо
Рівняння (4.8) встановлює зв'язок між середньою та істинною теплоємностями газу в даному процесі. Для точного визначення середньої теплоємності існують спеціальні таблиці, у яких наведені середні ізобарні та ізохорні теплоємності різних газів для інтервалу температур від Відповідно до правил інтегрування, інтеграл у рівнянні (4.6) може бути представленим різницею двох інтегралів:
з якої з урахуванням (4.8) випливає
Враховуючи рівняння (4.7), отримуємо
ІДЕАЛЬНОГО ГАЗУ 6.1. Загальні питання дослідження процесів
До основних термодинамічних процесів, що мають велике значення для аналізу роботи технічних систем, відносяться такі: ізохорний – це процес, що відбувається при незмінному об’ємі ізобарний – це процес, що відбувається при незмінному тиску ізотермічний – це процес, що відбувається при незмінній температурі адіабатний – це процес, що відбувається без теплообміну з навколишнім середовищем. Крім того існує величезна група процесів, які характеризуються незмінною теплоємністю процесу та називаються політропними. До цієї групи відносяться також і названі основні процеси. Дослідження всіх процесів будемо проводити за однією методикою, яка полягає в наступному: – встановлюється рівняння, що пов’язує між собою основні термодинамічні параметри на початку та в кінці процесу і виводиться рівняння кривої процесу для – визначається зміна внутрішньої енергії, ентальпії та ентропії в процесі; – визначаються робота розширення газу в процесі та тепло процесу; – будуються графіки процесів у
Ізохорний процес Ізохорним називається процес, що відбувається при незмінному об’ємі. Зв’язок між основними термодинамічними параметрами газу в цьому процесі встановлюється безпосередньо з рівняння стану ідеального газу:
звідси при
Отже
тобто, в ізохорному процесі
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 1545; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.108 (0.016 с.) |

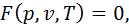


 молекул. Тоді в одиниці об’єму газу міститься молекул
молекул. Тоді в одиниці об’єму газу міститься молекул

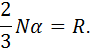

 залежить від виду газу. Її розмірність Дж/(кг∙К).
залежить від виду газу. Її розмірність Дж/(кг∙К). , отримуємо рівняння стану для довільної маси газу
, отримуємо рівняння стану для довільної маси газу  кг:
кг:
 – об’єм газу, м3.
– об’єм газу, м3. .
. , кг/кмоль і
, кг/кмоль і  , м3/кмоль – об’єм одного кіломоля газу:
, м3/кмоль – об’єм одного кіломоля газу:

 760 мм рт. ст. = 101325 Па;
760 мм рт. ст. = 101325 Па;  0° С (
0° С ( 273,15 К).
273,15 К). 22,4143 м3/кмоль. З урахуванням цього з рівняння (6) за нормальних фізичних умов
22,4143 м3/кмоль. З урахуванням цього з рівняння (6) за нормальних фізичних умов
 називають універсальною газовою сталою. Величина її однакова для всіх ідеальних газів.
називають універсальною газовою сталою. Величина її однакова для всіх ідеальних газів.
 . (1.8)
. (1.8)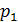
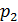


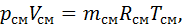 (2.9)
(2.9) – газова стала суміші.
– газова стала суміші.

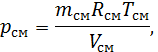





 , а питому, тобто теплоту, віднесену до 1 кг тіла, – через
, а питому, тобто теплоту, віднесену до 1 кг тіла, – через 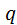 . Одиниця виміру питомої теплоти – Дж/кг. Підведену теплоту вважають додатною, відведену – від’ємною.
. Одиниця виміру питомої теплоти – Дж/кг. Підведену теплоту вважають додатною, відведену – від’ємною. , а питому, тобто роботу, віднесену до 1 кг тіла, – через
, а питому, тобто роботу, віднесену до 1 кг тіла, – через 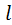 . Одиниця виміру питомої роботи – Дж/кг.
. Одиниця виміру питомої роботи – Дж/кг.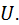 Вона складається з кінетичної енергії хаотичного теплового руху молекул тіла та потенціальної енергії їхньої взаємодії, енергії внутрішньомолекулярних коливань, потенціальної енергії зчеплення між молекулами, енергії електронних оболонок атомів, внутрішньоядерної енергії.
Вона складається з кінетичної енергії хаотичного теплового руху молекул тіла та потенціальної енергії їхньої взаємодії, енергії внутрішньомолекулярних коливань, потенціальної енергії зчеплення між молекулами, енергії електронних оболонок атомів, внутрішньоядерної енергії.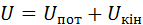 .
.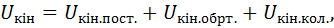
 – кінетична енергія поступального, обертального та коливального руху молекул і атомів, відповідно.
– кінетична енергія поступального, обертального та коливального руху молекул і атомів, відповідно.
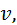 та від маси молекули
та від маси молекули 
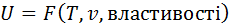 ,
,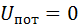 і з цього випливає, що для ідеального газу внутрішня енергія є однозначною функцією температури.
і з цього випливає, що для ідеального газу внутрішня енергія є однозначною функцією температури.




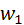 . Визначимо повну енергію
. Визначимо повну енергію 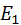 , якою володіє газ у цей момент часу.
, якою володіє газ у цей момент часу.
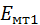 – енергія газу, як матеріального тіла;
– енергія газу, як матеріального тіла; 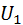 – внутрішня енергія газу.
– внутрішня енергія газу.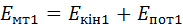 ,
,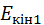 і
і 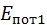 – кінетична та потенціальна енергія газу.
– кінетична та потенціальна енергія газу.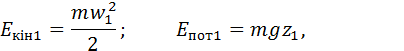
 – перевищення центра ваги газу над нульовим рівнем;
– перевищення центра ваги газу над нульовим рівнем; 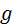 – прискорення вільного падіння. Отже
– прискорення вільного падіння. Отже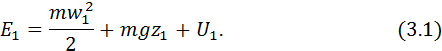
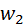 , перевищення – до
, перевищення – до 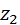 , внутрішня енергія – до
, внутрішня енергія – до  , то повна енергія газу стала
, то повна енергія газу стала
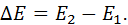

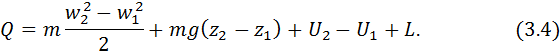



 Одиниця виміру цієї теплоємності Дж/(кг∙К).
Одиниця виміру цієї теплоємності Дж/(кг∙К). Одиниця виміру цієї теплоємності Дж/(нм3∙К).
Одиниця виміру цієї теплоємності Дж/(нм3∙К). Одиниця виміру цієї теплоємності Дж/(кмоль∙К).
Одиниця виміру цієї теплоємності Дж/(кмоль∙К).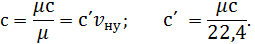
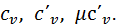 Друга називається ізобарною теплоємністю та позначається індексом
Друга називається ізобарною теплоємністю та позначається індексом 

 розуміють фактичне значення теплоємності газу
розуміють фактичне значення теплоємності газу 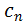 , що відповідає певній температурі
, що відповідає певній температурі 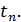 Істинна теплоємність дорівнює відношенню елементарної кількості теплоти, що підводиться до газу в якомусь термодинамічному процесі, до безкінечно малої різниці температур відносно точки процесу з фіксованою температурою:
Істинна теплоємність дорівнює відношенню елементарної кількості теплоти, що підводиться до газу в якомусь термодинамічному процесі, до безкінечно малої різниці температур відносно точки процесу з фіксованою температурою: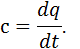

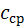 в інтервалі температур від
в інтервалі температур від 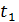 до
до 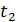 називають відношення кількості теплоти
називають відношення кількості теплоти  , підведеної в певному процесі, до отриманої в процесі різниці температур
, підведеної в певному процесі, до отриманої в процесі різниці температур 

 . (4.8)
. (4.8)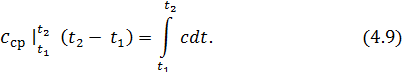
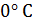 до певної температури
до певної температури  . Визначимо порядок підрахунку за допомогою цих таблиць середньої теплоємності газу для інтервалу між довільними температурами
. Визначимо порядок підрахунку за допомогою цих таблиць середньої теплоємності газу для інтервалу між довільними температурами 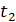 .
.

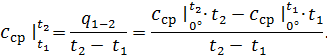


 і
і  –діаграм;
–діаграм;






