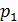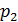Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні термодинамічні параметри стануСодержание книги
Поиск на нашем сайте
Будь-яка речовина може перебувати в одному з трьох основних фізичних станів: у вигляді газу, рідини або твердого тіла залежно від умов, у яких вона знаходиться – при зміні умов стан речовини міняється. Для визначення стану речовини використовують спеціальні величини, які однозначно характеризують стан. Їх називають термодинамічними параметрами стану. Відома значна кількість таких величин, серед яких у окрему групу виділяють так звані основні термодинамічні параметри стану – це абсолютний тиск, абсолютна температура та питомий об’єм. Відмінність основних термодинамічних параметрів стану від інших полягає в тому, що лише вони можуть бути безпосередньо виміряні. Інші параметрами стану розраховують. Тиск – це сила, що діє на одиницю поверхні тіла за нормаллю до неї. Для газу, структурні частинки якого мають можливість хаотично переміщуватись у будь-якому напряму, тиск є силою його взаємодії зі стінками резервуару, де він знаходиться, яка нормально спрямована до стінок і віднесена до одиниці їхньої площі. З точки зору молекулярно-кінетичної теорії, тиск газу являє собою осереднений результат ударів його молекул по стінкам резервуару. Для ідеального газу тиск, що позначається буквою
де Ідеальним називають газ, у якому відсутні сили міжмолекулярної взаємодії, а самі молекули мають безкінечно малий об’єм. Залежно від прийнятої бази для відліку тиск поділяють на такі види – абсолютний, надлишковий і вакуумметричний.
Рис. 1.1. Види тисків
Якщо тиск відраховують від нуля, то його називають абсолютним (рис. 1.1) і позначають
Якщо абсолютний тиск менший від атмосферного, то перевищення атмосферного тиску над абсолютним називають вакуумметричним тиском або вакуумом
Надлишковий тиск може змінюватися від 0, коли Вакуумметричний тиск може змінюватися від 0, коли
Прилади для вимірювання надлишкового тиску називаються манометрами, тому цей тиск називають також манометричним. Вакуумметричний тиск вимірюють вакуумметрами. Прилади для вимірювання атмосферного тиску називаються барометрами, тому інколи атмосферний тиск називають барометричним. Найчастіше для вимірювання використовують барометри-анероїди. Термодинамічним параметром стану, який однозначно характеризує стан речовини, є абсолютний тиск. Надлишковий і вакуумметричний тиски не являються параметрами стану через їхню залежність від величини атмосферного тиску. Тому в термодинамічні рівняння треба підставляти абсолютний тиск. Одиницею вимірювання тиску в системі СІ є паскаль – це сила в 1 ньютон, що віднесена до площі в 1 м2. Для технічних систем ця величина дуже мала, тому на практиці користуються кратними величини – кілопаскалем (1 кПа = 103 Па) і мегапаскалем (1 МПа = 106 Па). До тепер використовують також одиницю вимірювання тиску технічної системи, яка називається технічною атмосферою – це сила в 1 кілограм-сили (кгс), що віднесена до площі в 1 см2. Через те, що 1 ат = 9,81∙104 Па ≈ 105 Па, значне поширення має несистемна одиниця виміру тиску бар – 1 бар = 105 Па ≈ 1 ат.  нерухомої рідини (рис. 1.2) нерухомої рідини (рис. 1.2)
У якості врівноважувальних рідин використовують зазвичай ртуть (
1 мм рт. ст. = 133,32 Па; 1 мм вод. ст. = 9,81 Па. Існує також поняття фізичної атмосфери, яка дорівнює 1 атм = 760 мм рт. ст. = 101325 Па = 1,01 бар. Слід запам’ятати, що в усі термодинамічні рівняння тиск повинен підставлятися в паскалях. Температура – це величина, яка характеризує тепловий стан тіла, тобто ступінь його нагріву. З точки зору молекулярно-кінетичних уявлень про будову речовини температура є мірою інтенсивності хаотичного теплового руху молекул – чим вища інтенсивність цього руху, тим вища температура тіла. Отже, поняття температури не може бути використане до однієї або кількох молекул – вона характеризує макроскопічну систему в цілому. Для твердого тіла з жорсткою кристалічною граткою температура пропорційна енергії коливального руху атомів і молекул. Для рідин і газів вона пропорційна середній кінетичній енергії хаотичного поступального руху молекул. Зокрема, температура ідеального газу визначається співвідношенням
де Абсолютна температура – величина завжди додатна. Вона визначається за термодинамічною шкалою, відлік по якій розпочинається від абсолютного нуля, при якому зупиняється тепловий рух молекул. Одиниця виміру абсолютної температури – кельвін. У техніці для вимірювання температури використовують прилади, дія яких основана на визначені зміни фізичних параметрів тіл, залежних від температури, таких як об’єм рідини та газу, тиск газу, електричний опір, електрорушійна сила та інші. Найбільше поширення мають рідинні термометри, у яких зміна об’єму термометричної рідини залежно від температури відбивається на зміні висоти стовпчика рідини у приладі. Найчастіше використовують ртутні та спиртові термометри. Кожен прилад, що використовується для виміру температури, повинен бути відградуйованим відповідно до прийнятої практичної температурної шкали, в основу якої кладуться експериментально визначені температури в двох опорних (реперних) точках. У нашій країні, як і в більшості країн світу, такою є міжнародна практична стоградусна шкала (шкала Цельсія), у якій інтервал від температури танення льоду при атмосферному тиску до температури кипіння води в цих умовах розбито на 100 рівних частин – градусів Цельсія. Температура, виміряна за цією шкалою, позначається
У деяких країнах використовують інші практичні температурні шкали. Зокрема, в англомовних країнах використовують шкалу Фаренгейта, у якій температурний інтервал від точки танення льоду при атмосферному тиску до точки кипіння води в цих умовах розбито на 180 рівних частин – градусів Фаренгейта, і точці танення льоду приписана температура 32° F. Перехід від температури, виміряній по одній температурній шкалі, до температури за іншою практичною температурною шкалою здійснюється шляхом простого арифметичного перерахунку. Наприклад, температури за шкалою Цельсія та за шкалою Фаренгейта пов’язані такими співвідношеннями:
Слід запам’ятати, що термодинамічним параметром стану є абсолютна температура, тому в усі термодинамічні залежності необхідно підставляти саме її. Винятком є лише залежності, до яких уходить різниця температур. У цьому разі можна використовувати температуру в градусах Цельсія, зважаючи на те, що 1°С = 1 К. Питомий об’єм – це об’єм, який займає одиниця маси речовини. Зазвичай питомий об’єм позначають
де Використовують також величину, зворотну до питомого об’єму – густину речовини, що являє собою масу одиниці об’єму. ЇЇ позначають
Усі термодинамічні параметри стану поділяють на інтенсивні та екстенсивні. Інтенсивними параметрами називаються такі, що не залежать від кількості речовини. Це, зокрема, тиск і температура. Екстенсивні параметри пропорційні кількості речовини. До таких відноситься, зокрема, об’єм, який за певних умов змінюється пропорційно масі речовини. Екстенсивні параметри підпорядковуються закону адитивності, тобто їхня загальна величина для певної системи дорівнює сумі значень цих величин для кожної складової частини системи. Якщо позначити через
де Через це екстенсивні параметри називають також адитивними. Екстенсивні параметри, що віднесені до одиниці кількості речовини, набувають властивостей інтенсивних величин. Таким є, зокрема, питомий об’єм.
Термодинамічний стан Термодинамічні параметри однозначно характеризують термодинамічну систему лише в її рівноважному стані – такому, коли в усіх точках системи однакові всі інтенсивні параметри і коли вони незмінні в часі. Якщо в окремих точках системи різні температури, тиски або питомі об’єми, то такий її стан називається нерівноважним. Для такого стану часто неможливо визначити термодинамічні параметри системи. Наприклад, при швидкому стисканні або розширенні газу в циліндрі в ньому розповсюджуються хвилі стискання та розширення, через що в різних частинах циліндра тиск і температура будуть різними, тобто в цих процесах тиск і температура не являються параметром стану для всієї системи. При відсутності рівноваги в термодинамічній системі в ній під дією перепадів між значеннями параметрів стану виникають макроскопічні перетоки речовини та енергії, які поступово переводять систему до рівноважного стану. Тривалість цього переходу залежить від властивостей системи. Досвід показує, що ізольована термодинамічна система з плином часу завжди переходить до стану рівноваги і самостійно вийти з цього стану не може. У класичній термодинаміці розглядаються лише рівноважні системи.
Рівняння стану Досвід показує, що основні термодинамічні параметри стану будь-якої термодинамічної системи залежать один від одного. Для рівноважного стану найпростіших систем ця взаємозалежність описується рівнянням виду
яке в термодинаміці називається термічним рівнянням стану. Рівнянню стану можна надати іншого вигляду:
Ці рівняння вказують на те, що з трьох основних параметрів стану, які визначають стан простих термодинамічних систем, незалежними є будь-які два. Для вирішення завдань методами термодинаміки необхідно знати вид функціональної залежності між параметрами стану. Ця залежність різна для різних речовин і вона не може бути встановленою методами самої термодинаміки – рівняння стану можуть бути визначеними експериментально або методами статистичної фізики. Найпростіше їх встановити для ідеального газу. Сумісно вирішуючи рівняння (1) і (2), отримуємо
Розглядаючи 1 кг газу, приймаємо, що він містить у собі
і
Позначимо сталу величину, що віднесена до 1 кг газу,
Її називають газовою сталою. З урахуванням цього
Отримане співвідношення являє собою термічне рівняння стану ідеального газу та називається рівнянням Клайперона за прізвищем французького фізика, який першим його вивів у 1834 році. Газова стала Помноживши рівняння (1.3) на
де Рівнянню Клайперона можна надати універсальну форму, якщо газову сталу віднести не до 1 кг газу, а до одного його кіломоля, тобто до такої кількості газу, маса якого в кілограмах чисельно дорівнює його молекулярній масі Запишемо рівняння (1.4) для одного кіломоля газу. У цьому разі
Звідси
Із закону Авогадро, який стверджує, що рівні об’єми різних ідеальних газів при однакових тисках і температурах мають однакову кількість молекул, випливає, що за певних умов об’єм одного кіломоля різних ідеальних газів однаковий. Слід запам’ятати, що порівнювати між собою об’єми різних газів можна за умови, якщо ці об’єми виміряні при однакових тисках і температурах. У термодинаміці об’єми газів зводять, зазвичай, до так званих нормальних фізичних умов, параметри яких такі:
За цих умов
Добуток Уводячи до рівняння стану (1.5) значення
Рівняння (1.7) називають рівнянням Клайперона – Менделєєва, зважаючи на те, що його вперше запропонував Д.І. Менделєєв у 1874 р. Знаючи універсальну газову сталу, можна підрахувати газову сталу будь якого ідеального газу за формулою:
Наведені рівняння стану справедливі лише для ідеальних газів. Але вони дають достатню точність і при розрахунках реальних газів у великій кількості практичних завдань. Реальні гази тим ближчі за своїми властивостями до ідеальних, чим вища їхня температура та менший тиск. Якщо стан газу близький до його зрідження, то ці рівняння використовувати неможна – у цьому разі розрахунки виконують за допомогою спеціальних параметричних таблиць і діаграм.
Термодинамічний процес
Якщо хоча б один із параметрів стану термодинамічної системи змінюється в часі, то в системі відбувається термодинамічний процес, що являє собою неперервну послідовність нових станів системи, що змінюються. Усі процеси, що відбуваються в термодинамічних системах, поділяються на рівноважні та нерівноважні. Рівноважними називаються процеси, у яких усі проміжні стани, через які проходить система, є рівноважними. У разі невиконання цієї умови процеси називаються нерівноважними.

 . Але використовувати для розрахунків просторову систему координат незручно, тому на практиці, зазвичай, користуються площинними координатними системами . Але використовувати для розрахунків просторову систему координат незручно, тому на практиці, зазвичай, користуються площинними координатними системами 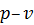 , ,  або або  . У цьому разі координати точок на площині будуть відповідати значенням двох параметрів стану, а величина третього параметру може бути знайденою за рівнянням стану. Найбільше поширення має координатна система . У цьому разі координати точок на площині будуть відповідати значенням двох параметрів стану, а величина третього параметру може бути знайденою за рівнянням стану. Найбільше поширення має координатна система 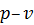 , у якій на осі абсцис відкладають питомий об’єм , у якій на осі абсцис відкладають питомий об’єм  , а на осі ординат – абсолютний тиск , а на осі ординат – абсолютний тиск  . .
 і питомим об’ємом і питомим об’ємом  . .
 і питомий об’єм і питомий об’єм  . Лінія 1-2, що відображає цей перехід, називається кривою процесу. Кожна точка цієї кривої характеризує рівноважний стан системи. Лише рівноважні термодинамічні процеси можуть бути зображені графічно. . Лінія 1-2, що відображає цей перехід, називається кривою процесу. Кожна точка цієї кривої характеризує рівноважний стан системи. Лише рівноважні термодинамічні процеси можуть бути зображені графічно.
Рівноважні процеси є процесами оборотними. Це означає, що при проходженні процесу в зворотному напрямку система пройде в зворотному порядку через усі стани, у яких вона перебувала в прямому процесі, і повернеться до початкового стану, не викликаючи ніяких змін його параметрів і змін у навколишньому середовищі. Прикладом оборотних процесів є процеси 1-2 і 2-1, що відмічені на рис. 4 стрілками. Нерівноважні процеси являють собою необоротні процеси. При проведенні таких процесів у прямому та зворотному напрямках або система, або зовнішнє середовище не повертаються до початкового стану. Якщо кінцевим станом системи є стан 2 з певними параметрами, то з цього випливає, що зміна параметрів у процесі переходу системи із стану 1 до стану 2, зокрема, зміна тиску або зміна питомого об’єму в процесі, становить, відповідно,
і вона не залежить від виду процесу – ця зміна буде однаковою як у процесі 1-2, так і в процесі 1- а -2, зображених на рис. 4. Незалежність зміни параметрів стану в термодинамічному процесі від виду процесу або, іншими словами, від шляху переходу з початкового до кінцевого стану, є головною ознакою параметрів стану – ця зміна визначається лише початковим і кінцевим станами системи. Це дає підставу стверджувати, що параметри стану, значення яких залежать лише від початкового та кінцевого станів системи, являються функціями стану.
СУМІШІ ІДЕАЛЬНИХ ГАЗІВ Газовою сумішшю називають механічну суміш окремих газів, які не вступають між собою ні в які хімічні реакції. Такою сумішшю є, зокрема, атмосферне повітря, яке складається з кисню, азоту, вуглекислого газу, водяної пари, інертних газів. У підземних виробках склад повітря змінюється через те, що з гірничих порід виділяються такі гази, як метан, вуглекислий газ, сірководень та інші. При певній концентрації цих домішок повітря в гірничих виробках може стати вибухонебезпечним або отруйним. Тому важливим завданням для гірничого інженера є вміння підтримувати безпечний склад рудникового повітря, а для цього він повинен мати чітку уяву про властивості газових сумішей.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 853; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.168.219 (0.009 с.) |

 , визначається співвідношенням:
, визначається співвідношенням:
 – кількість молекул в одиниці об’єму;
– кількість молекул в одиниці об’єму;  – маса однієї молекули;
– маса однієї молекули; 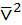 – середня квадратична швидкість поступального руху молекул.
– середня квадратична швидкість поступального руху молекул.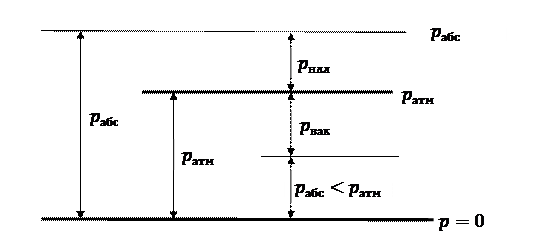
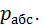 Безпосередньо виміряти абсолютний тиск технічно складно, адже для цього у вимірювальному приладі необхідно мати ємність із нульовим тиском. Набагато простіше вимірювати тиск, якщо за базу для його відліку прийняти атмосферний тиск
Безпосередньо виміряти абсолютний тиск технічно складно, адже для цього у вимірювальному приладі необхідно мати ємність із нульовим тиском. Набагато простіше вимірювати тиск, якщо за базу для його відліку прийняти атмосферний тиск 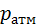 . У цьому разі вимірювальний прилад буде фіксувати відхилення тиску в точці заміру від атмосферного тиску. Перевищення абсолютного тиску над атмосферним називають надлишковим тиском і позначають
. У цьому разі вимірювальний прилад буде фіксувати відхилення тиску в точці заміру від атмосферного тиску. Перевищення абсолютного тиску над атмосферним називають надлишковим тиском і позначають  :
:

 до ∞.
до ∞. коли
коли 
 ,
, де
де  – тиск на вільній поверхні рідини;
– тиск на вільній поверхні рідини;  – заглиблення точки
– заглиблення точки  – густина рідини, кг/м3;
– густина рідини, кг/м3;  9,81 м/с2 – прискорення вільного падіння.
9,81 м/с2 – прискорення вільного падіння.
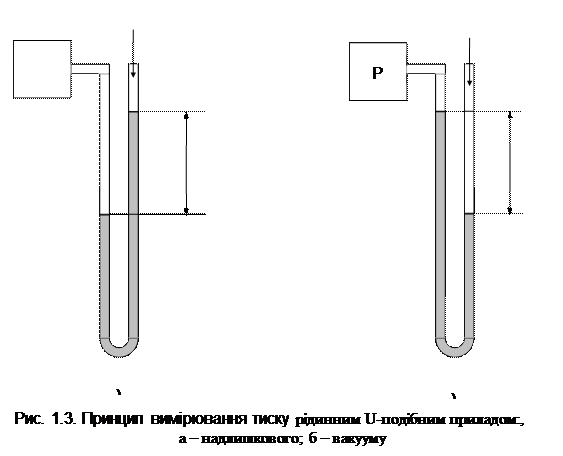
 На цьому базується дія рідинних манометрів і вакуумметрів. На рис. 1.3, а показано вимірювання надлишкового тиску в резервуарі рідинним U-подібним манометром – цей тиск дорівнює
На цьому базується дія рідинних манометрів і вакуумметрів. На рис. 1.3, а показано вимірювання надлишкового тиску в резервуарі рідинним U-подібним манометром – цей тиск дорівнює 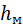 метрів урівноважульної рідини або
метрів урівноважульної рідини або Па.
Па. цей тиск дорівнює
цей тиск дорівнює  метрів урівноважульної рідини або
метрів урівноважульної рідини або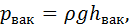 Па.
Па. 13595 кг/м3) або воду (
13595 кг/м3) або воду (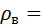 1000 кг/м3), при цьому
1000 кг/м3), при цьому





 – абсолютна температура ідеального газу;
– абсолютна температура ідеального газу;  – середня кінетична енергія поступального руху молекул;
– середня кінетична енергія поступального руху молекул;  – коефіцієнт пропорційності.
– коефіцієнт пропорційності.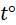 С. Точці танення льоду приписана температура
С. Точці танення льоду приписана температура  0° С, точці кипіння води – температура
0° С, точці кипіння води – температура  273,16 К (точно), а за шкалою Цельсія
273,16 К (точно), а за шкалою Цельсія  0, 01° С. Отже, абсолютна температура та температура в градусах Цельсія пов’язані між собою співвідношенням
0, 01° С. Отже, абсолютна температура та температура в градусах Цельсія пов’язані між собою співвідношенням

 і вимірюють у м3/кг:
і вимірюють у м3/кг:
 – об’єм довільної кількості речовини, м3;
– об’єм довільної кількості речовини, м3;  – маса цієї речовини, кг.
– маса цієї речовини, кг.
 термодинамічний параметр, то у випадку його адитивності
термодинамічний параметр, то у випадку його адитивності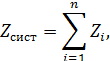
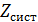 і
і  – значення параметра для системи в цілому та для i-тої її частини відповідно
– значення параметра для системи в цілому та для i-тої її частини відповідно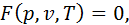


 молекул. Тоді в одиниці об’єму газу міститься молекул
молекул. Тоді в одиниці об’єму газу міститься молекул

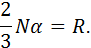

 залежить від виду газу. Її розмірність Дж/(кг∙К).
залежить від виду газу. Її розмірність Дж/(кг∙К).
 – об’єм газу, м3.
– об’єм газу, м3. .
. , кг/кмоль і
, кг/кмоль і  , м3/кмоль – об’єм одного кіломоля газу:
, м3/кмоль – об’єм одного кіломоля газу:

 760 мм рт. ст. = 101325 Па;
760 мм рт. ст. = 101325 Па;  0° С (
0° С ( 273,15 К).
273,15 К). 22,4143 м3/кмоль. З урахуванням цього з рівняння (6) за нормальних фізичних умов
22,4143 м3/кмоль. З урахуванням цього з рівняння (6) за нормальних фізичних умов
 називають універсальною газовою сталою. Величина її однакова для всіх ідеальних газів.
називають універсальною газовою сталою. Величина її однакова для всіх ідеальних газів.
 . (1.8)
. (1.8)