Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
при захворюваннях серцевого м’яза
(за А. Ф. Комаровим та ін.)
| Фермент
| Захворювання
| | Інфаркт міокарда
| Стенокардія
| Міокардит
| | АсАТ
| Сильно підвищена
| Майже завжди норма
| Підвищена
| | АлАТ
| Помірно підвищена
| Норма
| Те саме
| | ФДФА
| Те саме
| Майже завжди норма
| Помірно підвищена
| | ЛДГ
| Підвищена
| Те саме
| Норма або злегка підвищена
| | КК
| Сильно підвищена
| Норма
| Підвищена
| | МДГ
| Підвищена
| Те саме
| Норма
| | ХЕ
| Знижена
| —«—
| Те саме
| | Гексозофосфат-ізомераза
| Підвищена
| —«—
| —«—
|
Таблиця А.6 – До диференціальної діагностики інфаркту міокарда і емболії легеневих судин
(за А. Ф. Комаровим та ін.)
| Захворювання
| КК
| ЛДГ
| Ізоферменти ЛДГ
| АсАТ
| АлАТ
| | Інфаркт міокарда
| +++
| ++
| ЛДГ1-2
| ++
| + (++)
| | Емболія легеневих судин
|
| +
| ЛДГ3-5
| +
| ++
| | Примітка: + підвищення; ++ помітне підвищення;
+++ різке підвищення
|
Таблиця А.7 – Характеристика інших ферментів, що згадуються
В посібнику
| Назва ферменту
| Код фер-менту
| Значення ферменту
| |
|
|
| | Аденозин-дезаміназа
| 3.5.4.4
| Каталізує гідролітичне відщеплення аміаку від аденозину з утворенням інозину, активний у печінці і слизовій оболонці кишечнику. Збільшення рівня ферменту спостерігається при гепатиті, цирозі, гемохроматозі, механічній жовтяниці, раку передміхурової залози і сечового міхура, гемолітичній анемії, лихоманці при ревматизмі і тифі, подагрі. Зменшення рівня ферменту спостерігається при комбінованих імунодефіцитних станах
| | Аланін-амінопеп-тидаза
| 3.4.11.2
| Локалізований у тонкому кишечнику і на мембрані ниркових мікроворсинок, а також на інших плазматичних мембранах. ААП є екзопептидазою та гідролізує N-кінцеву амінокислоту з пептиду. Відомі 5 ізоферментів ААП. Ізофермент AA1 представлений головним чином у тканині печінки, ААП2 – у підшлунковій залозі, ААП3 – у нирках, ААП4 і ААП5 – у різних відділах стінки кишечника. При ушкодженні тканини нирок ізофермент ААП3 виявляється в крові та сечі, що є специфічною ознакою ураження ниркової тканини
| | Аргіназа
| 3.5.3.1
| Органоспецифічний фермент для печінки. Каталізує розщеплення аргініну на орнітин і сечовину. Дефект аргінази приводить до аргінінемії
| | Арилсуль-фатаза А
| 3.1.6.1
| Виявлений у лізосомах усіх клітин, крім зрілих еритроцитів. Його активність найбільш висока в клітинах печінки, підшлункової залози та нирок, де екзогенні речовини перетворюються в складні ефіри сірчаної кислоти. Підвищення рівня арилсульфатази А у сечі відзначається при раку сечового міхура, прямої та ободової кишки і лейкозі
| Продовження табл. А.7
|
|
|
| | Арилсуль-фатаза В
| 3.1.6.4
| Здійснює гідроліз сульфатної групи N-ацетилгалактозамін-4-сульфату, дерматан-сульфату і хондроїтин-4-сульфату. Дефіцит арилсульфатази В є причиною спадкового мукополісахаридозу VI типу
| | N-ацетил-гексоз-амінідаза
| 3.2.1.52
| За участі білка-активатора бере участь у деградації GM2-гангліозидів. Дефіцит β,N-ацетилгексозамінідази приводить до розвитку гангліозидозу, або хвороби Тея-Сакса.
| | Гексо-кіназа
| 2.7.1.1
| Каталізує перенесення фосфату з молекули АТФ на D-глюкозу (D-гексозу, D-фруктозу, D-манозу або D-глюкозамін) з утворенням АДФ і D-глюкозо-6-фосфату – перша реакція гліколізу; часто використовується як популяційно–генетичний маркер
| | Гіалуро-нідаза
| 3.2.1.35 і 3.2.1.36
| Гіалуронідази – це назва ферментів, які каталізують реакції гідролітичного розщеплення і деполімеризації гіалуронової кислоти (важлива складова частина сполучної тканини і шкірних покривів) і споріднених до неї сполук. Гіалуронідаза виконує важливу біологічну роль, пов’язану зі зміною проникності тканин, ступенем їх гідратації, транспортом води та іонів. Підвищений вміст гіалуронідази у сечі використовується як один з біохімічних маркерів раку сечового міхура
| | Гістидаза
| 4.3.1.3
| Органоспецифічний фермент печінки, що каталізує дезамінування гістидину з утворенням уроканінової кислоти. Це один з ранніх тестів при гострих вірусних гепатитах, його клінічна чутливість при паренхіматозних захворюваннях печінки становить 85 %. Збільшення активності гістидази більш характерне для гострих уражень печінки Незначне підвищення активності ензиму відзначається при деяких шкірних хворобах (сверблячі дерматози, псоріаз). Активність гістидази в пунктатах печінки визначають у клініці дитячих хвороб для прямого доказу наявності у хворого гістидинемії
| Продовження табл. А.7
|
|
|
| | Гістидин-декарбок-силаза
| 4.1.1.22
| Каталізує декарбоксилювання L-гістидину з утворенням двоокису вуглецю та гістаміну, який відіграє важливу роль у процесі запалення та розвитку деяких алергічних реакцій
| | Глутамі-наза
| З.5.1.2
| Каталізує гідролітичне розщеплення L-глутаміну на L-глутамінову кислоту та аміак; найбільш активний у нирках
| | Глутамін-синтетаза
| 6.3.1.2
| Каталізує за наявності АТФ утворення L-глутаміну з L-глутамінової кислоти та аміаку; бере участь у знешкодженні вільного аміаку в тканинах
| | α-Глюко-зидаза
| 3.2.1.20
| Каталізує гідролітичне розщеплення мальтози на дві молекули глюкози, діє також і на інші α-D-глюкозиди; бере участь у перетравлюванні вуглеводів
| | β-Глюко-зидаза
| 3.2.1.21
| Каталізує гідроліз β-глікозидного зв’язку в природних і синтетичних β-глікозидах та олігосахаридах; спадкова недостатність β-глюкозидази є причиною розвитку глюкоцереброзидозу, або хвороби Гоше
| | Глюкозо-фосфат-ізомераза
| 5.3.1.9
| Каталізує перетворення D-глюкозо-6-фосфату на D-фруктозо-6-фосфат у другій реакції гліколізу; генетично детермінована недостатність ферменту може приводити до гемолітичної анемії. Глюкозофосфатізомераза часто використовується як популяційно-генетичний маркер
| | β-Глю-куронідаза
| 3.2.1.31
| Каталізує гідроліз β-глюкуронідів – похідних β-глюкуронової кислоти і різних фенолів, спиртів, карбонових кислот, міститься в нирках і печінці. Відсутність ферменту в організмі приводить до мукополісахаридозу VII типу. Підвищення активності β-глюкуронідази в сечі відзначається при захворюваннях печінки, раку нирок і сечового міхура, гострому некрозі ниркових канальців, гострому пієлонефриті. Значне збільшення активності ферменту в сечі спостерігається при гострій нирковій недостатності
| Продовження табл. А.7
|
|
|
| | Ізоцитрат-дегідро-геназа
| 1.1.1.42
| Каталізує оборотну реакцію дегідрування та декарбоксилювання ізоцитрату з утворенням α-кетоглутарату. НАДФ-залежна форма ІДГ наявна в усіх тканинах, але найбільша її активність виявлена в печінці, скелетних м’язах, серці. Підвищена активність ферменту, може спостерігатися при вірусних і токсичних гепатитах, обтураційній жовтяниці, метастазах у печінку й цирозі, гіпоксії печінки унаслідок гемодинамічних причин, ураженні печінки при бактеріальних інфекціях, атрезії жовчних проток у новонароджених дітей, інфекційному мононуклеозі. Також збільшення активності цього ферменту може спостерігатися при тяжкому інфаркті легені, мієлолейкозі, мегалобластній анемії. Зниження активності ІДГ спостерігається при масивному некрозі печінкових клітин
| | Калікреїн
| 3.4.21.34
| Представник групи ферментів, що присутні в крові та інших рідинах організму і які впливають на ряд глобулінів плазми, приводячи до утворення брадикініну та калідину
| | Карбо-ангідраза
| 4.2.1.1
| Каталізує зворотну реакцію розщеплення вугільної кислоти до двоокису вуглецю і води. Міститься в еритроцитах, клітинах слизової оболонки шлунка, корі надниркових залоз, нирках, у незначних кількостях – у ЦНС, підшлунковій залозі та інших органах. Бере участь у підтримці кислотно-лужної рівноваги, транспорті СО2, утворенні соляної кислоти слизовою оболонкою шлунка. Підвищення активності ферменту в крові відзначається при анеміях різного генезу, порушеннях кровообігу II–III ступенів, деяких захворюваннях легенів (бронхоектази, пневмосклероз), а також при вагітності. Зниження активності цього ферменту в крові відбувається при ацидозі ниркового генезу, гіпертиреозі
| Продовження табл. А.7
|
|
|
| | Карбок-силесте-раза
| 3.1.1.1
| Каталізує гідроліз аліфатичних і ароматичних ефірів нижчих жирних кислот, а також ефірів молочної, янтарної та інших кислот і багатьох амінокислот
| | Карбокси-пептидази А і В
| 3.4.17.1 і 3.4.17.2
| Каталізують гідролітичне відщеплення С-кінцевих амінокислотних залишків у молекулі білків і пептидів. У плазмі крові людини функціонує карбоксипептидаза типу N, що подібна за субстратною специфічністю до карбоксипептидази типу В. Цей фермент каталізує відщеплення С-кінцевого аргініну від пептиду брадикініну, що міститься в крові, в результаті чого цей пептид втрачає здатність знижувати кров’яний тиск
| | Колагеназа
| 3.4.24.3
| Високоспецифічний фермент, що розщеплює колаген із виділенням вільної амінокислоти оксипроліну. Колагеназа продукується анаеробними мікроорганізмами і руйнує тканини, наприклад у рані
| | Лізоцим
| 3.2.1.17
| Антибактеріальний агент, що руйнує клітинні стінки бактерій шляхом гідролізу пептидоглікану муреїну
| | Малат-дегідро-геназа
| 1.1.1.37
| Каталізує окислення малату до оксалоацетату в циклі Кребса. МДГ знайдена в мозку, серці, печінці, м’язах, нирках та інших тканинах
| | Моно-аміно-оксидаза
| 1.4.3.4
| Є ферментом, що бере участь в інактивації ряду біологічно активних речовин, таких, як адреналін, норадреналін, серотонін, тирамін та ін.
| | Орнітин-карбамоїл-трансфе-раза
| 2.1.3.3
| Специфічний для печінки фермент, що бере участь у циклі синтезу сечовини, забезпечуючи перетворення орнітину в цитрулін. Спадкова недостатність ферменту є причиною гіперамоніємії ІІ типу
| | Піруват-кіназа
| 2.7.1.40
| Гліколітичний фермент, що каталізує передостанню реакцію гліколізу – перенесення залишку фосфорної кислоти від фосфоенолпірувату до АДФ із утворенням АТФ і пірувату. Недостатність піруваткінази приводить до хронічної гемолітічної анемії
| Продовження табл. А.7
|
|
|
| | РНКаза A
| 3.1.26.1
| Має активність ендорибонуклеази, специфічно розщеплює фосфодіефірні зв’язки, утворені піримідиновими нуклеотидами. Продуктами гідролізу є 3’-фосфорильовані піримідинові мононуклеотиди та олігонуклео-тиди, що містять кінцеві піримідин-3’-монофосфати
| | Тирози-наза
| 1.14.18.1
| Біфункціональний мідьвмісний фермент, що каталізує перетворення тирозину на дигідроксифенілаланін (ДОФА) і потім на ДОФА-трансамідиназа хінон (реакції циклу біосинтезу меланіну); недостатність тирозинази є причиною виникнення альбінізму
| | Транс-амідиназа
| 2.6.2.1
| Органоспецифічний фермент нирок, бере участь у синтезі гуанідиноцтової кислоти - попередника креатину. Найбільша активність трансамідинази виявлена в нирках і підшлунковій залозі, де вона міцно зв’язана з тканиною. У сечі здорових людей трансамідиназа не виявляється. Найбільша активність трансамідінази спостерігається в сечі при гострій формі гломерулонефриту
| | Транс-кетолаза
| 2. 2.1.1
| Каталізує оборотну реакцію перенесення глікольної групи від кетозомонофосфату на альдозофосфат. Визначення в крові співвідношення апо- і холотранскетолази (остання містить кофермент ТДФ) використовують для характеристики забезпеченості організму тіаміном
| | Тріозо-фосфат-ізомераза
| 5.3.1.1
| Фермент гліколізу, що каталізує взаємоперетворення діоксіацетонфосфату і D-гліцеральдегід-3-фосфату. Дефіцит актив-ності тріозофосфатізомерази зумовлює рідкісну спадкову гемолітичну анемію
| | Урокіназа
| 3.4.21.73
| Фермент виробляється нирками і бере участь у розчиненні тромбів крові. Урокіназа активізує безпосереднє перетворення плазміногену на плазмін, який розчиняє кров’яні згустки
|
Продовження табл. А.7
|
|
|
| | Фосфо-глюко-мутаза
| 5.4.2.2
| Каталізує перетворення глюкозо-1-фосфату (як продукту розщеплення глікогену) на глюкозо-6-фосфат. Ген фосфоглюкомутази (PGM) є одним із найбільш поширених популяційно – генетичних маркерів
| | Церуло-плазмін
| 1.16.3.1
| Мідьвмісний білок (глікопротеїн), що наявний у плазмі крові. У церулоплазміні міститься близько 95 % загальної кількості міді сироватки крові людини. Уроджений дефіцит церулоплазміну приводить до дефектів розвитку головного мозку і печінки (хвороба Вільсона)
|
Таблиця А.8 - Показники лабораторних тестів, які використовують для диференціальної діагностики захворювань, супроводжуваних гострими болями в животі
(за В. Г. Колбом і В. С. Камишніковим)
| Захво-рювання
| АсАТ
| АлАТ
| ГлДГ
| ЛФ
| α-Амілаза
| Показники інших лаборатор-них тестів
| | Гострий панкреа-тит
| (+), +
| (+), +
| н, (+), +
| (+)
| +++
| α-Амілаза сечі: ++, +++
| | Ниркова коліка
| н
| н
| н
| н
| н
| Гематурія
| | Печін-кова коліка
| +, ++
| +, ++
| ++
| ++
| н, (+), +
| Гіпербілі-рубінемія
| | Спазми кишок
| н
| н
| н
| н
| н
| —
| | Інфаркт міокарда (атипо-вого пе-ребігу)
| ++
| н, (+), +
| н
| н
| н
| КК, ЛДГ, ГБДГ (++, +++)
| | Гострий гепатит
| +++
| +++
| ++
| (+), +
| н
| Гіпербілі-рубінемія
| | Примітка: н - норма, (+) - слабке зростання, + - зростання,
++ - сильне зростання, +++ - дуже сильне зростання
|
| «Старіння» клітин та їх відмирання
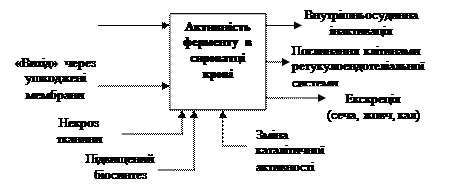
| | Схема А.1 – Фактори, що впливають на рівень активності ферментів у сироватці крові
|