
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторно-практическое занятие № 3Содержание книги
Поиск на нашем сайте
«Анализ веществ, изолируемых перегонкой с водяным паром. Спирты» Задание 1. провести качественный анализ дистиллята на наличие спиртов. Метиловый спирт Образование метилсалицилата К 1 мл дистиллята прибавляют 0,03 – 0,05 г кислоты салициловой и 2 мл кислоты серной концентрированной, затем смесь осторожно нагревают в пламени горелки. При наличии метилового спирта в исследуемом растворе ощущается характерный запах метилсалицилата. Реакция окисления метанола до формальдегида и обнаружение последнего реакциями окрашивания. К 2 мл дистиллята прибавляют 1 мл раствора калия перманганата и несколько капель 10% раствора кислоты серной, жидкость охлаждают и перемешивают, затем для удаления избытка калия перманганата прибавляют 1 мл 5% раствора кислоты щавелевой в кислоте серной разбавленной (1:1). Образующийся формальдегид открывают реакцией с кислотой фуксинсернистой. Несоблюдение условий проведения реакции может привести к переоткрытию метанола за счет того, что формальдегид будет образовываться из этилового спирта, который может находиться в дистилляте. Этиловый спирт Реакция образования йодоформа. К 1 мл дистиллята добавляют 2 мл 5% раствора гидроксида натрия, а затем по каплям 1% раствор йода в 2% растворе йодида калия до сохранения слабо-желтого окрашивания. Смесь нагревают 5 - 10 минут на водяном бане, при этом ощущается запах йодоформа. При охлаждении раствора образуются кристаллы йодоформа. Реакция образование ацетальдегида. К 1 мл дистиллята прибавляют 10% раствор серной кислоты до кислой реакции. К этой смеси по каплям прибавляют 10% раствор дихромата калия до оранжево-красной окраски, нагревают на кипящей водяной бане 3 – 5 минут. Наблюдается переход окраски из оранжевой в зеленую и ощущается характерный запах ацетальдегида (запах резаных яблок). Эффект реакции также наблюдается, если смесь оставить на несколько минут при комнатной температуре или при слабом нагревании. Реакция образование этилацетата. К 1 мл дистиллята прибавляют 0,1 г высушенного ацетата натрия, затем осторожно по каплям 2 мл концентрированной серной кислоты. Смесь нагревают на кипящей водяной бане до выделения пузырьков газа. После охлаждения ощущается запах этилацетата, который появляется более отчетливо, если к содержимому пробирки добавить 20-25 кратный объем воды. Изоамиловый спирт Все реакции на изоамиловый спирт дают положительный эффект только при отсутствии воды, поэтому перед выполнением реакций изоамиловый спирт экстрагируют из дистиллята эфиром (5 мл), эфирную вытяжку делят на 4 части и эфир испаряют при комнатной температуре. С полученным остатком проделывают реакции: Реакция образование изоамилацетата. К остатку в фарфоровой чашке прибавляют 2 капли кислоты серной концентрированной и 0,03 г высушенного порошка натрия ацетата. Нагревают на водяной бане. Ощущается характерный запах амилацетата (запах грушевой эссенции). Запах ощущается более отчетливо, если к реакционной смеси добавить 20-25 кратный объем воды.
Реакция образование изовалерианового альдегида. К остатку в фарфоровой чашке прибавляют 3-5 капель 10 % раствора калия перманганата и 5-10 капель кислоты серной концентрированной. Пробирку нагревают на кипящей водяной бане в течение 1-2 мин. Появляется едва уловимый приятный запах изовалерианового альдегида, затем неприятный запах гнилого сыра, характерный для изовалериановой кислоты, который вновь переходит в приятный запах изоамилового эфира изовалериановой кислоты. Реакция Комаровского с салициловым альдегидом (на высшие спирты, содержащие более 3 атомов углерода). К сухому остатку в фарфоровой чашке прибавляют 1 мл 1% спиртового раствора альдегида салицилового и 3 мл кислоты серной концентрированной. Чашку помещают на водяную баню на 3 мин. Появление розово-красной окраски указывает на наличие спирта изоамилового в пробе. При больших количествах спирта изоамилового окраска жидкости появляется без нагревания.
Этиленгликоль Реакция окисления калия перйодатом и последующим обнаружением формальдегида К 3 - 5 мл дистиллята прибавляют 5 капель 12 % раствора кислоты серной, 5 капель 5 % раствора калия перйодата в 5 % растворе кислоты серной и взбалтывают. Через 5 мин. прибавляют 3 - 5 капель раствора кислоты серной, а затем 4 капли раствора кислоты фуксинсернистой. При наличии этиленгликоля через 3 - 20 мин появляется красно-фиолетовое или розовое окрашивание. Реакция окисление этиленгшлшоля кислотой азотной до кислоты щавелевой с последующим ее обнаружением Часть дистиллята окисляют кислотой азотной при выпаривании в фарфоровой чашке на водяной бане досуха. Остаток растворяют в воде, нейтрализуют водным раствором аммония гидроксида и прибавляют раствор кальция хлорида. Выпадение кристаллического осадка (возможно через 2 - 3 суток), нерастворимого в кислоте уксусной и растворимого в кислоте хлористоводородной и имеющего характерную форму кристаллов указывает на наличие этиленгликоля в дистилляте. Реакция образования гликолята меди. К 2 – 3 мл дистиллята прибавляют 1 – 2 мл 10% раствора натрия гидроксида и несколько капель 10% раствора сульфата меди. Появляется голубое окрашивание.
Результаты качественных реакций диализата занести в таблицу: Таблица 1.
Задание 2. Провести количественное определение спиртов. Количественное определение одноатомных спиртов в дистилляте проводят методом ГЖХ и ИК-спектроскопии после пробоподготовки. Газохроматографическое определение этилового спирта в жидких биосредах. Выполнение работы I. Обнаружение этилового спирта в биологической пробе. Предварительно готовят растворы нитрита натрия, трихлоруксусной кислоты и пропанола. Во флаконы из-под пенициллина, содержащие 0,5 мл раствора трихлоруксусной кислоты, вносят 0,5 мл эталонного раствора этилового спирта (концентрация 3 - 4,0 ‰) и 0,5 мл исследуемой пробы. Флаконы закрывают стандартными резиновыми пробками и фиксируют алюминиевыми колпачками с помощью ПОК (прибор для обжима пенициллиновых флаконов). После энергичного перемешивания во флаконы шприцем вводят по 0,35 мл 30% раствора нитрита натрия. Содержимое флаконов энергично встряхивают (30 маятникообразных движений) и оставляют на 1 минуту. Затем из флаконов шприцем путем прокола пробки отбирают 0,5 мл парогазовой фазы, которую тотчас же вводят в прибор. С помощью секундомера измеряют время удерживания от начала выхода пика несорбирующегося компонента (воздуха) до максимума измеряемого пика. Это исправленное время удерживания вещества в колонке. При наличии в исследуемой биологической жидкости алифатических спиртов на хроматограмме появляются пики соответствующих алкилнитритов. По формулам 1, 2, 3 рассчитывают параметры удерживания:
где V0r,i – исправленный удерживаемый объем вещества i, мл; Vr, st – исправленный удерживаемый объем вещества – стандарта, мл; Vq – относительный удерживаемый объем, мл; v – скорость потока газа - носителя, мл/с; tоr,i – исправленное время удерживания вещества, с; tst – исправленное время удерживания вещества – стандарта, с; tq - относительное время удерживания, с.
Для идентификации алкилнитритов часто достаточно вычислить относительное время удерживания. Если на хроматограмме исследуемой пробы отсутствуют пики, то делают заключение о необнаружении алифатических спиртов С1-С5. Приготовление растворов. Нитрит натрия. 30 г NaNO2 растворяют в 100 мл дистиллированной воды. Хранят в склянке из темного стекла в холодильнике. Трихлоруксусная кислота. 50 г ССl3CООН растворяют в 100 мл дистиллированной воды. Хранят в склянке из темного стекла при комнатной температуре. Пропанол. 0,4 мл спирта в мерной колбе доводят дистиллированной водой до 100 мл. Хранят в склянке с притертой пробкой в холодильнике до 5 суток.
Количественное определение этилового спирта газожидкостной хроматографией. Количественный анализ проводят с помощью калибровки по методу внутреннего стандарта, используя для расчета отношение высот пика этанола к пику пропанола. Градуировочный график для количественных исследований строят ежедневно, так как при повторном включении прибора условия хроматографирования могут изменяться. При построении графика используются стандартные растворы этанола с концентрацией 0,4-2,0-4,0‰, которые подвергаются газохроматографическому исследованию в тех же условиях, что и исследуемые пробы. Для приготовления эталонных растворов используют 95-96%-ный этиловый спирт. Предварительно спиртомером измеряют процент (объемный) исходного алкоголя. Для получения 100 мл 10%-ного раствора из исходного спирта, содержащего 95,9 % (объемных), следует: – перевести по алкоголеметрической таблице объемные проценты в массовые, что будет соответствовать 93,7 % с плотностью 0,8129 г/см3; – вычислить массу этилового спирта, необходимого для приготовления раствора требуемой концентрации 93,7 % - 100 г 10,0% - х г
– определить объем исходного раствора этилового спирта, соответствующий вычисленной массе
13,1 мл этилового спирта переносят количественно в мерную колбу емкостью 100 мл. Объем доводится дистиллированной водой до метки. Полученный раствор используется для приготовления эталонных растворов. Для приготовления стандартного раствора с концентрацией 0,4‰ пипеткой отмеривают 2 мл раствора спирта, количественно переносят в мерную колбу емкостью 50 мл и разбавляют дистиллированной водой до метки. Для приготовления 2 ‰ раствора берут 10 мл 10 % раствора спирта, а для приготовления 4‰ эталонного раствора – 20 мл 10%-ного раствора спирта, дальнейшее разведение осуществляется как указано выше. Эталонные растворы хранятся в склянках из темного стекла с хорошо пришлифованными пробками при температуре +4 - +60С. При пользовании эталонными растворами следует как можно меньше оставлять их открытыми. Перед открыванием склянки с эталоном ее необходимо тщательно встряхнуть. При соблюдении этих условий стандартные растворы могут использоваться в течение 5-10 дней, практически не теряя своей концентрации. По истечении указанного срока готовятся новые эталонные растворы. Ход определения Во флаконы из-под пенициллина вносят 0,5 мл трихлоруксусной кислоты, 0,5 мл раствора пропанола, 0,5 мл раствора этилового спирта различной концентрации (0,4; 2,0; 4,0‰) и 0,5 мл исследуемой пробы. Флаконы закрывают стандартными пробками, пробки фиксируют. Содержимое флаконов перемешивают и шприцем вводят по 0,35 мл раствора нитрита натрия. Флаконы энергично встряхивают (30 маятникообразных движений) и оставляют на 1 минуту. После чего из каждого флакона шприцем путем прокола пробки отбирают 0,5 мл парогазовой фазы, которую тотчас же вводят в дозатор прибора и хроматографируют. Для получения достоверных результатов проводят три параллельных исследования. На полученных хроматограммах должны быть проставлены ФИО освидетельствуемого, номер акта медицинского освидетельствования или номер медицинской карты стационарного или амбулаторного больного, дата и время исследования. На градуировочном графике по оси абсцисс откладываются значения отношения высот пиков этилнитрита к пропилнитриту. Во избежание дробных чисел среднее значение соотношения высот пиков для каждой концентрации этанола умножают на 100 (масштаб: 1см = 0,1). По оси ординат откладывают соответствующие им значения концентрации эталонных растворов (масштаб: 1 см = 0,4 ‰.). Для расчета концентрации этилового спирта удобнее пользоваться величиной fR – фактор чувствительности, который рассчитывается по формуле:
где С – концентрация исследуемого вещества, г/л; hst – высота пика внутреннего стандарта, см; hx – высота пика исследуемого вещества, см; n – число текущих измерений; fR – постоянная величина для данной пары веществ на каждой колонке, зависящая от летучести определяемых соединений при условиях опыта. Концентрацию этилового спирта соответственно определяют по формуле:
Для вычисления концентрации этанола в исследуемых пробах необходимо полученную концентрацию умножить на коэффициенты пересчета: для крови – 0,95, для мочи – 1,05. Определение этилового алкоголя в крови и моче фотометрическим методом Сущность фотометрического метода заключается в восстановлении калия бихромата в кислой среде этанолом, ускоренно диффундирующим из объекта под действием калия карбоната. В зависимости от концентрации этанола раствор калия бихромата изменяет окраску от светло-оранжевой до темно-синей. По градации переходных оттенков фотометрированием по отношению к эталонным растворам этилового спирта и к контрольной пробе определяется концентрация этанола в исследуемых объектах. Использование трех растворов: калия бихромата в серной кислоте, калия перманганата, мета-нитробензальдегида в серной кислоте позволяет установить наличие или отсутствие этилового спирта. Каждый из указанных растворов приобретает различную окраску. При наличии этанола раствор калия бихромата изменяет окраску от светло-оранжевой до темно-синей; калия перманганата – от красно-фиолетовой до буроватой; раствор мета-нитробензальдегида не изменяет окраску. При наличии метанола раствор калия бихромата восстанавливается значительно интенсивнее, примерно в 4 раза, чем в присутствии этанола, окраска растворов калия перманганата и мета-нитробензальдегида не изменяется. При наличии пропиловых, бутиловых, амиловых спиртов окраска калия бихромата и калия перманганата изменяется примерно как и от этанола, но раствор мета-нитробензальдегида резко изменяет окраску до красной или коричневой (при концентрации менее 0,2‰). Этиловый эфир, анилин, ментол, ацетон, ацетальдегид, формальдегид вызывают другие окрашивания указанных реактивов. Пиридин, аммиак, четыреххлористый углерод, нитробензол, дихлорэтан, этиленгликоль не влияют на цвет растворов реактивов. Объекты исследования Объектами исследования являются кровь и моча. Для анализа используется по 2 мл крови и мочи (по 1 мл для идентификации и количественного определения).
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 537; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.3.17 (0.01 с.) |

 (1)
(1) (2)
(2) (3)
(3)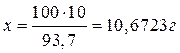

 (4)
(4) (5)
(5)


