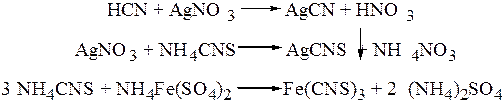Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика и анализ веществ группы «Летучие яды»Содержание книги
Поиск на нашем сайте
СИНИЛЬНАЯ КИСЛОТА Синильная кислота – бесцветная жидкость с температурой кипения 26,5°С. Плотность при температуре 20°С – 0,69 г/см3. Смешивается во всех отношениях с водой, спиртом, диэтиловым эфиром. Легко воспламеняется и горит голубоватым пламенем. Чрезвычайно слабая кислота, ее соли легко гидролизуются. Перегоняется с водяным паром в первые порции дистиллята. Граница отгонки 1 мг из 100 г биологического материала. Синильная кислота занимает первое место по своей летучести с водяным паром. Токсикологическое значение и метаболизм. Ядовитость синильной кислоты обусловлена присутствием в HCN изоцианистой кислоты, одной из таутомерных форм HCN:
Токсикологическое значение синильной кислоты и ее производных определяется ядовитостью их, с одной стороны, и сравнительно широким применением – с другой. Цианиды калия и натрия применяются в металлургии для извлечения благородных металлов из руд и в ювелирном деле, благодаря их способности образовывать легко растворимые комплексы с благородными металлами, их которых благородные металлы затем легко вытесняются цинком. Кроме того, различные производные синильной кислоты применятся в качестве компонентов при производстве фармпрепаратов, средств дезинсекции и дезинфекции, при цианидировании сталей и т.д. Выделяется при срезании монтажной пены. Источниками отравления, особенно детей, нередко становятся ядра горького миндаля, абрикоса, вишни, лавровишни и др. растений семейства Rosaceae, содержащие гликозид амигдалин, который способен в кислом растворе, а под влиянием энзима эмульсина даже в нейтральной среде, расщепляться на виноградный сахар, бензойный альдегид и синильную кислоту. Известны отравления также спиртовыми настойками, приготовленными на плодах косточковых растений сем. Rosaceae. Иногда источником отравления был и фасеолюнатин – гликозид индийских бобов (Phaseolus lunatus) дающий при гидролизе синильную кислоту и ацетон, а также линамарин – гликозид семян льна, имеющий близкое строение и являющийся причиной отравления скота при поедании льняного жмыха. Описаны случаи отравления животных манником водяным, содержащим гликозид, отщепляющий HCN. Токсикологическое значение имеет также дициан [(CN)2], хлор- и бромцианы (ClCN, BrCN), которые могут вызывать отравления в производственных условиях. Имеются сведения об образовании синильной кислоты при горении целлулоида. Следы HCN содержатся также в табачном дыме. Нормальное содержание цианидов в организме человека: ~6,7 мкг % в моче некурящих людей и 17,4 мкг % в моче курящих. Повышение нормального содержания цианидов отмечается у лиц, страдающих рассеянным склерозом. В крови цианиды могут образовываться и посмертно. Смертельной дозой чистой синильной кислоты считают 0,05 - 0,1 г; смертельная доза цианида калия 0,15 - 0,25 г. Отравление ядрами горького миндаля может наступить при поедании 40 - 60 штук, а у детей — даже 10 - 12 шт. Горькоминдальная вода (Aqua Amygdalarum amararum) может оказать токсическое и даже смертельное действие при приеме внутрь 60—100 мл. Всасывание синильной кислоты и ее солей происходит быстро из ЖКТ, через дыхательные пути, кожные покровы. Отравление синильной кислотой может происходить как молниеносно (3 -5 мин), так и замедленно. При остром молниеносном отравлении (прием синильной кислоты натощак) потерпевший непроизвольно вскрикивает, мгновенно теряет сознание, падает, изгибается дугой, затем наступает смерть. Замедленная форма отравления характеризуется болями в сердце, царапанье в горле, мышечная слабость, тошнота, рвота, пошатывание, головокружение, головная боль, покраснение слизистых оболочек, кожи лица, жгучий горький вкус во рту, металлический привкус, онемение рта и зева, слюнотечение, одышка, учащенное дыхание, тонические и тетанические судороги, паралич, остановка дыхания и сердечной деятельности. Патологоанатомическая картина при вскрытии – признаки смерти от асфиксии, вишнево-красный цвет трупных пятен, ушных раковин, губ, лица, внутренних органов, слизистой желудка. Одним из наводящих указаний при вскрытии трупов лиц, погибших от отравления синильной кислотой, является запах горького миндаля (но далеко не всегда) от внутренних органов трупа и мозга (отмечено, что при отравлениях препаратами синильной кислоты она иногда обнаруживается в желудке с содержимым, а в паренхиматозных органах при этом результаты анализа бывают негативными). В организме в тканях трупа, во внешней среде цианиды подвергаются биотрансформации несколькими путями: гидролиз; превращение в роданиды под влиянием фермента роданазы; соединение с гемоглобином крови; связывание с цистеином; присоединение к веществам, содержащим альдегидную группу;
Проведения химико-токсикологического исследования на наличие HCN проводиться в день поступления объектов в лабораторию. Качественное обнаружение. Реакция образования берлинской лазури NaOH + HCN = NaCN + Н2О; FeSO4 + 2NaCN = Fe(CN)2 + Na2SO4; Fe(CN)2 + 4NaCN = Na4[Fe(CN)6]; 3Na4[Fe(CN)6] + 2Fe2(SO4)3 = Fe4[Fe(CN)6]3 + 6Na2SO4 Реакция проводится со всем объемом первого дистиллята. Признаком наличия CN- в дистилляте служит появление синего осадка или синего окрашивания. При образовании значительного синего осадка берлинской лазури реакцию необходимо повторить с добавлением растворов FeSO4 и FeCl3 перед подкислением соляной кислотой. Заключение о качественном обнаружении (если синий осадок не выпадает тотчас) или необнаружении синильной кислоты дается лишь по истечении 24—48 часов, так как при следах синильной кислоты в присутствии органических веществ осадок берлинской лазури может выпадать медленно. Чувствительность реакции 20 мкг HCN в 1 мл раствора. Открываемый минимум 20 мкг при предельном разбавлении 1:100 000. При содержании 20—30 мкг HCN в пробе образуется соответственно зеленое или голубое окрашивание раствора, а при количествах, больших 30 мкг, выделяется характерный синий осадок берлинской лазури. Выделившийся осадок берлинской лазури может быть представлен в качестве доказательства обоснованности заключения об обнаружении синильной кислоты. Реакция образования берлинской лазури на тест – бумаге. Предел обнаружения 0,3 мкг в пробе. Реакция применима при анализе объектов, подверженных гнилостному разложению. Реакция с пиридинбензидиновым рективом. При наличии в дистилляте синильной кислоты в присутствии пиридинбензидинового реактива происходит образование полиметнового красителя. Реакция проходит в несколько стадий. Продуктом реакции первой стадии является образование бромциана, который в дальнейшем конденсируется с пиридином, образуя цианпиридин. Цианпиридин в присутствии воды разрушается до глутаконового альдегида, способного в дальнейшем конденсироваться с веществами, содержащими первичную аминогруппу (бензидин). Продукты конденсации – окрашенные соединения.
В результате реакции наблюдается образование оранжевого окрашивания, постепенно переходящего в красно-фиолетовое. Предел обнаружения синильной кислоты в исследуемой пробе составляет 0,2 мкг. Проведению реакции не мешают продукты гнилостного разложения биологического объекта. Микрокристаллоскопическая реакция образования цианида серебра. Реакция основана на образовании цианидов серебра, которые выпадают в виде кристаллов, имеющих вид длинных игл или сростков из них. Кристаллы для наблюдения под микроскопом окрашивают раствором метиленового синего, придающего им голубое окрашивание. Предел обнаружения составляет 0,1 мкг синильной кислоты в исследуемой пробе. Реакцию можно применять в присутствии продуктов гнилостного разложения объекта. Количественное определение Синильную кислоту количественно определяют методом спектроскопии в видимой области и методом аргентометрии. Спектрофотометрический метод в видимой области основан на реакции образования полиметинового красителя с помощью пиридин-бензидинового реактива. Ошибка метода находиться в пределах 5 – 6%. Аргентометрический метод. Метод используется при исследовании свежего трупного материала, содержащего синильной кислоты более чем 1 мг в 100 г биологического объекта. Он основан на взаимодействии синильной кислоты с 0,1 М (или 0,01 М при малых количествах HCN) раствором нитрата серебра. Избыток нитрата серебра оттитровывают 0,1 М (или 0,01 М) раствором роданида аммония или калия при индикаторе железоаммонийные квасцы.
При несвежем трупном материале такой способ количественного определения неприменим, таккак сероводород, содержащийся в объекте исследования, будет реагировать с нитратом серебра, образуя сульфид серебра, искажая результаты количественного определения.
В таких случаях обычно применяют весовой метод определения. Весовое определениесинильной кислоты сводится котгонке синильной кислоты из новой навески объекта исследования, собиранию дистиллятов в 2—3 приемника, содержащие 0,2% раствор нитрата серебра, отделению после подкисления азотной кислотой (не содержащей цианидов) осадка AgCN с возможной примесью Ag2S, обработке полученного осадка избытком раствора аммиака в целях отделения растворимого в нем цианида серебра от нерастворимого сульфида серебра, выделению из раствора с помощью азотной кислоты цианида серебра и определению металлического серебра после высушивания, сжигания и прокаливания фильтра с осадком. АЛКИЛГАЛОГЕНИДЫ Алкилгалогениды находят широкое применение в лакокрасочной, кожевенной, электротехнической, фармацевтической промышленности; при приготовлении полимерных материалов как пластификаторы, мономеры и сополимеры. Используются в качестве растворителей, в том числе для обезжиривания и экстрагирования жиров и эфирных масел, хладагентов, пестицидов, в органическом синтезе, при производстве каучука, резинотехнических изделий. Почти все хлорпроизводные алканов опасные яды. Максимальная смертность отмечается при отравлениях хлороформом, четырёххлористым углеродом, 1,2-дихлорэтаном. Хлороформ (трихлорметан) — бесцветная, прозрачная, подвижная и легколетучая жидкость, обладающая характерным запахом и жгучим вкусом. Температура кипения 59,5—62°. Удельный вес 1,498 при температуре 15°. Растворяется в воде в соотношении 1:200. Со спиртом, эфиром, бензином смешивается во всех отношениях. Под влиянием света, влаги, воздуха, температуры хлороформ постепенно разлагается с образованием фосгена, муравьиной и хлористоводородной кислот. На организм оказывает наркотическое действие. Четыреххлористый углерод представляет собой прозрачную, подвижную, тяжелую жидкость с удельным весом 1,594—1,600 и запахом, напоминающим запах хлороформа. Почти не растворяется в воде (растворимость 0,077 г/мл при температуре 25°), хорошо смешивается с безводным спиртом, эфиром, бензолом, бензином. Температура кипения 75,5—77,5°, [α]20D = 1,462—1,464. При нагревании с водой до 250°C происходит гидролиз: при недостатке воды образуется фосген, при избытке - углекислый газ. Дихлорэтан (1,2-дихлорэтан, хлористый этилен) - представляет собой тяжелую, бесцветную, подвижную жидкость с запахом, напоминающим запах хлороформа. Температура кипения — 83,7°, удельный вес 1,25 при температуре 20°. Растворимость его 0,922 г в 100 мл воды при 0°, 0,855 г при 10°, 0,869 г при 20°, 0,894 г при 30°. Хорошо растворяется в спирте и других органических растворителях. Весьма стоек к действию кислот и щелочей. Воспламеняется с трудом. Технический препарат всегда содержит примесь трихлорэтилена. Трихлорэтилен (1,1,2-трихлорэтан) - Бесцветная, прозрачная, подвижная, летучая жидкость со своеобразным запахом, напоминающим запах хлороформа, и сладким, жгучим вкусом. Удельный вес 1,462—1,466 г/см³ Температура кипения 86,0 – 88,0°. Практически нерастворим в воде; смешивается с органическими растворителями, не воспламеняется и не взрывается. При окислении трихлорэтилена образуется фосген. Хлоралгидрат (1,1-диокси-2,2,2-трихлорэтан) - бесцветные кристаллы с острым запахом, слегка горьковатого царапающего вкуса. Легко растворяется в воде, спирте, эфире, хлороформе. На воздухе расплывается и медленно улетучивается. Температура плавления 49—53°.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.140.108 (0.008 с.) |