Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: контроль качества лекарственных средств, производных ароматических кислот и фенолокислот. Ароматические кислоты, фенолокислоты и их соли (изучение лекарственных средств по обучающей программе).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ЦЕЛИ: Самостоятельно изучить ацетилсалициловую кислоту по тексту программированного обучения и составить конспект. Освоить методику экспресс-анализа микстуры с натрия-бензоата. Освоить методику фармакопейного количественного анализа ацетилсалициловой кислоты. Овладеть методикой анализа натрия салицилата (анализ дефектуры). Закрепить умения решать исследовательскую задачу.
1. Лекарственные средства: бензойная кислота, бензоат натрия, салициловая кислота, салицилат натрия. 2. Качественные реакции на сложноэфирную группу. 3. Метод нейтрализации – обратное титрование. 4. Расчёты.
СТУДЕНТЫ ДОЛЖНЫ ВЫПОЛНИТЬ НА ЗАНЯТИИ: 1. Ответить на вопросы тестового задания. 2. Изучить ацетилсалициловую кислоту. 3. Провести фармакопейный анализ ацетилсалициловой кислоты. 4. Решить исследовательские задачи №3-4. 5. Сдать результаты работы преподавателю и оформить протокол и журналы.
ПОСЛЕ ВЫПОЛНЕНИЯ ЗАНЯТИЯ СТУДЕНТ ДОЛЖЕН УМЕТЬ: 1. Проводить качественный и количественный фармакопейный анализ ацетилсалициловой кислоты в соответствии с программой. 2. Решать исследовательскую задачу на известный препарат.
ЛИТЕРАТУРА: 1. ГФ XI. 2. Н.Н. Глущенко, Т.В. Плетенева, В.А. Попков. Фармацевтическая химия стр. 221-229. 3. Конспект лекций
ОБУЧАЮЩАЯ ПРОГРАММА С ЭЛЕМЕНТАМИ ПРОГРАММИРОВАННОГО ОБУЧЕНИЯ НА ТЕМУ: «АРОМАТИЧЕСКИЕ КИСЛОТЫ, ФЕНОЛОКИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ»
Шаг № 1: Кислота ацетилсалициловая
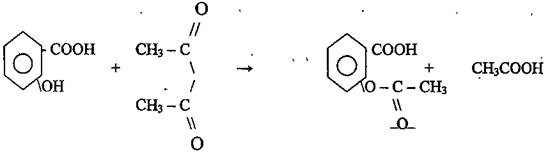
Задание № 1 Напишите формулу лекарственного средства, который является сложным эфиром, образованным салициловой кислотой (фенольный гидроксид) и уксусной кислотой. Дайте химические названия.
Проверь себя
Задание № 2
Вопрос 1: Выберите правильное основное латинское название фармпрепарата: 1. Acidum acethylsalicylicum 2. Acidi acetylsalicylicum Осторожно, ошибки! 3. Acidum acetylsalicylicum
Вопрос 2: Напишите латинский синоним фармпрепарата.
Проверь себя Ответ на 1 вопрос: Acidum acetylsalicylicum Ответ на 2 вопрос: Aspirinum
Шаг № 2: Получение
При взаимодействии салициловой кислоты с уксусным ангидридом при нагревании до 50-60°С.
Шаг № 3: Физико-химические свойства:
Задание № 3
Рассмотрите образец препарата, определите цвет и структуру порошка. Есть ли у препарата запах, вкус? Проверьте растворимость в воде, спирте, растворе гидроксида натрия, взяв по 0,1 препарата и 1 мл растворителя. Проверь себя: бесцветные кристаллы или белый кристаллический порошок без запаха, или со слабым запахом, слабокислого вкуса, препарат устойчив в сухом воздухе, во влажном постепенно гидролизуется с образованием уксусной и салициловой кислоты. Мало растворим в воде, легко растворим в спирте, растворим в хлороформе, эфире, растворах едких и углекислых щелочей.
Задание № 4 Вопрос 1: Объясните, почему препарат неустойчив во влажном воздухе? Подтвердите соответствующими уравнениями реакций. Вопрос 2: Почему препарат растворим в едких и углекислых щелочах?
Проверь себя и запиши
Ответ на 1 вопрос: препарат является сложным эфиром, образован двумя органическими кислотами, поэтому является непрочным. Легко гидролизуется при действии влаги воздуха.
Ответ на 2 вопрос: Препарат растворим в растворах едких и углекислых щелочей, т.к. обладает кислотными свойствами за счёт свободной карбоксильной группы. Шаг № 4: Подлинность
Задание № 5 (демонстрационный опыт)
0,5 препарата прокипятите в течение трёх минут в 5 мл раствора гидроксида натрия, в вытяжном шкафу. Что при этом наблюдается? После охлаждения подкислите раствор серной кислотой. Что наблюдается? Почему? Раствор слейте в другую пробирку, добавьте к нему 2 мл этанола и 2 мл концентрированной серной кислоты. Что ощущается? К осадку добавьте 2 капли раствора хлорида железа III. Что появляется? Почему? (демонстрационно). Напишите методику выполнения испытания, наблюдения и уравнения реакций.
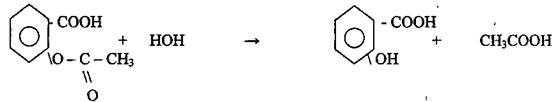
Проверь себя При нагревании с раствором гидроксида натрия препарат, как сложный эфир гидролизуется с образованием:
При добавлении серной кислоты выпадает в осадок салициловая кислота (серная кислота, минеральная, вытесняет более слабую органическую кислоту из её соли).
Наличие салициловой кислоты подтверждается по фиолетовому окрашиванию с раствором хлорида железа III (реакция на фенольный гидроксид). Наличие уксусной кислоты подтверждается по реакции образования уксусно-этилового эфира.
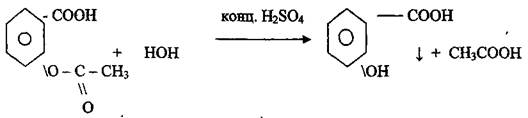
Задание № 6 0,2 препарата поместите в фарфоровую чашку, добавьте 0,5 мл концентрированной серной кислоты, перемешайте стеклянной палочкой, добавьте 1 каплю воды. Что ощущается? Добавьте 2 капли раствора формальдегида. Что появляется? Напишите методику выполнения испытания, наблюдения, уравнения реакции.
Проверь себя
В присутствии концентрированной серной кислоты происходит кислотный гидролиз, образуется салициловая кислота и уксусная, последнюю определяют по запаху.
Салициловая кислота (фенолокислота) с раствором формальдегида (альдегида) образует продукт конденсации розового цвета. Определяют температуру плавления =133-138 °С.
Шаг № 5: Чистота
хлориды, сульфаты, органические примеси в пределах эталонного раствора определяют свободную салициловую кислоту сульфатную золу и тяжёлые металлы
1. Каким методом количественно определяют фармпрепарат? Почему? 2. Вариант, какого титрования? 3. На чём основан? 4. Что следует взять в качестве растворителя, индикатора, титрованного раствора? 5. До какого окрашивания следует титровать и почему? 6. Чему равен f эквивалентности и молярная масса эквивалента.
Проверь себя Метод алкалиметрии. Расчёт прямого титрования. Определение основано на кислотных свойствах препарата за счёт наличия свободной карбоксильной группы. Методика: Т.н. препарата растворяют в нейтрализованном по фенолфталеину спирте, охлаждают при температуре 8-10°С и титруют 0,1н раствором гидроксида натрия с тем же индикатором до слабо-розового окрашивания. Индикатор меняет окраску при рН 8,2-10,0.
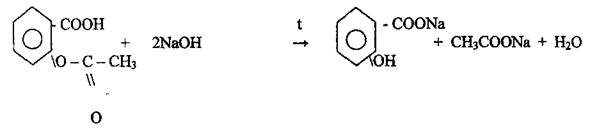
Натриевая соль ацетилсалициловой кислоты
Задание № 7 Объясните, почему титрование надо вести при охлаждении до 8-10°С?
Проверь себя и напиши
Охлаждают до температуры 8-10°С для предотвращения гидролиза препарата, как сложного эфира. f эквивалентности и молярная масса эквивалента = М, т.к. 1 молекула препарата взаимодействует с 1 эквивалентом гидроксида натрия.
Шаг № 7: Применение
Противоревматическое, противовоспалительное, болеутоляющее, жаропонижающее средство в виде порошков и таблеток. Задание № 3 Решить исследовательскую задачу. Определите концентрацию кислоты салициловой в мази. Методика: 0,1 г препарата (мази) помещают в колбу для титрования, добавляют 2 мл спирта, взбалтываем до растворения основы и препарата. Затем прибавляют 2 мл воды, 6-7 капель фенолфталеина и титруют при взбалтывании 0,1н раствором гидроксида натрия до розоватого окрашивания водного слоя. 1 мл 0,1н гидроксида натрия соответствует 0,01381 г салициловой кислоты.
Задание №4
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1870; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.26.8 (0.007 с.) |