Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Условия равновесия и устойчивости термодинамических систем: равновесие трехфазной системы. Правило фаз Гиббса. Фазовые переходы 1-го рода. Уравнение Клапейрона-Клаузиуса. Фазовая диаграмма состояния.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Равновесие трехфазной системы. 1) Каждая из фаз должна находиться в состоянии равновесия. 2) Для каждой пары фаз должно соблюдаться условие равновесия:
Очевидно, что для трехфазной системы равновесие может быть в одной точке. Подобные точки называются тройными точками. Однокомпонентные системы не могут существовать в более чем трех фазах. Точка, где существуют твердая, жидкая и парообразная фаза называется основной тройной точкой. Она также является важной характеристикой. Правило фаз Гиббса. Гиббс вывод частной распространил на системы многофазную многокомпонентную. Пусть мы имеем систему, состоящую из Ф фаз и К компонентов.
Аргументов Уравнений
Число степеней свободы:
Фазовые переходы 1-ого рода. Фаза – гомогенная область в гетерогенной системе ограниченная поверхностью раздела. Фазовый переход первого рода: переход вещества из одной фазы в другую. Фазовый переход 1-ого рода – такой переход, когда первые производные от энергии Гиббса имеют скачок. Фазовый переход – это мирное существование двух фаз. T,P=const.
То есть фазовый переход всегда характеризуется теплотой фазового перехода.
Тогда продифференцируем и получаем:
ps и Ts – температура и давление насыщения.
Фазовая диаграмма состояния. В области фазовой диаграммы проводятся кривые фазового равновесия. Кривая фазового равновесия называется кривая соответствующая равновесию двух фаз.
Фазовая диаграмма — термодинамическая диаграмма, в которой по осям координат откладываются физические параметры (давление и температура, давление и удельнй объём и т.д.) и наносятся кривые фазового равновесия. Диаграмма состояния (фазовая диаграмма) - диаграмма, изображающая зависимость устойчивого фазового состояния одно- или многокомпонентного вещества от термодинамич. параметров, определяющих это состояние (температуры T, давления P). Каждая точка фазовой диаграммы указывает на фазовый состав вещества при заданных значениях термодинамич. параметров. В зависимости от числа внеш. параметров фазовая диаграмма может быть двумерной, трёхмерной и многомерной.
Фазовые диаграммы однокомпонентных систем изображаются на плоскости в координатах p–T. На них присутствуют поля, отвечающие существованию той или иной фазы вещества (газообразной, жидкой, различных твердых модификаций), разделенные линиями фазового равновесия, вдоль которых возможно сосуществование граничащих фаз. Места, где сходятся три различные линии фазовых равновесий, образуют так называемые тройные точки, в которых могут сосуществовать три фазы. Это максимальное число фаз, способных равновесно сосуществовать в однокомпонентных системах. Кривая фазового равновесия — кривая, соответствующая равновесному состоянию фаз. рϑ-диаграмма реальной ТС Её особенностью является (как и 2 следующих диаграмм) изображение области 2-фазного равновесного состояния в виде площадей, ограниченных пограничными кривыми
На pv - диаграмме представлены (рис. 2.3, а): - р, v - давление Па, удельный объем м3/кг; - vo - удельный объем воды при t = 0 oC; - - удельный объем воды при ts и pi = const; - - удельный объем сухого насыщенного пара при ts и pi = const; - - удельный объем влажного пара, соответствующего состоянию в точке Аi, - хАi - степень сухости пара, соответствующая состоянию пара в точке Аi;
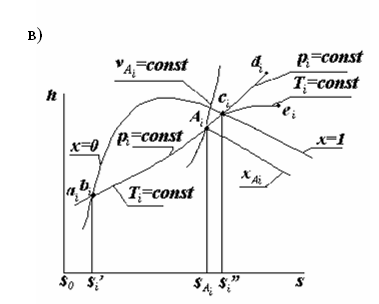
hs-диаграмма реальной ТС
На Ts- и hs - диаграммах представлены (Рис. 2.3, б и 2.3, в): - T – температура К; h – удельная энтальпия, Дж/кг; s - удельная энтропия Дж/(кгּК); - h’i – удельная энтальпия воды при ts и при давлении pi; - h’’i – удельная энтальпия сухого насыщенного пара при ts и при давлении pi; - so - удельная энтропия воды при температуре 0оС и при давлении pi t; - - удельная энтропия воды при ts и при давлении pit; - - удельная энтропия сухого насыщенного пара при ts и при давлении p; - sA=- удельная энтальпия влажного пара, соответствующая состоянию в точке Ai, - - удельная энтропия влажного пара, соответствующего состоянию в точке Аi.
Диаграммы состояния используют в материаловедении, металлургии, нефтепереработке, химической технологии (в частности, при разработке методов разделения веществ), производствах электронной техники и микроэлектроники и др. С их помощью подбирают условия промышленного синтеза веществ, определяют направленность процессов, связанных с фазовыми переходами, осуществляют выбор режимов термообработки, отыскивают оптимальные составы фаз и т. п.
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 530; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.255.135 (0.011 с.) |




 .
. .
. .
. .
. - Правило фаз Гиббса.
- Правило фаз Гиббса.








 - уравнение Клайперона-Клаузиуса.
- уравнение Клайперона-Клаузиуса.