Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
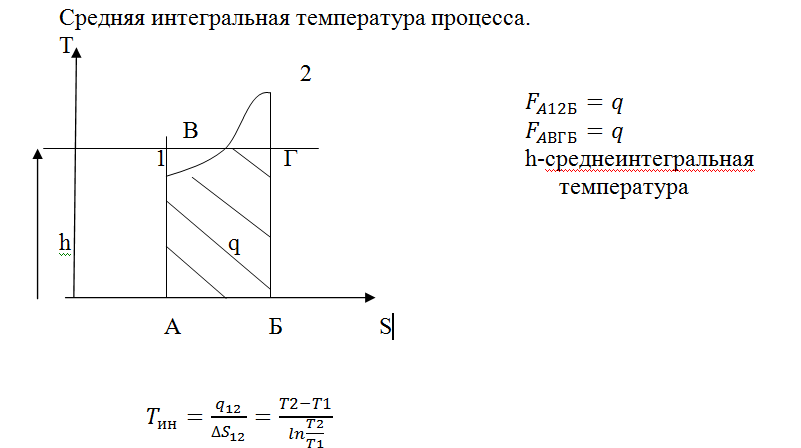
Термодинамические процессы идеального газа. Методика исследования основных процессов. Группы процессов в pv- и Ts- диаграммах. Средняя интегральная температура подвода теплоты процесса.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Методика исследования: из уравнения состояния и аналитического выражения первого закона термодинамики для закрытых ТС, с учетом особенностей процесса, выводится уравнение сосояния; связь между другими термическими параметрами выявляется из совместного рассмотрения уравнения процесса и уравнения состояния идеального газа; линия процесса в термодинамических диаграммах строится с помощью известных приемов аналитической геометрии, прежде всего, на основании производных dp/dv, dT/ds, определенных для соответствующих функций, характеризующих конкретный процесс; изменение внутренней энергии и энтальпии определяется из (1.78), (1.81), интегрирование которых, с учетом допущения c= const, дает для всех процессов Δu = cv(T2 – T1); Δh = cp(T2 – T1). (1.119) Аналогично, во всех процессах изменение энтропии ТС в процессе может быть определено по соотношению (1.51), если известна теплоемкость процесса, иначе, в зависимости от пары независимых переменных ис-пользуются формулы (1.84), (1.86) и (1.88); теплота процесса определяется интегрированием (1.18) q = cx(T2 – T1), (1.120) а в случае учета влияния темпе-ратуры на теплоемкость, по формуле (1.24); работа процесса определяется из соотношений (1.13), (1.15), ин-тегрирование которых осущест-вляется с учетом особенностей процесса; доля теплоты, затрачиваемой на изменение внутренней энергии ТС в процессе, определяется ко-эффициентом ϕ ϕ = du/dq = Δu/q = сv/cx. (1.121) проверка правильности расчетов осуществляется с помощью балансов энергии ТС в процессе, представленных аналитическими выражениями первого закона термодинамики
Среднеинтегральная температура не зависит от процесса, а только от начальной и конечной температуры. 28. Термодинамика идеального газа. Смеси идеальных газов. Общие положения. Закон Дальтона. Способы задания смеси. Газовая постоянная, кажущаяся молярная масса, плотность, теплоемкость, внутренняя энергия, энтальпия, энтропия газовой смеси. Энтропия смешения.
В ТС редко приходится иметь дело с чистыми веществами. Чаще всего встречаются смеси веществ (Воздух состоит из О2, N2, CO2, Н2О и т.д.). Если между компонентами смеси отсутствуют химические реакции, то такая газовая смесь подчиняется основным законам и уравнениям состояния. При выполнении условия ϑ→∞, смесь подчиняется законам идеального газа.
Закон дальтона: давление смеси идеальных газов равно сумме парциальных давлений компонентов смеси. рсм = ∑рi Парциальное давление — давление, которые имел бы газ данной газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре. Каждый компонент смеси идеальных газов занимает весь объём системы, независимо от наличия и числа других компонентов, и оказывает на стенки ТС давление, не зависящее от других газов, образующих смесь. piVсм = miRiTсм Способы задания смеси. Состав смеси может быть задан 3 способами: массой, объёмной или мольной концентрациями. Концентрация — величина, характеризующая относительное содержание данного компонента в многокомпонентной термодинамической системе. Измеряется в долях либо процентах. Массовая концентрация — отношение массы компонента к массе смеси. gi = mi/mсм Объёмная концентрация — отношение парциального объёма смеси ко всему объёму смеси
ri = Vi/Vсм pсмVi = miRiTсм pi/pсм = Vi/Vсм ri = Vi/Vсм = pi/pсм pi = pсм ri
Мольная концентрация — отношение числа молей компонента к общему числу молей многокомпонентной ТС. Объёмная и мольная концентрации обозначаются одинаково, так как равны между собой.
ri = pi/pсм i = Vi/Vсм = ϑμiNi/ϑμсмNсм = Ni/Nсм Объём одного моля не зависит от хим. состава газа и для различных веществ при различных температурах и давлениях одинаков.
Газовая постоянная смеси и молярная масса смеси: Rсм = ∑ giRi; Rсм = ∑ ri/Ri; Молярная масса — численное выражение отношения средней массы молекулы вещества к 1/16 части средней массы атома природного кислорода, принятой за единицу атомной массы. μсм = ∑ riμi; плотность смеси: ρсм = ∑ ρi; теплоемкость смеси: ссм = ∑ giсi; ссм = ∑ riсi; внутренняя энергия смеси: uсм = ∑ giui; энтальпия смеси: hсм = ∑ gihi; энтропия газовой смеси: энтропия идеальной газовой смеси определяют как сумму энтропий компонентов, взятых при температуре смеси и давлениях, равных их парциальным давлениям в смеси. Энтропия смешения. ∆sсм = – Rсм ∑ ri ln ri — энтропия смешения для смеси 2 газов. Чем она больше, тем более необратим процесс смешения. Зависит от состава смеси, не зависит от температуры и давления. ∆sсм/Rсм зависит от количественных пропорций компонентов смеси и не зависит от их природы.
Первый закон термодинамики. Виды энергии. Теплота и работа – формы передачи энергии. Балансы энергии и теплоты технической системы. Абсолютные и относительные характеристики технической системы на базе балансовых уравнений 1-го закона.
Первый закон термодинамики – закон сохранения и превра-щения энергии для термодинамиче-ских систем и процессов
Ана-литически это можно записатьW = const, или W1 – W2 = 0, где W1, W2 – соответственно в начальном и конечном состояниях энергия рассматриваемой изолиро-ванной ТС. Из сказанного вытекает форму-лировка первого закона термодина-мики: невозможны уничтожение и возникновение энергии. Для закрытой, адиабатной ТС, изменение энергии системы опре-деляется величиной работы L, ко-торой она обменивается с окруже-нием в неком термодинамическом процессе изменения состояния W1 – W2 = L. Для закрытой ТС, которая мо-жет обмениваться энергией с окру-жением только в форме теплоты Q, изменение энергии в ходе некоего термодинамического процесса мо-жет быть определено W1 – W2 = - Q. Для закрытой ТС, изменяющей свое состояние в процессе 1 – 2, в общем случае имеет место соотно-шение W1 – W2 = L – Q. (1.29) Теплота и работа являются единственно возможными форма-ми передачи энергии от одних тел к другим – еще одна формулировка первого закона термодинамики для закрытых ТС. Если закрытая ТС совершает круговой термодинамический про-цесс, то после его завершения все параметры системы принимают на-чальное значение, что позволяет последнее равенство записать в ви-де 0=L-Q Из этого следует наиболее по-пулярная формулировка первого за-кона термодинамики: вечный дви-гатель первого рода невозможен. Виды энергии: внутренняя (U), химическая, ядерная, кинетическая. В ряде случаев удобно разделять энергию по при-знаку количественного превраще-ния одного вида энергии в другие. Энергия, которая полностью может быть превращена из одного вида в любой другой, относится к, так на-зываемому, первому виду. Если же, по тем или иным причинам, пре-вращение в какой-либо другой вид энергии полностью невозможно ее относят к, так называемому, второ-му виду. Энергия ТС в общем случае мо-жет быть определена W = Wпот + Wкин + U Единицей измерения энергии в системе физических единиц СИ яв-ляется 1 Дж (Джоуль). При исполь-зовании иных систем приходится иметь дело с другими единицами измерения энергии: калория, эрг, килограммометр и др.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 822; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.008 с.) |