
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В результате реакции, термохимическое уравнение которойСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж выделилось 652,5 кДж теплоты. Определите массу сгоревшего ацетилена. Решение 1) Установим пропорциональные отношения между количеством вещества ацетилена и количеством теплоты.
По уравнению 2 моль C2H2 ---------- 2610 кДж
По условию х моль ---------- 652,5 кДж
Решаем пропорцию х=(2 * 652,5):2610 2) Определяем массу ацетилена по формуле m= n * M
m = 0,5 моль * 26 г/моль = 13 г. Ответ: масса сгоревшего ацетилена 13 г.
В результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое уравнение этой реакции. Решение 1. Запишем уравнение реакции горения метана в общем виде CH4 + 2O2 = CO2 +2H2O + Q
2. Определим количество 48 г метана
ν = m / M
ν(CH4) = 48г: 16 г/моль = 3 моль
3. Составляем пропорцию с учетом коэффициентов в уравнении реакции
По условию 3моль CH4 - 2406 кДж
По уравнению 1 моль CH4 - Q
Решаем пропорцию Q=(1*2406):3=802кДж
Ответ: термохимическое уравнение реакции горения метана CH4+ 2O2 = CO2 +2H2O + 802 кДж
6. Рассчитайте тепловой эффект реакции: 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж), если ΔH0обр NH3(г) и H2O(ж) равны соответственно -286 и -46 кДж/моль. Решение 1. O2 и N2 – простые вещества, следовательно тепловой эффект образования их равен нулю. 2. Согласно следствию из закона Гесса, тепловой эффект реакции равен разности между суммами теплот образования продуктов реакции и теплот образования исходных веществ с учетом стехиометрических коэффициентов: ΔH0 = 6·(-286) – 4·(-46)=-1532 кДж. 2. Термохимическое уравнение будет иметь вид 3. 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж)+1532 кДж Ответ: в результате данной реакции выделится 1532 кДж.
Определить тепловой эффект реакции гидролиза нитрида магния Mg3N2(тв.) + 6H2O(ж.) = 3Mg(OH)2(тв.) + 2NH3(г.). Решение DH = DHобр.прод. – DHобр.исх. Используя справочные данные, находим теплоты образования продуктов и исходных веществ: DH обр. (Mg3N2(тв.)) = –461,5 кДж/моль; DH обр. (Mg(OH)2(тв.)) = –924,66 кДж/моль; DH обр. (H2O(ж.) = –285,77 кДж/моль; DH обр. (NH3(г.) = –46,19 кДж/моль; Отсюда DH0 = [3×(–924,66) + 2×(–46,19)] – [–461,5 + 6×(–285,77)] == –689,86 кДж/моль.
8. Вычислить стандартную энтальпию реакции: 2C2H5OH(жидк.) = C2H5OC2H5(жидк.) + H2O(жидк.) по значениям стандартных энтальпий сгорания веществ: DH0сгор. C2H5OH = -1368 кДж/моль; DH0сгор. C2H5OC2H5 = -2727 кДж/моль. Решение Запишем выражение второго следствия из закона Гесса с учетом того, что стандартная энтальпия сгорания воды равна нулю:
Подставим значения стандартных энтальпий сгорания веществ, участвующих в реакции: Ответ:
При сгорании некоторого количества газообразного углеводорода образовалось 4,48 л оксида углерода (IV) (н.у.) и 3,6 г воды и выделилось 137,5 кДж теплоты. Определите теплоту сгорания углеводорода, если известно, что его плотность по воздуху равна 1,448. Решение 1) Определяем простейшую формулу сгоревшего углеводорода: С х Н у + О2 → х СО2 + 0,5у Н2О ν(СО2) = 4,48 / 22,4 = 0,2 моль; ν(Н2О) = 3,6/ 18 = 0,2 моль. ν(С) = 0,2 моль; ν(Н) = 0,2 · 2 = 0,4 моль. х: у = 0,2: 0,4 = 1: 2. Простейшая формула углеводорода СН2. 2) Рассчитываем молярную массу и определяем молекулярную формулу углеводорода: М(С х Н у) = Dвоздух · 29 = 1,448 · 29 = 42 г/моль. М(фрагмента СН2) = 14 г/моль Молекулярная формула углеводорода (СН2) n: n = М(СхНу) / М(фрагмента СН2) = 42 / 14 = 3. Углеводород (СН2)3 или С3Н6. 3) Записываем термохимическое уравнение реакции горения углеводорода и определяем теплоту сгорания: С3Н6(газ) + 4,5 О2(газ) → 3 СО2(газ) + 3 Н2О(ж) + Q(сгорания) ν(С3Н6) =ν(СО2) / 3 = 0,2 / 3 = 0,0667 моль. Q(сгорания С2Н6) = Q / ν(С2Н6) = 137,5 / 0,0667 = 2061 кДж/моль. Ответ: Q(сгорания С2Н6) = 2061 кДж/моль.
При сжигании 9 г органического вещества образовалось 13,2 г оксида углерода(IV) и 5,4 г воды и выделилось 140 кДж теплоты. Определите молекулярную формулу вещества, если его теплота сгорания равна 2800 кДж/моль. Решение 1) Судя по продуктам сгорания исходное вещество содержало углерод, водород и,возможно, кислород. Рассчитываем количества образовавшихся веществ, и записываем схему горения: ν(СО2) = 13,2 / 44 = 0,3 моль. ν(Н2О) = 5,4 / 18 = 0,3 моль. С х Н у О z + О2 →СО2 + Н2О 2) Рассчитываем количества веществ элементов, входящих в состав исходного вещества и определяем его простейшую формулу: ν(С) = ν(СО2) = 0,3 моль. ν(Н) = 2 · ν(Н2О) = 0,3 · 2 = 0,6 моль. m(O) = m(вещества) – m(С) – m(Н) = 9 – 0,3 · 12 – 0,6 · 1 = 4,8 г. ν(О) = 4,8 / 16 = 0,3 моль. х: у: z = 0,3: 0,6: 0,3 = 1: 2: 1. Простейшая формула вещества СН2О. 3) Определяем молярную массу вещества и его молекулярную формулу: ν(исходного вещества) = Q(выделившееся при сгорании взятого количества): Q(сгорания) = 140 / 2800 = 0,05 моль. М(исходного вещества) = 9 / 0,05 = 180 г/моль. Молекулярная формула (СН2О) n; n = 180 / 30 = 6. С6Н12О6. Ответ: С6Н12О6. Ø ТЕСТЫ ПО ТЕМЕ: «ОСНОВЫ ТЕРМОХИМИИ. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ».
Тест 1 1. При стандартных условиях теплота образования равна 0 для: а) водорода; б) воды; в) пероксида водорода; г) алюминия. 2. Реакция, уравнение которой N2 + O2 = 2NO – Q, относится к реакциям: а) эндотермического соединения; б) экзотермического соединения; в) эндотермического разложения; г) экзотермического разложения.
|
||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 3260; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.022 с.) |

 = 2×
= 2× 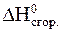 C2H5OH -
C2H5OH - 


