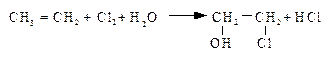Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая переработка углеводородных газов и газоконденсатов, состояние и перспективы развития в России и за рубежомСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ХИМИЧЕСКАЯ ПЕРЕРАБОТКА УГЛЕВОДОРОДНЫХ ГАЗОВ И ГАЗОКОНДЕНСАТОВ, СОСТОЯНИЕ И ПЕРСПЕКТИВЫ РАЗВИТИЯ В РОССИИ И ЗА РУБЕЖОМ Россия является мощной газовой державой, располагающей огромными запасами природного газа и газоконденсата. Запасы природного газа составляют 40 трлн. куб. м., а разведанность неосвоенных сырьевых ресурсов (НСР) - 24,6%. Всего на территории Российской Федерации и других стран СНГ сосредоточено около 40% всех мировых запасов природного газа, в то время как на долю США приходится 6-7%, стран Западной Европы 5-6% и Ирана 14%. В настоящее время использование полезных компонентов газа в нашей стране не отвечает потенциальным возможностям сырьевой базы и не соответствует мировой практике. За 25 лет запасы конденсата возросли в 100 раз, а добыча держится в диапазоне 3-6 млн. т. в год. За рубежом действует более 1500 заводов по переработке природного и попутного нефтяного газа и газовых конденсатов, на которых ежегодно вырабатывается более 160 млн. т продукции, в т.ч. 21 млн. т этана, около 18 млн. т пропана и 14 млн. т бутанов. При этом наблюдается устойчивая тенденция увеличения производства указанных продуктов и их использования в качестве химического сырья. Газохимическая промышленность России не соответствует мировому уровню. Для преодоления отставания необходимо в первую очередь решить задачи: Œ Более полное использование ресурсов попутного газа, как наиболее эффективного вида сырья для нефтехимии, а значительная часть этого сырья в настоящее время сжигается на факелах. Решение проблемы транспортировки широкой фракции углеводородов (ШФЛУ), в том числе для незагруженных мощностей на нефтехимических комбинатах. Ž Оценка потребностей в газовом сырье для производства крупнотоннажных нефтехимических продуктов: олефинов, ароматики, метанола, сажи, мономеров для производства синтетических каучуков и других полимерных материалов. Анализ возможностей использования газовых ресурсов для производства моторных топлив. Многолетний опыт ряда стран, имеющих аналогичные по масштабам с Россией мощности газодобывающих предприятий (например, США и Канада) показал высокую эффективность базирования нефтехимической и химической промышленности на легких промысловых углеводородах: этане, пропане, бутане. Практически все крупные нефтегазовые компании применили такую схему переработки природного газа – извлечение этана и пропана, пиролиз легких углеводородов, производство химических продуктов и синтетических полимеров на базе газового сырья. В России предполагается значительное расширение использования природного газа.
ПРОЦЕССЫ ХИМИЧЕСКОЙ ПЕРЕРАБОТКИ УГЛЕВОДОРОДНЫХ ГАЗОВ, РЕАЛИЗОВАННЫЕ В ПРОМЫШЛЕННОСТИ. ПЕРСПЕКТИВНЫЕ НАПРАВЛЕНИЯ ХИМИЧЕСКОЙ ПЕРЕРАБОТКИ УГЛЕВОДОРОДНЫХ ГАЗОВ В настоящее время на базе природного газа (метана) создана разветвленная группа химических производств, называемая «Химия С1». Среди крупнотоннажных продуктов - метанол, аммиак, а также ацетилен, галогенпроизводные метана. В свою очередь, на базе аммиака, метанола, ацетилена производятся десятки химических продуктов, таких как карбамид, формальдегид, карбамидно-формальдегидные смолы, высокооктановый компонент бензинов - метилтретбутиловый эфир (МТБЭ), меламин и смолы на его основе, азотные удобрения и др. В основе синтеза большинства продуктов на базе метана лежит реакция взаимодействия метана с кислородом или водяным паром, в результате которой получается синтез-газ - смесь оксида углерода и водорода в различных пропорциях.
Это направление химической переработки метана является наиболее масштабным в настоящее время. На основе синтез-газа возможно получение практически всех крупнотоннажных химических продуктов. Важное преимущество процессов на основе синтез-газа состоит в том, что он может быть легко переработан в более удобный для транспортировки метанол, который при необходимости на месте его потребления можно полностью вновь превратить в синтез-газ или другие химические продукты. Большой интерес представляют также направления переработки низших ненасыщенных углеводородов, получаемых при пиролизе или дегидрировании углеводородов природных газов, в полимерные материалы: полиолефины и пластмассы на их основе, синтетические каучуки. Широкие возможности открываются перед использованием этансодержащего газа. Это получение полиэтилена, этиленгликоля, винилацетата и стирола и полимеров на их основе. ШФЛУ может с успехом заменить прямогонные бензиновые фракции НПЗ на установках пиролиза.
ПОЛУЧЕНИЕ ИЗОПРЕНА Изопрен (2-метил-1,3-бутадиен) – это легковоспламеняющаяся бесцветная жидкость с характерным запахом, нерастворима в воде, но растворима в органических растворителях. Формула изопрена:
Изопрен является мономером для получения стереорегулярного цис -полиизопренового каучука, почти не уступающего по свойствам натуральному каучуку. Некоторые количества изопрена используются для производства бутилкаучука и многих резинотехнических изделий. Синтез изопрена может быть осуществлен разнообразными методами. Промышленное применение получили следующие методы: Œ Дегидрирование изопентана и изопентенов. Синтез из 2-метилпропена (изобутилена) и формальдегида. Ž Синтез из пропилена. Синтез из ацетона и ацетилена.
¯ Дегидрирование изопентана и изопентенов. Процесс состоит из 2 стадий: Ø Пентан изомеризуется в изопентан по схеме:
Ø Дегидрирование изопентана:
Очистка изопрена осуществляется ректификацией.
¯ Синтез из изобутилена и формальдегида. Процесс состоит из 3 стадий: Ø Конденсация в присутствии серной кислоты с образованием 4,4-диметил-1,3-диоксана:
Ø Каталитическое расщипление:
Ø Из побочного продукта (3-метилбутандиола-1,3) в тех же условиях образуется изопрен:
¯ Синтез из пропилена. Синтез состоит из 3 стадий: Ø Пропилен димеризуется в 2-метил-1-пентен:
Ø Изомеризация в 2-метил-2-пентен:
Ø Деметанизация:
¯ Синтез из ацетона и ацетилена. Так же состоит из 3 стадий: Ø Конденсация ацетилена и ацетона с образованием метилбутинола:
Ø Гидрирование метилбутинола в метилбутенол:
Ø Дегидратация метилбутенола:
Очистка сажи В процессе производства сажи в нее могут попадать посторонние включения различного происхождения: окалина от металлического оборудования, футеровка реакторов и газоходов, частицы углерода. Размеры этих включений изменяются от долей миллиметра до нескольких миллиметров. Применение сажи с посторонними включениями значительно ухудшает свойства резинотехнических изделий. Существуют различные способы очистки сажи, но одни из них малопроизводительны (просеивание через сито), при других улавливаются только металлические включения (магнитные ловушки). В настоящее время для очистки используются: Инерционный сепаратор, который устанавливается на системе пневмотранспорта. Саже-воздушная смесь под давлением со скоростью 20—30 м/с поступает в сепаратор. Вследствие инерционных сил трения скорость потока резко уменьшается на отбойных лопатках, крупные частицы осаждаются, а затем выводятся из аппарата. Производительность аппарата до 2000 кг/час. Отвеивательные аппараты. Принцип их действия следующий: сажа падает на колесо и отбрасывается лопатками к периферии камеры. Воздушный поток подхватывает взвешенные частицы сажи и направляет их в систему отделения сажи от воздуха. Посторонние включения не захватываются воздухом и осаждаются в бункерной части.
ПРИМЕНЕНИЕ САЖИ Сажа находит в настоящее время широкое применение в различных отраслях промышленности. В общем виде потребителей можно условно разделить на производителей резиновых и нерезиновых изделий. Основным потребителем резины является шинное производство, затем производство резинотехнических изделий, обуви, резиновых плиток для настила полов, резиновых съёмных матов для покрытия теннисных кортов и т. д. Свыше 90% всего потребления сажи приходится на резиновую промышленность, причем 80% всей сажи поглощает шинная промышленность. Области применения сажи вне резиновой промышленности очень многочисленны. Ее используют в производстве различных сортов бумаги (копировальной, альбомной, фотографической, для обоев и т.д.). Сажа применяется для изготовления лент для пишущих машинок, штемпельной краски, крема для обуви, парфюмерных и гримировальных красок, туши. Сажа необходима для изготовления разных сортов лаков, в том числе в довольно крупном производстве специальных автомобильных лаков, обеспечивая глубину черного цвета. Сажа используется в качестве пигмента при производстве чернил, в химической и цементной промышленности, в сельском хозяйстве — для производства удобрении и инсектофунгицидов, в дорожной строительстве — для устранения отблеска дорожных покрытий и взлетно-посадочных площадок на аэродромах, в производстве пластмасс для изготовления грампластинок, телефонных аппаратов, изделий из эбонита. В электропромышленности сажу применяют для изготовления различных электродов, сухих элементов, радиоламп, щеток и сопротивлений, ее используют в оптическом и электронном производстве, для печатных схем электроприборов и аппаратов, для производства линолеума, взрывчатых веществ, искусственного волокна. Сажа является прекрасным теплоизолирующим материалом, применяется для создания дождевых облаков, кондиционных почв и получения синтетических алмазов.
ПРОИЗВОДСТВО ПОЛИПРОПИЛЕНА Процесс производства полипропилена имеет много общего с полимеризацией этилена при низком давлении, но имеет и некоторые особенности. В зависимости от используемой каталитической системы могут получаться полимеры регулярного или нерегулярного строения с большей или меньшей степенью кристалличности. В общем виде полимеризация пропилена протекает по схеме:
Полимеризацию пропилена проводят при температуре 65— 70° С и давлении 10—12 атм. В качестве сырья можно применять высококонцентрированный пропилен (99%) или пропан-пропиленовую фракцию (30% пропилена). В последнем случае растворителем служит пропан. При полимеризации пропилена выделяется значительно меньшее количество тепла, чем при полимеризации этилена, что позволяет ограничиться отводом тепла только через рубашку реактора, хотя частично тепло может отводиться и за счет испарения растворителя, его конденсации и возвращения в процесс. Конверсия пропилена составляет 98%. В остальном процесс полимеризации пропилена идентичен процессу полимеризации этилена на катализаторе Циглера. Полипропилен по многим свойствам близок к полиэтилену, но ему присущи и свои специфические свойства. Так, благодаря разветвлению макромолекул, полипропилен при высокой степени кристалличности (80—90%) имеет невысокую плотность (0,90—0,92 г/см3). Поэтому изделия из него механически более прочные, чем из полиэтилена, но значительно легче. При обычных температурах полипропилен более эластичен, чем полиэтилен; он более термостоек, но имеет низкую морозостойкость. Стойкость к окислению у полипропилена значительно ниже, чем у полиэтилена, что объясняется наличием в макромолекуле большого количества третичных атомов углерода. Поэтому для полипропилена необходимо применение антиоксидантов. Сочетание в полипропилене высокой эластичности с низкой плотностью и хорошими механическими свойствами делает его ценным сырьем для получения синтетического волокна, которое превосходит полиамидные волокна по химической стойкости и не уступает им по прочности. Кроме того, полипропиленовое волокно в 9 раз дешевле полиамидных волокон.
КАУЧУКИ ОБЩЕГО НАЗНАЧЕНИЯ Их производство составляет 80% от общего производства. Они используются для производства шин, резино-технических изделий и др. К ним относятся: Ø Бутадиен-стирольный каучук. Применяют для изготовления резино-технических изделий, кабельных изделий, резиновой обуви, спортивного инвентаря, детских игрушек, для упаковки пищевых продуктов. Получают его по реакции:
Ø Бутадиен-
-
Ø Стереорегулярные каучуки на основе бутадиена и изопрена (получают в присутствии стереоспецифических катализаторов), натрий-бутадиеновый каучук (получают блочной полимеризацией в присутствии металлического натрия).
ПРОИЗВОДСТВО МЕТАНОЛА
Метанол является ценным крупнотоннажным продуктом, находящим широкое применение в различных отраслях промышленности. Объем потребления метанола в мире непрерывно возрастает. В настоящее время его мировое производство превышает 20 млн. т/год. Традиционным потребителем метанола является производство формальдегида (в первую очередь, его водного раствора - формалина), который получают окислительной конверсией метанола. На долю формальдегида приходится половина производимого метанола. Потребителями метанола являются производства различных мономеров (например, метилметакрилата и диметилтерефталата), метилтретбутилового эфира (МТБЭ), метилгалогенидов, метиламинов, ионообменных смол, уксусной кислоты. Метанол также широко используется как растворитель и экстрагент. Одной из новых областей применения метанола является использование его в качестве моторного топлива взамен ставшего дефицитным и весьма дорогим бензина.
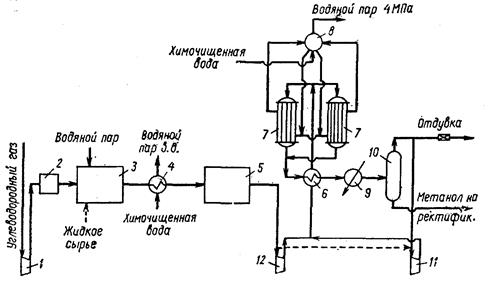
Метанол либо добавляют к бензину в количестве до 5%, либо используют целиком вместо бензина. Однако метанол обладает более низкой теплотворной способностью и является весьма токсичным, что, вероятно, будет сдерживать его применение. Метанол – ядовитая бесцветная жидкость со сладковатым запахом. Метанол в числе других кислородсодержащих соединений впервые был получен из оксида углерода и водорода в 1913 г. Для этой цели использовали железные катализаторы, которые однако быстро покрывались углеродом и дезактивировались. Применение цинк-хромовых катализаторов позволило устранить этот недостаток. Было установлено, что оксид цинка не чувствителен к сере, соединения которой обычно содержатся в синтез-газе и отравляют металлические катализаторы. Реакция образования метанола идет с выделением тепла и уменьшением объема, поэтому ей благоприятствуют низкие температуры и высокие давления. При синтезе метанола протекают следующие реакции: СO+2H2 → CH3OH –ΔН25= 110,8 кДж/моль (1) СO+H2O → CO2+H2 –ΔН25= 41 кДж/моль (2) CO2+3H2 → CH3OH+H2O –ΔН25= 60,4 кДж/моль (3) С повышением температуры степень превращения СО заметно снижается. Условия проведения реакции определяются катализатором. Если катализатор обладает такой высокой активностью, что уже при низкой температуре достигается высокая степень превращения СО, то синтез метанола можно осуществлять уже при давлении 5 МПа. В противном случае, то есть при применении менее активного катализатора, работающего при более высокой температуре, необходимо давление ~30 МПа. Катализаторы, обычно применяемые в промышленности, проявляют активность только при высоких температурах (360-380оС), т.е. в условиях термодинамически неблагоприятных. В промышленности наибольшее распространение получили цинк-хромовые катализаторы, а в последние годы – медьсодержащие катализаторы, достаточно активные при температуре 220-270оС. При управлении селективностью синтеза метанола необходимо учитывать, что протекание этой реакции гораздо менее термически благоприятно, чем протекание таких побочных реакций, как образование углеводородов, высших спиртов, диметилового эфира. Эти реакции можно подавить варьированием состава катализатора. В зависимости от применяемых катализаторов (а, следовательно, условий синтеза) различают два варианта превращения синтез-газа в метанол: синтезы при высоком и низком давлении. При высоком давлении применяют катализаторы на основе оксида цинка, характеризующиеся низкой чувствительностью к сере, промотированные оксидами хрома (межкристаллический промотор – располагающийся вне кристаллической решетки ZnO) или оксидами железа, кальция, магния (внутрикристаллические промоторы – располагающиеся внутри кристаллической решетки ZnO). Реакторы высокого давления представляют собой цельнокованные аппараты колонного типа, для эффективного теплоотвода используют реакторы полочного типа с промежуточным вводом холодного газа и выносным или встроенным теплообменником. Обычное число полок 5-6, для пуска агрегата применяют встроенный электронагреватель или специальную трубчатую печь. Наиболее эффективными каталитическими системами, работающими при низком давлении, являются медьсодержащие оксидные катализаторы. Однако медьсодержащие катализаторы отличаются высокой чувствительностью к примесям сернистых соединений, почти всегда содержащимся в синтез-газе. Если при синтезе на цинк-хромовых катализаторах допустимо содержание сероводорода в синтез-газе выше 100 ррm, то для медных катализаторов этот показатель не может превышать 1 ppm. При низком давлении используют полочные реакторы, аналогичные тем, что применяются при высоком давлении, или реакторы трубчатого типа, в которых катализатор загружен в трубки, а тепло реакции отводится кипящей водой, циркулирующей в межтрубном пространстве реактора и связанной с паросборником, так как при съеме тепла генерируется водяной пар. При использовании трубчатого реактора не требуется пусковой нагреватель, реактор в пусковой период разогревается водяным паром из сети, что является преимуществом реактора этого типа. В то же время достоинством полочного реактора является простота конструкции и легкость загрузки и выгрузки катализатора. Природный газ отделяют от тяжелых углеводородов и компримируют в турбокомпрессоре 1 до 2,5 МПа, после чего направляют на очистку и далее в блок конверсии метана 3. Туда же поступает водяной пар. К метану добавляют небольшое количество СО2. Конверсия метана осуществляется при температуре 850—860 °С. После печей конверсии синтез-газ поступает в котел-утилизатор 4, где генерируется пар высокого давления (12 МПа), который затем перегревается и поступает на турбины — привод компрессоров 1 и 11. Если конверсии подвергают тяжелое жидкое сырье, то блок очистки располагается после конверсии, а необходимость в компрессоре 1 отпадает. В последнем случае конверсию проводят при давлении 5,8 МПа, а синтез-газ после очистки не нуждается в дополнительной компрессии и поступает в циркуляционный компрессор 11. Синтез-газ, полученный из природного газа, направляют на доохлаждение с целью конденсации воды. Далее синтез-газ дожимается в турбокомпрессоре 12 до 5—5,5 МПа, смешивается с циркуляционным газом и через теплообменник 6, обогреваемый горячим реакционным газом, поступает в два параллельно работающих реактора синтеза метанола 7.
Технологическая схема синтеза метанола под низким давлением: 1,11,12 — компрессоры; 2 — блок очистки; 3-блок конверсии метана; 4 - котел-утилизатор; 5 — блок очистки и доохлаждення синтез-газа; 6- теплообменник; 7 — реакторы синтеза метанола; 8—паросборник; 9 - холодильник; 10 — газосепаратор в. д. Реакторы трубчатого типа охлаждаются циркулирующей в межтрубном пространстве водой. Пар направляется в паросборник 8, куда подается и химически очищенная вода. Конденсат из паросборника вновь поступает в реакторы 7, а водяной пар высокого давления направляется на перегрев и используется в турбинах. Продукты реакции направляются через теплообменник 6, где отдают свое тепло синтез-газу, в конденсатор-холодильник 9 и в газосепаратор 10 для отделения метанола от циркуляционного газа. Последний поступает на прием циркуляционного компрессора 11 и вновь направляется в систему синтеза. Часть газа отдувают для удаления поступающих в систему инертных примесей (главным образом метана и азота). Метанол-сырец из газосепаратора 10 направляется на ректификацию.
ВАРИАНТЫ ТЕХНОЛОГИЧЕСКОГО ОФОРМЛЕНИЯ СТАДИИ ГИДРОФОРМИЛИРОВАНИЯ К сырью для оксосинтеза предъявляются жесткие требования в отношении содержания примесей. Из-за того, что диеновые и ацетиленовые углеводороды образуют с карбонилами кобальта неактивные комплексы, появляется индукционный период гидроформилирования, когда катализатор регенерируется, а диеновый или ацетиленовый углеводород гидрируется до олефина. Наличие в синтез-газе кислорода приводит к разложению карбонила кобальта с образованием неактивного оксида СоО, что также замедляет реакцию. Пероксидные соединения также взаимодействуют с гидрокарбонилами, замедляя гидроформилирование и обусловливая большой индукционный период. Поэтому сырье нужно подвергать предварительной очистке. Процесс гидроформилирования является экзотермическим: тепловой эффект равен 117 кДж/моль и мало зависит от молекулярной массы и строения углеводорода. Для процесса имеет большое значение эффективный теплоотвод и поддержание стабильного температурного режима. Отвод тепла осуществляется несколькими способами: 1) в реакторе монтируют трубчатый холодильник, в межтрубном пространстве которого циркулирует вода или синтез-газ—он при этом нагревается до нужной температуры; 2) наряду с внутренним охлаждением применяются также выносные холодильники; 3) в реактор возвращают охлажденные продукты: за счет их нагревания отводится выделяющееся тепло. Реакция протекает при 120—170 °С и 15—30 МПа. Объемную скорость подачи олефина можно менять от 0,4 до 2 ч-1, что соответствует среднему времени контакта 1 ч. В промышленных условиях соотношение СО: Н2 поддерживается в интервале от 1:1 до 2:1, а концентрация катализатора равна 0,02—0,2% (масс.) в расчете на Со. Степень конверсии олефина зависит от его молекулярной массы и колеблется в пределах 65—80 %. С повышением степени конверсии олефина возрастает роль вторичных реакций. Конверсию регулируют изменением объемной скорости. Выход целевых альдегидов составляет не менее 75—85 % от стехиометрического и зависит от молекулярной массы олефина. Процесс гидроформилирования ведут с рециркуляцией синтез-газа. В связи с рециркуляцией необходимо выводить из системы инертные примеси путем промывки синтез-газа циркулирующими продуктами реакции под давлением с последующей десорбцией абсорбированных примесей и дополнительной отдувкой части циркулирующего газа. Гидроформилирование низших олефинов ведут в растворе углеводородов, обычно в растворе высококипящей фракции, остающейся после гидриро- вания и отделения спиртов. Продукты реакции потом легко отделяют от растворителя. Оксид углерода и водород барботируют через слой жидкости, что обеспечивает хорошее перемешивание. Специфической особенностью процесса является необходимость декобальтизации—извлечения карбонилов кобальта из реакционной смеси и возвращения их в процесс. Это основная технологическая трудность процесса, так как декобальтизация технологически значительно сложнее собственно гидроформилирования, и она определяет технико-экономические показатели процесса в целом. По способу декобальтизации технологические схемы оксосинтеза можно классифицировать следующим образом: 1) схемы с термическим разложением карбонилов кобальта, основанные на термической нестабильности карбонилов; 2) солевые схемы, основанные на нестабильности карбонилов кобальта к действию окислителей; 3) испарительные схемы, основанные на различной летучести карбонилов кобальта и продуктов оксосинтеза. 4) смешанные схемы, сочетающие принципы солевых и испарительных схем. Схемы с термическим разложением карбонилов кобальта. Эти схемы основаны на обратимости реакции:
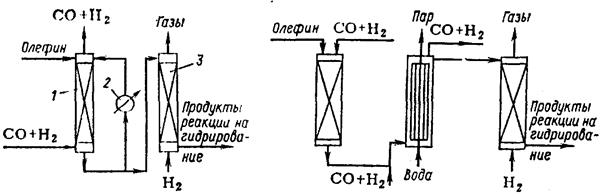
Как указывалось выше, образование карбонилов кобальта идет при более низкой температуре и достаточно высоком парциальном давлении СО, а распад их протекает при более высокой температуре и низком парциальном давлении СО. Как видно из уравнения, при разложении карбонилов образуется металлический кобальт, который обычно отлагается на твердых поверхностях. Это недопустимо, так как кобальт накапливается на стенках аппаратуры и не может быть возвращен в цикл. Поэтому в схемах с термическим разложением карбонилов кобальта в реактор вводят твердый носитель (кизельгур или пемзу), чтобы кобальт оставался на его поверхности. Существуют три разновидности этого способа: 1) с суспендированным носителем (кизельгурная схема); 2) со стационарным слоем носителя; 3) без носителя, с тонкодисперсным металлическим кобальтом. Схема с суспендированным слоем носителя (кизельгурная схема). Катализатор вводят в виде суспензии мелкозернистого кизельгура, на котором осажден металлический кобальт; суспензию готовят в специальном аппарате. Процесс гидроформилирования осуществляют в двух последовательно расположенных реакторах 1 и 2. Суспензию катализатора подают в реактор 1 одновременно с олефином и синтез-газом. Реактор работает под давлением 25—30 МПа при температуре 150— 160°С.
Кизельгурная схема оксосинтеза: 1,2 — реакторы карбонилообразования и гидроформилирования; 5 — реактор гидроформилирования; 3, 4—газосепараторы; 5 — реактор декобальтизации; 6—магнитный сепаратор. В нем образуются карбонилы кобальта и протекает реакция гидроформилирования до степени превращения олефина около 70%. В реакторе 2 реакция гидроформилирования завершается при 160—170 °С с глубиной 80% и более. Продукты реакции поступают в газосепараторы 3 и 4, где суспензия отделяется от газа и направляется в реактор декобальтизации 5, работающий при давлении водорода 2,5—3 МПа и температуре 120—130°С. В этих условиях карбонилы кобальта разлагаются и осаждаются на кизельгур. Жидкие продукты реакции отделяются от катализатора в магнитных сепараторах 6, после чего они направляются на гидрирование, а катализатор вновь поступает в реактор гидроформилирования. Такая схема осуществлена в промышленном масштабе. Характерной особенностью приведенной схемы является использование для гидрирования альдегидов в спирты кобальта, осажденного на мелкозернистом кизельгуре. Схемы со стационарным слоем носителя. В промышленности применяются две разновидности схем—двухреакторную и триадную. В колонне оксосинтеза 1 помещен стационарный слой пемзы, на которой осажден металлический кобальт. Жидкий олефин подают в колонну сверху, а синтез-газ снизу, и они движутся противотоком. В колонне 1 непрерывно происходит образование карбонилов кобальта и растворение их в олефине. В результате реакции выделяется тепло, которое отводится в выносном холодильнике 2, а охлажденные продукты возвращаются в колонну. Часть продуктов поступает в декатализер 3, куда подается водород и где благодаря низкому парциальному давлению СО карбонилы кобальта разлагаются. Выделяющийся при этом металлический кобальт осаждается на насадке, которой заполнен аппарат. После истощения катализатора в колонне 1 и накопления кобальта в декатализере 3 направление потоков меняется на обратное.
Схема двухреакторного реакционного узла оксосинтеза: 1 — колонна оксосинтеза; 2 — холодильник; 3 — декатализер. Реакторный блок триадной схемы оксосинтеза: 1 — катализер; 2—колонна оксосинтеза; 3 — декатализер Триадная схема отличается тем, что реакторный блок состоит из трех аппаратов. Металлический кобальт осажден на стационарном носителе в катализере 1. Жидкий олефин и синтез-газ подаются сверху; при этом образуются карбонилы кобальта, которые растворяются в олефине. Температура в катализере поддерживается 150—180°С, давление 15—30 МПа. Раствор катализатора в олефине вместе с синтез-газом поступает в реактор 2. Туда же дополнительно подают синтез-газ. Отвод выделяющегося тепла осуществляется при помощи вмонтированного в аппарат трубчатого холодильника, в котором генерируется водяной пар. Декобальтизация жидких продуктов осуществляется в декатализере 3, который устроен так же, как катализер 1. В декатализер подают водород. При 150—180°С и низком парциальном давлении СО происходит разложение карбонилов кобальта, и металлический кобальт осаждается на насадке. После истощения кобальта в катализере и накопления его в декатализере направление потоков меняется на обратное. В порошковой схеме используется металлический кобальт, который вводят в реактор в виде тонкого порошка. Карбонилы кобальта разлагаются в декатализере, куда подают рециркулят с суспендированным порошком металлического кобальта; на этот порошок и высаживается продукт разложения. Суспензию после отделения продуктов реакции возвращают в реактор оксосинтеза. Основные недостатки схем с термическим разложением карбонилов кобальта следующие: - большой удельный расход металла, так как разложение карбонилов кобальта осуществляется при высоком давлении; - эрозия аппаратуры и измельчение носителя в схемах с суспендированным катализатором; - периодичность работы реакторов в схеме со стационарным слоем катализатора, что требует сложной автоматики; - отложение кобальта на поверхности аппаратуры, особенно в схемах с суспендированным катализатором. Солевые схемы основаны на разложении карбонилов кобальта окислителями. Так, кобальт вводят в реактор в виде солей жирных или нафтеновых кислот, из которых в условиях гидроформилирования образуются карбонилы:
Распад и образование карбонилов кобальта представляют собой окислительно-восстановительную реакцию. Реакцию разложения карбонилов ведут в присутствии окислителей; без них она идет слишком медленно. Температура на стадии разложения не должна быть высокой во избежание разложения карбонилов до металлического Со. Для процесса выбирают такие кислоты, которые образуют водорастворимые соли, легко отделяемые от декобальтизованного продукта (минеральные или низшие карбоновые кислоты). Водорастворимую соль кобальта затем переводят в маслорастворимую, например нафтенат кобальта, и в таком виде подают в систему образования карбонилов. В процессе образования карбонилов выделяются соответствующие карбоновые кислоты. Более перспективными оказались смешанные схемы, в которых сочетается принцип солевых и испарительных схем. От чисто солевых схем они отличаются тем, что карбонилы кобальта переводят в маслорастворимую соль, например нафтеновой кислоты, являющуюся термоустойчивой и малолетучей. От раствора кобальтовой соли отгоняют продукты гидроформилирования, а остаток возвращают на стадию кобальтизации, где опять образуются карбонилы кобальта.
ПОЛУЧЕНИЕ ОКСИДОВ ОЛЕФИНОВ Промышленное производство оксидов олефинов ограничивается этилен- и пропиленоксидами. Оксид этилена является многотоннажным промышленным продуктом. На основе оксида этилена получают: этиленгликоль, используемый как антифриз, этаноламины, применяемые в качестве абсорбентов для удаления кислых примесей из газов, неионогенные синтетические моющие вещества. Известны два основных способа производства оксида этилена: классический хлоргидринный и современный метод прямого окисления этилена. Получение оксида этилена хлоргидридным методом состоит из двух стадий. На первой стадии при пропускании этилена и хлора через воду образуется этиленхлоргидрин:
Температура реакции 48—52°С, давление около 1,1 атм. На второй стадии полученный раствор этиленхлоргидрина омыляется раствором известкового молока (10—12%-ной концентрации) при температуре 90—100°С, который приливают к этиленхлоргидрину:
Оксид этилена отгоняется затем из водного раствора. Экономически более выгодным является получение оксида этилена прямым окислением этилена, так как при этом методе не тратится хлор. Себестоимость оксида этилена, полученного прямым окислением, на 20% ниже, чем при получении его хлоргидринным методом. Прямое окисление этилена протекает над серебряным катализатором при температуре 220—280°С и давлении 7—10 атм. Реакция протекает в критических условиях; если условия мягкие, образуется мало оксида этилена, в жестки
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1045; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.197.111 (0.02 с.) |




 .
. МПа.
МПа. .
.
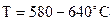 .
. хромкальций - никельфосфатный.
хромкальций - никельфосфатный.
 .
. МПа.
МПа.
 .
. .
.



 .
. МПа.
МПа. .
.
 .
. .
.
 .
. МПа.
МПа. .
.
 .
. .
. .
.

 .
. .
. .
. -метилстирольный каучук. Применяют в шинной и в резиновой промышленности. Вместо стирола используют
-метилстирольный каучук. Применяют в шинной и в резиновой промышленности. Вместо стирола используют 
 .
. .
. .
.
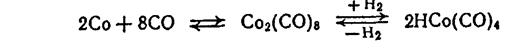

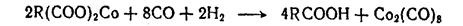
 Карбонилы после реакции разлагают серной кислотой в присутствии пероксида водорода:
Карбонилы после реакции разлагают серной кислотой в присутствии пероксида водорода: