Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физиологические виды гемоглобинаСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
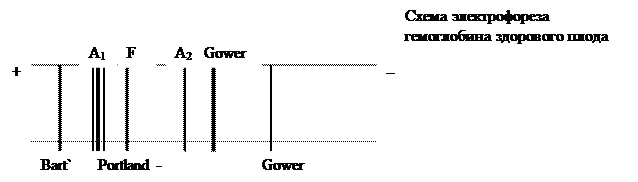
1) эмбриональные гемоглобины (Gover I, Gover II). На ранних этапах развития плода в первые недели развития, когда в желточном мешке возникают очаги кроветворения начинается синтез e-цепей (эпсилон). Из четырёх e цепей образуется гемоглобин Gover I. Затем у эмбриона, длина которого не превышает 2,5см, начинается синтез a-цепей, которые вместе e-цепями образуют гемоглобин Gover II (2a 2e). Затем синтез e-цепей прекращается и Gover гемоглобины полностью исчезают у трехмесячного эмбриона. Если они остаются у новорожденного, то это признак врожденной аномалии развития. 2) фетальный гемоглобин – HbF (от латинского fetus – плод). Фетальный гемоглобин сменяет эмбриональные гемоглобины, вместо эпсилон – цепей (e - цепей) начинают синтезироваться гамма-цепи (g - цепи). HbF состоит из 2 a и 2g цепей. HbF – является главным гемоглобином плода и составляет к моменту рождения 50-80% всего гемоглобина. HbF имеет более высокое сродство к кислороду, что позволяет ему забирать кислород от гемоглобина матери и передавать его тканям плода. Эта особенность связана с низким сродством HbF к 2,3-ФГК. Кроме перечисленных основных видов гемоглобинов плода, у здорового плода выделяются и другие виды гемоглобинов: например, гемоглобин Bart`s, (4g), Portland–1 (S2g2).
3) гемоглобин А1 – тетрамер (2a 2b) составляет около 98% гемоглобина эритроцитов взрослого человека. Начинает синтезироваться на 8 месяце развития плода. 4) гемоглобин А2 – тетрамер (2a 2d). Его содержание в эритроцитах взрослого человека равно 2%. Гемоглобин А2, также как и гемоглобин F, обладает более высоким сродством к кислороду по сравнению с гемоглобином А1. 5) гемоглобин А3 (2a 2b) образуется по мере старения эритроцита, при присоединении к цистеину b-цепи глутатиона. 6) гемоглобин А1С – гликозилированный гемоглобин А. Аномальные виды гемоглобинов Аномальные гемоглобины возникают в результате мутации генов, кодирующих a и b цепи. Известно несколько сотен мутантных гемоглобинов человека (в большинстве случаев функционально активных). Таблица №1 замена аминокислот в a и b пептидных цепях гемоглобина
Болезни гемоглобинов Болезни гемоглобинов называют гемоглобинозами, их насчитывают более 200. Гемоглобинозы делятся на гемоглобинопатии и таласемии. Гемоглобинопатии, возникают в результате точечных мутаций в структурных генах, кодирующих полипептидные цепи гемоглобина. Поэтому в крови появляется аномальный гемоглобин. Серповидноклеточная анемия – классический пример наследственной гемоглобинопатии. В норме в b-субъединицах гемоглобина в шестом положении находится гидрофильная глутаминовая кислота. В гемоглобине S глутаминовая кислота заменена на гидрофобный валин. Такая замена приводит к появлению на поверхности b-субъединицы гидрофобного («липкого») участка, который соединяется с гидрофобным карманом другой молекулы гемоглобина S. Происходит полимеризация гемоглобина S и его осаждение в виде длинных волокон. Длинная волокнистая структура нарушает нормальную форму эритроцитов, превращая её из двояковогнутого диска в серповидную, которая имеет тенденцию блокировать капилляры. Такие эритроциты преждевременно разрушаются, способствуя развитию анемии. Если поражены обе гомологичные хромосомы, заболевание может оказаться смертельным. Заболевание широко распространено в географических зонах, где наиболее часто встречается злокачественная форма малярии. Высокий показатель заболеваемости можно объяснить положительной селекцией генома носителей аномальных генов. Серповидная красная кровяная клетка «неудобна» для развития малярийного плазмодия. Существенное ухудшение состояния больных наблюдается в условиях высокогорья при низких давлениях кислорода. Это связано с тем, что полимеризоваться способна только дезоксиформа S гемоглобина. Так как в молекуле оксиформы S-гемоглобина нет гидрофобного кармана («липкого участка»), и она не способна к полимеризации. Талассемия – генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. При данном заболевании отсутствуют дефекты в структурных генах, кодирующих a, b, g,d -цепи. Причиной талассемий являются мутации генов-операторов, контролирующих транскрипцию структурных генов a, b, g,d -цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. В зависимости от того, формирование какой глобиновой цепи нарушается, выделяют a, b, g, e - талассемии. Талассемии делятся так же на гомозиготные и гетерозиготные. Гомозиготная b-талассемия – формирование b-цепи полностью подавляется. Симптомы заболевания появляются приблизительно через полгода после рождения, когда происходит полное переключение синтеза g-цепи гемоглобина F на b-цепь. У ребенка прогрессирует анемия. Увеличиваются селезенка и печень. Лицо приобретает монголоидные черты (из-за чрезмерного разрастания костного мозга скулы выдаются вперед, нос приплюснут), при рентгенологическом исследовании черепа наблюдается феномен «игл ежа» («hair – standing –on –end»). В попытке восполнить эритроциты, утраченные в результате не эффективного эритропоэза и увеличении гемолиза, ткани черепа, чрезмерно разрастаясь и гипертрофируясь, порождают такое изменение медуллярной пластинки. α-талассемия - недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения. Для всех этих заболеваний характерны некоторые общие закономерности: 1). нарушаются пропорции в составе гемоглобина крови. Например, при b- талассемии в крови появляется 15% гемоглобина А2, 15 – 60% гемоглобина F; 2). эритроциты приобретают не нормальную форму (мишеневидную, каплевидную). Такие эритроциты в пределах 1 дня захватываются ретикулярной соединительной тканью (например, селезенкой) и подвергаются распаду (по этой причине селезёнка оказывается гипертрофированной), что приводит к развитию гемолитической анемии. Катаболизм гемоглобина Старые поврежденные эритроциты фагоцитируются клетками РЭС и перевариваются в лизосомах. При распаде гемоглобина образуется жёлчный пигмент билирубин. Дальнейший катаболизм билирубина в печени, кишечнике и почках приводит к образованию уробилиногенов и уробилина, которые выходятся с калом и мочой. Железо, освобождающееся при распаде гема, снова используется для синтеза железосодержащих белков.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 550; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |