
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: Биохимия крови 1. Физико-химические свойства,Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Кафедра биохимии
КУРС ЛЕКЦИЙ ПО ОБЩЕЙ БИОХИМИИ
Модуль 7. Биохимия крови
Автор: к.б.н., доцент кафедры биохимии Гаврилов И.В.
Екатеринбург, 2009г ЛЕКЦИЯ № 22 Тема: Биохимия крови 1. Физико-химические свойства, Химический состав Факультеты: лечебно-профилактический, медико-профилактический, педиатрический. 2 курс. Функции крови Кровь - это жидкая ткань, которая выполняет в организме ряд важных функций:
а) Дыхательная функция. Кровь переносит газы: О2 от легких к органам и тканям, а обратно СО2; б) Трофическая и выделительная функция. Кровь доставляет органам и тканям питательные вещества, забирая от них продукты метаболизма; в) Коммуникативная функция. Кровь переносит гомоны от места их синтеза к органам-мишеням; г) Кровь транспортирует по организму воду и ионы; д) Терморегуляторная функция. Кровь перераспределяет в организме тепловую энергию;
В результате выполнения перечисленных функций, кровь обеспечивает поддержание в организме гомеостаза. Для нормального функционирования кровь: 1. должна находиться в жидком состоянии, и присутствовать в кровяном русле в достаточном объеме, что в основномобеспечивается работой желудочно-кишечного тракта, почек, печени и эндотелия сосудов. 2. должна содержать определенное количество форменных элементов, белков, низкомолекулярных органических веществ, электролитов, что в основномобеспечивается работой костного мозга, печени, селезенки, почек и желудочно-кишечного тракта.
ОБЩИЕ И СПЕЦИФИЧЕСКИЕ СВОЙСТВА КРОВИ Все жидкости организма обладают рядом общих свойств: объемом, плотностью, вязкостью, рН и осмотическим давлением. Нормальные значения общих свойств крови взрослого человека:
При этом у некоторых жидкостей организма могут быть подчеркнуты специфические свойства, такие как цвет, прозрачность, запах и т.д. К специфическим свойствам крови относятся онкотическое давление, СОЭ, цветовой показатель и гематокрит. Нормальные значения специфических свойств крови взрослого человека:
ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ОБЩИХ И СПЕЦИФИЧЕСКИХ СВОЙСТВ КРОВИ В связи с тем, что кровь поддерживает гомеостаз в организме и контактирует практически со всеми органами и тканями, она является самым хорошим биологическим материалом для диагностики большинства заболеваний организма.
СОСТАВ КРОВИ Кровь является разновидностью соединительной ткани и, как любая ткань, состоит из клеток и межклеточного вещества. КЛЕТОЧНЫЙ СОСТАВ КРОВИ Форменные элементы (клетки) крови составляют 45% от общего объема крови.
Среди лейкоцитов выделяют:
Изображение форменных элементов крови
МЕЖКЛЕТОЧНОЕ ВЕЩЕСТВО КРОВИ Межклеточное вещество крови называется плазмой крови, она составляет 55% от общего объема крови. Для получения плазмы крови, цельную кровь центрифугируют с антикоагулянтом, например с гепарином. Существует также понятие сыворотка крови, в отличие от плазмы сыворотка крови не содержит белок фибриноген. Сыворотку крови получают при центрифугировании цельной крови без антикоагулянта. БЕЛКИ ПЛАЗМЫ КРОВИ В плазме крови открыто более 200 видов белков, которые составляют 7% объема плазмы. Белки плазмы крови синтезируются в основном в печени и макрофагах, а также в эндотелии сосудов, в кишечнике, лимфоцитах, почках, эндокринных железах. Разрушаются белки плазмы крови печенью, почками, мышцами и др. органами. Т½ белков плазмы крови составляет от нескольких часов до несколько недель. В плазме крови белки выполняют следующие функции:
Фракции белков плазмы крови I. Альбумины Основным белком этой фракции является альбумин. Альбумин. Простой белок из 585 АК с массой 69кДа, имеет 17 дисульфидных мостиков, много дикарбоновых АК, обладает высокой гидрофобностью. У альбумина наблюдается полиморфизм. Синтезируется в печени (12 г/сут), утилизируется почками, энтероцитами и др. тканями. Т½=20 дней. 60% альбуминов находиться в межклеточном веществе, 40% - в кровяном русле. В плазме альбуминов 40-50г/л, они составляют 60% всех белков плазмы крови. Функции: поддержание онкотического давления (вклад 80%), транспорт свободных жирных кислот, билирубина, жёлчных кислот, стероидных и тиреоидных гормонов, ХС, лекарств, неорганических ионов (Cu2+, Ca2+, Zn2+), является источником аминокислот. Транстиретин (преальбумин). Тетрамер. В плазме 0,25г/л. Белок острой фазы (5 группа). Транспортирует тиреоидные гормоны и ретинолсвязывающий белок. Снижается при голодании. Диспротеинемия альбуминовой фракции реализуется преимущественно за счет гипоальбуминемии. Причиной гипоальбуминемии является снижение синтеза альбуминов при печеночной недостаточности (цирроз), при повышении проницаемости капилляров, при активации катаболизма вследствие ожогов, сепсисе, опухолях, при потере альбуминов с мочой (нефротический синдром), при голодании. Гипоальбуминемия вызывает отек тканей, снижение почечного кровотока, активацию РААС, задержку воды в организме и усиление отека тканей. Резкий отток жидкости в ткани приводит к снижению АД и может вызвать шок. Глобулины. Онисодержат липопротеины и гликопротеины. II. α1-Глобулины α1-Антитрипсин - гликопротеин, синтезируемый печенью. В плазме 2,5г/л. Белок острой фазы (2 группа). Важный ингибитор протеаз, в том числе эластаз нейтрофилов, которые разрушают эластин альвеол лёгких и печени. α1-Антитрипсин также ингибирует коллагеназу кожи, химотрипсин, протеазы грибков и лейкоцитов. При дефиците α1-антитрипсина могут возникнуть эмфизема лёгких и гепатит, приводящий к циррозу печени.
Кислый α1- гликопротеин, синтезируется печенью. В плазме 1 г/л. Белок острой фазы (2 группа). Транспортирует прогестерон и сопутствующие гормоны. ЛПВП синтезируются в печени. В плазме 0,35 г/л. Транспортируют излишки ХС из тканей в печень, обеспечивают обмен других ЛП. Протромбин - гликопротеид, содержащий около 12% углеводов; белковая часть молекулы представлена одной полипептидной цепью; молекулярная масса около 70000Да. В плазме 0,1 г/л. Протромбин - предшественник фермента тромбина, стимулирующего формирование тромба. Биосинтез протекает в печени и регулируется витамином К, образуемым кишечной флорой. При его недостатке витамина К уровень протромбина в крови падает, что может приводить к кровоточивости (ранняя детская геморрагия, обтурационная желтуха, некоторые болезни печени). Транскортин - гликопротеин, синтезируемый в печени, масса 55700Да, Т½=5 суток. Переносит кортизол, кортикостерон, прогестерон, 17-альфа-гидроксипрогестерон и, в меньшей степени, тестостерон. В плазме 0,03 г/л. Концентрация в крови чувствительна к экзогенным эстрогенам и зависит от их дозы. Тироксинсвязывающий глобулин (TBG) -синтезируется в печени. Молекулярная масса 57 кДа. В плазме 0,02 г/л. Т½=5 суток. Он является главным транспортером тироидных гормонов в крови (транспортирует 75% тироксина и 85% трийодтиронина). Диспротеинемия за счет α1-глобулиной фракции реализуется преимущественно за счет: 1). снижения синтеза α1-антитрипсина. 2). Потере белков этой фракции с мочой при нефротическом синдроме. 3). повышения белков острой фазы в период воспаления. III. α2-Глобулины α2-Макроглобулин очень крупный белок (725 кДа), синтезируется в печени. Белок острой фазы (4 группа). В плазме 2,6 г/л. Главный ингибитор множество классов протеиназ плазмы, регулирует свертывание крови, фибринолиз, кининогенез, иммунные реакции. Уровень α2-макроглобулина в плазме уменьшается в острой фазе панкреатита и карциномы простаты, увеличивается - в результате гормонального эффекта (эстрогены). Гаптоглобин – гликопротеид, синтезируется в печени. В плазме 1 г/л. Белок острой фазы (2 группа). Связывает гемоглобин с образованием комплекса, обладающего пероксидазной активностью, препятствует потери железа из организма. Гаптоглобин эффективно ингибирует катепсины С, В и L, может участвовать в утилизации некоторых патогенных бактерий.
Витамин Д связывающий белок (БСВ) (масса 70кДа). В плазме 0,4 г/л. Обеспечивает транспорта витамина А в плазме и предотвращает его экскрецию с мочой. Церулоплазмин - главный медьсодержащий белок плазмы (содержит 95% меди в плазмы) с массой 150кДа, синтезируется в печени. В плазме 0,35 г/л. Т½=6 суток. Церулоплазмин обладает выраженной оксидазной активностью; ограничивает освобождение железа, активирует окисление аскорбиновой кислоты, норадреналина, серотонина и сульфгидрильных соединений, инактивирует активные формы кислорода, предотвращая ПОЛ. Церулоплазмин - белок острой фазы (3 группа). Он повышается у больных с инфекционными заболеваниями, циррозом печени, гепатитами, инфарктом миокарда, системными заболеваниями, лимфогранулематозом, при злокачественных новообразованиях различной локализации (рак легкого, молочной железы, шейки матки, желудочно-кишечного тракта). Болезнь Вильсона – Коновалова. Недостаточность церулоплазмина возникает при нарушении его синтеза в печени. При дефиците церулоплазмина Cu2+ уходит из крови, выводятся с мочой или накапливается в тканях (например, в ЦНС, роговице). Антитромбин III. В плазме 0,3 г/л. Ингибитор плазменных протеаз. Ретинолсвязывающий белок синтезируется в печени. В плазме 0,04 г/л. Связывает ретинол, обеспечивает его транспорт и предотвращает распад. Функционирует в комплексе с транстиретином. Ретинол связывающий белок фиксирует излишки витамина А, что предотвращает мембранолитическое действие высоких доз витамина. Диспротеинемия за счет α2-глобулиной фракции может возникать при воспалении, т.к. в этой фракции содержатся белки острой фазы. IV. β-Глобулины ЛПОНП - образуются в печени. Транспорт ТГ, ХС. ЛППП - образуются в крови из ЛПОНП. Транспорт ТГ, ХС. ЛПНП – образуются в крови из ЛППП. В плазме 3,5 г/л. Транспортируют излишки ХС из периферических органов в печень. Трансферрин – гликопротеин, синтезируется печенью. В плазме 3 г/л. Т½=8 суток. Главный транспортер железа в плазме, 1 молекула трансферрина связывает 2 Fe3+, а 1г трансферрина соответственно около 1,25 мг железа. При снижении концентрации железа синтез трансферрина возрастает. Белок острой фазы (5 группа). Снижается при печеночной недостаточности. Фибриноген гликопротеин, синтезируется в печени. Молекулярная масса 340кДа. В плазме 3 г/л. Т½=100часов. Фактор I свёртывания крови, способен под действием тромбина превращаться в фибрин. Является источником фибринопептидов, обладающих противовоспалительной активностью. Белок острой фазы (2 группа). Содержание фибриногена увеличивается при воспалительных процессах и некрозе тканей. Снижается при ДВС синдроме, печеночной недостаточности. Фибриноген основной белок плазмы, влияющий на величину СОЭ (с повышением концентрации фибриногена скорость оседания эритроцитов увеличивается). С-реактивный белок синтезируется преимущественно в гепатоцитах, его синтез инициируется антигенами, иммунными комплексами, бактериями, грибами, при травме (через 4-6 ч после повреждения). Может синтезироваться эндотелиоцитами артерий. В плазме <0,01 г/л. Белок острой фазы (1 группа). Способен связывать микроорганизмы, токсины, частицы поврежденных тканей, препятствуя тем самым их распространению. Эти комплексы активируют комплемент по классическому пути, стимулируя процессы фагоцитоза и элиминации вредных продуктов. С-реактивный белок может взаимодействовать с Т-лимфоцитами, фагоцитами и тромбоцитами, регулируя их функции в условиях воспаления. Обладает антигепариновой активностью, при повышении концентрации ингибирует агрегацию тромбоцитов. СРБ - это маркер скорости прогрессирования атеросклероза. Определяют для диагностики миокардитов, воспалительных заболеваний клапанов сердца, воспалительные заболевания различных органов.
Диспротеинемия за счет β-глобулиной фракции может возникать при 1). некоторых дислипопротеинемиях; 2). воспалении, т.к. в этой фракции содержатся белки острой фазы; 3). При нарушении свертывающей системы крови. V. γ-Глобулины Синтезируются функционально активными В-лимфоцитами (плазмоцитами). У взрослого человека 107 клонов В-лимфоцитов которые синтезируют 107 видов γ-глобулинов. γ-Глобулины гликопротеины, состоят 2 тяжелых (440 АК) и 2 легких (220 АК) полипептидных цепей различной конфигурации, которые соединяются между собой дисульфидными мостиками. Антитела гетерогенны, отдельные составные части полипептидов кодируются разными генами, с различной способностью к мутированию. Все γ-глобулины разделены на 5 классов G,A,M,D,E. В каждом классе выделяют несколько подклассов. Диспротеинемия за счет γ-глобулиной фракции может возникать при 1). Иммунодефицитом состоянии; 3). Инфекционных процессах. 2). Нефротическом синдроме.
ФЕРМЕНТЫ ПЛАЗМЫ КРОВИ Ферменты, находящиеся в плазме крови, можно разделить на 3 основные группы: 1. Секреторные. Они синтезируются в печени, эндотелии кишечника, сосудов поступают в кровь, где выполняют свои функции. Например, ферменты свертывающей и противосвертывающей системы крови (тромбин, плазмин), ферменты обмена липопротеинов (ЛХАТ, ЛПЛ). 2. Тканевые. Ферменты клеток органов и тканей. Они попадают в кровь при увеличении проницаемости клеточных стенок или при гибели клеток тканей. В норме их содержание в крови очень низкое. Некоторые тканевые ферменты имеют диагностическое значение, т.к. по ним можно определить пораженный орган или ткань, по этому их еще называют индикаторными. Например, ферменты ЛДГ с 5 изоформами, креатинкиназа с 3 изоформами, АСТ, АЛТ, кислая и щелочная фосфатаза и т.д. 3. Экскреторные. Ферменты, синтезируемые железами ЖКТ (печень, поджелудочная железа, слюнные железы) в просвет ЖК тракта и участвующие в пищеварении. В крови эти ферменты появляются при повреждении соответствующих желез. Например, при панкреатите в крови обнаруживают липазу, амилазу, трипсин, при воспалении слюнных желез – амилазу, при холестазе – щелочную фосфатазу (из печени).
ЛЕКЦИЯ № 23 Тема: Биохимия крови 2. ФункциИ эритроцитов Основными функциями эритроцитов, которые реализуются с участием гемоглобина, являются транспорт от легких к тканям О2 и обратно СО2, а также регуляция КОС. Кроме того эритроциты адсорбируют и транспортируют на своей клеточной мембране аминокислоты, антитела, токсины, лекарственных веществ и другие вещества. Строение эритроцитов Эритроциты у человека и млекопитающих в токе крови обычно (80%) имеют форму двояковогнутых дисков и называются дискоцитами. Такая форма эритроцитов создаёт наибольшую площадь поверхности по отношению к объёму, что обеспечивает максимальный газообмен, а также обеспечивает большую пластичность при прохождении эритроцитами мелких капилляров. Диаметр эритроцитов у человека колеблется от 7,1 до 7,9 мкм, толщина эритроцитов в краевой зоне - 1,9 - 2,5 мкм, в центре - 1 мкм. В нормальной крови указанные размеры имеют 75% всех эритроцитов - нормоциты; большие размеры (свыше 8,0 мкм) - 12,5 % - макроциты. У остальных эритроцитов диаметр может быть 6 мкм и меньше - микроциты. Поверхность отдельного эритроцита у человека приблизительно равна 125 мкм2, а объём (MCV) – 75-96 мкм3. Эритроциты человека и млекопитающих представляют собой безъядерные клетки, утратившие в процессе фило- и онтогенеза ядро и большинство органелл, они имеют только цитоплазму и плазмолемму (клеточную мембрану), толщиной около 20 нм. Плазмолемма эритроцитов Плазмолемма эритроцитов состоит из примерно равного количества липидов и белков, а также небольшого количества углеводов. Липиды Бислой плазмолеммы образован глицерофосфолипидами, сфингофосфолипидами, гликолипидами и холестерином. Внешний слой содержит много холина (фосфатидилхолин, сфингомиелин) и около 5% (от общего количества липидов) гликолипидов, внутренний - много фосфатидилсерина и фосфатидилэтаноламина. Белки В плазмолемме эритроцита идентифицировано 15 главных белков с молекулярной массой 15-250 кДа. Большинство этих белков (спектрин, гликофорин, белок полосы 3, белок полосы 4.1, актин, анкирин) образуют с цитоплазматической стороны плазмалеммы цитоскелет, который придает эритроциту двояковогнутую форму и высокую механическую прочность.
Самыми распространенными белками плазмолеммы (более 60% всех мембранных белков) являютсяспектрин, гликофорин и белок полосы 3. Спектрин - основной белок цитоскелета эритроцитов (составляет 25% массы всех мембранных и примембранных белков), имеет вид фибриллы 100 нм, состоящей из двух антипаралельно перекрученных друг с другом цепей α-спектрина (240 кДа) и β-спектрина (220 кДа). Молекулы спектрина образуют сеть, которая фиксируется на цитоплазматической стороне плазмалеммы с помощью анкирина и белка полосы 3 или актина, белка полосы 4.1 и гликофорина. Белок полосы 3 - трансмембранный гликопротеид (100 кДа), его полипептидная цепь которого много раз пересекает бислой липидов. Белок полосы 3 является компонентом цитоскелета и анионным каналом, который обеспечивает трансмембранный антипорт для ионов НСО3- и Сl-. Гликофорин - трансмембранный гликопротеин (30 кДа), который пронизывает плазмолемму в виде одиночной спирали. С наружной поверхности эритроцита к нему присоединены 20 цепей олигосахаридов, которые несут отрицательные заряды. Гликофорины формируют цитоскелет и, через олигосахариды, выполняют рецепторные функции. Na+,K+-АТФ-аза мембранный фермент, обеспечивает поддержание градиента концентраций Na+ и К+ по обе стороны мембраны. При снижении активности Na+K+-АТФ-азы концентрация Na+ в клетке повышается, что приводит к увеличению осмотического давления, увеличению поступления воды в эритроцит и к его гибели в результате гемолиза. Са2+-АТФ-аза — мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны. Углеводы Олигосахариды (сиаловая кислота и антигенные олигосахариды) гликолипидов и гликопротеидов, расположенные на наружной поверхности плазмолеммы, образуют гликокаликс. Олигосахариды гликофорина определяют антигенные свойства эритроцитов. Они являются агглютиногенами (А и В) и обеспечивают агглютинацию (склеивание) эритроцитов под влиянием соответствующих белков плазмы крови – a- и b-агглютининов, находящихся в составе фракции g-глобулинов. Агглютиногены появляются на мембране на ранних стадиях развития эритроцита. На поверхности эритроцитов имеется также агглютиноген - резус-фактор (Rh-фактор). Он присутствует у 86% людей, у 14% отсутствует. Переливание резус-положительной крови резус-отрицательному пациенту вызывает образование резус-антител и гемолиз эритроцитов. Цитоплазма эритроцитов В цитоплазме эритроцитах содержится около 60% воды и 40% сухого остатка. 95% сухого остатка составляет гемоглобин, он образует многочисленные гранулы размером 4-5нм. Оставшиеся 5% сухого остатка приходятся на органические (глюкоза, промежуточные продукты ее катаболизма) и неорганические вещества. Из ферментов в цитоплазме эритроцитов присутствуют ферменты гликолиза, ПФШ, антиоксидантной защиты и метгемоглобинредуктазной системы, карбоангидраза. А. Анаэрбный гликолиз Катаболизм углеводов в эритроцитах на 70-90% происходит в анаэробном гликолизе, где с участием фосфоглицераткиназы и пируваткиназы образуется АТФ, а с участием 3-ФГА дегидрогеназы восстанавливается НАДН2. Конечный продукт лактат выходит в плазму крови и направляется преимущественно в печень для глюконеогенеза. Б. ПФШ 10% углеводов в эритроцитах подвергаются катаболизму в ПФШ. В его окислительной стадии с участием глюкозо-6-фосфат дегидрогеназы и 6-фосфоглюконат дегидрогеназы восстанавливается НАДФН2. Обмен метгемоглобина В течение суток до 3% гемоглобина может спонтанно окисляться в метгемоглобин: Hb (Fe2+) ® Met Hb (Fe3+) +e- Восстановление метгемоглобина до гемоглобина осуществляет метгемоглобинредуктазная система. Она состоит из цитохрома b5 и цитохром b5 редуктазы (флавопротеин), донором водорода служит НАДН2, образующийся в гликолизе. 1). Цитохром b5 восстанавливает Fe3+ метгемоглобина в Fe2+ гемоглобина: MetHb(Fe3+) + цитb5 восст → Hb(Fe2+) + цит b5 окисл 2). Окисленный Цитохром b5 восстанавливается цитохром b5 редуктазой: цит b5 окисл + НАДН2 → цитb5 восст + НАД+ Восстановление метгемоглобина может осуществляться также неферментативным путём, например, за счёт витамина В12, аскорбиновой кислоты или глутатиона. У здорового человека концентрация метгемоглобина в крови не превышает 1%. Генетический дефект ферментов гликолиза и метгемоглобинредуктазной системы приводит к накоплению метгемоглобина и увеличению образования активных форм кислорода. Активные формы кислорода вызывают образование дисульфидных мостиков между протомерами метгемоглобина, что приводит к их агрегации с образованием телец Хайнца. Последние способствуют разрушению эритроцитов при попадании их в мелкие капилляры. Накопление метгемоглобина в крови из-за нарушения транспорта кислорода ведет к гипоксии. Строение гема
Использование гема Гем является простатической группой многих белков: гемоглобина, миоглобина, цитохромов митохондриальной ЦПЭ, цитохрома Р450, ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы. Наибольшее количество гема содержат эритроциты, заполненные гемоглобином, мышечные клетки, имеющие миоглобин, и клетки печени, содержащие цитохром Р450. Гемы разных белков могут содержать разные типы порфиринов. В геме гемоглобина находится протопорфирин IX, в состав цитохромоксидазы входит формилпорфирин и т.д. Синтез гема Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина, в гепатоцитах — для образования цитохрома Р450. 1). Аминолевулинат-синтаза, пиридоксальзависимый фермент, в матриксе митохондрий катализирует образование 5-аминолевулиновой кислоты (5-АЛК) из глицина и суцинил-КоА. Суцинил-КоА поступает из ЦТК. Реакцию ингибирует и репрессирует гем. В ретикулоцитах реакцию индуцирует железо (через железосвязывающий белок и железочувствительный элемент (IRE)). Дефицит пиридоксальфосфата снижает активность аминолевулинатсинтазы. Стероидные гормоны и некоторые лекарства (барбитураты, диклофенак, сульфаниламиды), инсектициды, канцерогенные вещества являются индукторами аминолевулинатсинтазы. Это связано с возрастанием потребления гема системой цитохрома Р450, который участвует в метаболизме этих соединений в печени.
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. 2). Порфобилиноген-синтаза (Аминолевулинатдегидратаза) цитоплазматический Zn-содержащий фермент, соединяет 2 молекулы 5-аминолевулиновой кислоты в молекулу порфобилиногена. Реакцию ингибирует гем и ионы свинца. Поэтому, при отравлении свинцом в крови и моче повышается концентрация 5-АЛК.
3). Порфобилиногендезаминаза в цитоплазме дезаминирует (-4NH4+) 4 молекулы порфобилиногена в молекулу гидроксиметилбилана. 4). Уропорфириноген III косинтаза в цитоплазме дегидрирует гидроксиметилбилан в молекулу уропорфириногена III. Гидроксиметилбилан может также неферментативно превращаться в уропорфириноген I, который декарбоксилируется в копропорфириноген I. 5). Уропорфириногендекарбоксилаза декарбоксилирует (-4СО2) в цитоплазме уропорфириноген III до копропорфириногена III. Из цитоплазмы копропорфириноген III опять поступает в митохондрии. 6). Копропорфриноген III оксидаза в митохондриях декарбоксилирует (+ О2, -2СО2) копропорфириноген III в протопорфириноген IX. 7. Протопорфириногеноксидаза в митохондриях окисляет (-6Н+) протопорфириноген IX в протопорфирин IX. 8). Феррохелатаза в митохондриях встраивает Fe2+ в молекулу протопорфирина IX с образованием гема. Источником железа для синтеза гема служит ферритин.
Классификации порфирий Единой классификации порфирий нет. Порфирии делят по причинам на: 1) Наследственные. Возникают при дефекте гена фермента, участвующего в синтезе гема; 2) Приобретенные. Возникают при ингибирующем влиянии токсических соединений (гексохлорбензол, соли тяжелых металлов - свинец) на ферменты синтеза гема. В зависимости от преимущественной локализации дефицита фермента (в печени или эритроцитах) порфирин делится на: 1) печеночные – наиболее распространенны. К ним относятся острая перемежающаяся порфирия (ОПП), поздняя кожная порфирия, наследственная копропорфирия, мозаичная порфирия; 2) эритропоэтические – врожденная эритропоэтическая порфирия (болезнь Гюнтера), эритропоэтическая протопорфирия. В зависимости от клинической картины, порфирии делят на: 1) острые. 2) хронические. Негативные последствия порфирий связаны с дефицитом гема и накоплением в организме промежуточных продуктов синтеза гема – порфириногенов и продуктов их окисления. При эритропоэтических порфириях порфирины накапливаются в нормобластах и эритроцитах, при печёночных — в гепатоцитах. Для каждого вида порфирии существует определенный уровень ферментативного дефекта, в результате накапливаются продукты, синтезирующиеся выше этого уровня. Эти продукты являются основными диагностическими маркерами заболевания. Порфириногены ядовиты, при тяжёлых формах порфирий они вызывают нейропсихические расстройства, нарушения функций РЭС и повреждения кожи. Нейропсихические расстройства при порфириях связаны с тем, что аминолевулинат и порфириногены являются нейротоксинами. В коже на солнце порфириногены легко превращаются в порфирины. Кислород при взаимодействии с порфиринами переходит в синглетное состояние. Синглетный кислород стимулирует ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи. Порфириногены бесцветны и не флуоресцируют, а порфирины проявляют интенсивную красную флуоресценцию в ультрафиолетовых лучах. Избыток порфиринов который выводиться с мочой, придает ей темный цвет («порфирин» в переводе с греч. означает пурпурный). При лёгких формах наследственных порфирий заболевание может протекать бессимптомно, но приём лекарств, являющихся индукторами синтеза аминолевулинатсинтазы, может вызвать обострение болезни. В некоторых случаях симптомы болезни не проявляются до периода полового созревания, когда повышение образования β-стероидов вызывает индукцию синтеза аминолевулинатсинтазы. Порфирии наблюдают и при отравлениях солями свинца, так как свинец ингибирует аминолевулинатдегидратазу и феррохелатазу. Некоторые галогенсодержащие гербициды и инсектициды являются индукторами синтеза аминолевулинатсинтазы, поэтому попадание их в организм сопровождается симптомами порфирии. Виды порфирий Острая перемежающая порфирия (ОПП) – причина – дефект гена, кодирующего ПБГ – дезаминазу. Наследуется по аутосомно-доминатному типу. Происходит накопление ранних предшественников синтеза гема: 5- АЛК (5- ALA) и порфобилиногена (ПБГ). Бесцветный ПБГ на свету превращается в порфибилин и порфирин, они предают моче темный цвет. АЛК оказывает нейротоксическое действие, приводя к вялому параличу конечностей и парезу дыхательной мускулатуры. Последнее вызывает острую дыхательную недостаточность. Заболевание проявляется в среднем возрасте, провоцируется приемом анальгетиков, сульфаниломидных препаратов, так как они увеличивают синтез АЛК – синтазы. Клинической симптоматикой являются острые боли в животе, рвота, запор, сердечно-сосудистые нарушения, нервно-психические расстройства. Не наблюдается повышенной чувствительности к свету, так как метаболическое нарушение проходит на стадии, предшествующей образованию уропорфириногена. Для лечения применяют препарат нормосанг – аргинат гема. Действие основано на том, что гем, по механизму отрицательной обратной связи блокирует трансляцию АЛК – синтазы, а, следовательно, падает синтез АЛК и ПБГ, чем и достигается купирование симптоматики. Врожденная эритропоэтическаяпорфирия
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 574; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.105.110 (0.014 с.) |

 http://www.nanoworld.org/russian/tef/nanopic/blood/blood.html
http://www.nanoworld.org/russian/tef/nanopic/blood/blood.html
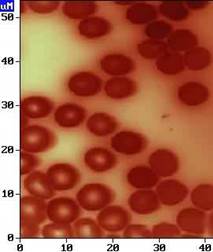 АСМ изображение эритроцитов (кровь бурундука).
Изображение предоставлено Николаем В.Корнеевым, НТ-МДТ, Москва, Россия.
АСМ изображение эритроцитов (кровь бурундука).
Изображение предоставлено Николаем В.Корнеевым, НТ-МДТ, Москва, Россия.








