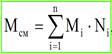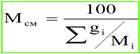Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярный объем, плотность, вязкость, сжимаемость, упругость насыщенных паров УВ газов.Содержание книги
Похожие статьи вашей тематики
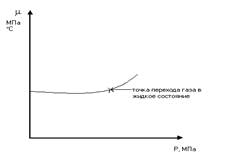
Поиск на нашем сайте Упругость насыщенных паров УВ-ых газов - это то минимальное давление, при кот. газ начин. переходить в жидкое состояние Ру [Па, МПа] Упругость насыщенных паров увеличивается с увеличением t и она тем больше, чем меньше плотность газов. С ростом молекулярного веса упругость насыщенных паров уменьшается Примеры: 1. бутан С4Н10- 0,22МПа 2. пропан С3Н8- 0,82МПа 3. этан С2Н8- 4,0 МПа 4. метан СН4- 27,0МПа Плотность газа – это масса газа в единицу объема, измеряется в кг/м3, но часто пользуются относительной плотностью газа. За относительную плотность газа принимается число, показывающие во сколько раз масса рассматриваемого газа> или< массы сухого воздуха, заключ. В один и тот же объём при н.у. (0 0С; 0,1 МПа.) a = rг / rв Чем > молекулярная масса газа, тем > его плотность. Значение относительных плотностей a для некоторях газов. N2, СО2 - 0,97 СО2 - 0,518 Н2S - 1,191 СН4 - 0,55 С3Н8 - 1,52 С4Н10 - 2,007 Воздух - 1 Плотность газов измеряют специальными газовыми пикнометрами или эффузивным способом, основанным на измерении скорости истечения газов из калиброванных отверстий, при этом отмечается следующее равенство
Плотность газов зависит от t-ры и давления. С увеличением t-ры плотность газов уменьшится, с ростом Р и молекулярной массы плотность увеличивается. Сведения о плотности газов использ. для опред-ия массы газа по объему и наоборот. Вязкость УВ газов - характеризует силу внутреннего трения. Различают динамическую и кинематическую вязкость, кот. связаны м/у собой следующим отношением:
u- [м2/с]-кинематическая вязкость m-[Па*с]- динамическая вязкость Вязкость газа зависит от t, P и природы самого газа. Закономерности изменения в. газов от указанных параметров можно объяснить исходя из некот. положений кинетич. теории газов. Так известно, что вязкость
r-плотность газа V - ср. скорость движения молекул газа l-ср. скорость длина свободного пробела молекул m-динамич. вязкость Согласно ф-ле (2) с повышением Р плотность газа увеличивается, но при этом уменьшается средняя длина свободного пробега молекул, а средняя их скорость не изменяется, поэтому с увеличением Р динамич. вязкость газа в начале практически остается постоянной.
При высоких давлениях это нарушается, т.к. газ по своим св-ам приближается к жидкостям. Из формулы (2) видно, что с увеличением t-ры вязкость газа должна возрастать, т.к. ср. скорость движения молекул увелич-ся, а плотность и ср.длина пробега остаются постоянными, при неизменном объеме газа. С повышением t-ры увеличивается скорость и количество движения передаваемого из слоя в слой в ед. времени и следует, что больше будет вязкость.
Однако с повышением Р эти закономерности нарушается. При высоких Р с увеличением t вязкость газов изменяется аналогично изменению вязкости ж-ти, т.е. вязкость снижается. В сжатом газе перелет молекул в движущиеся др. относительно др. слои затруднен и передача кол-ва движения из слоя в слой происходит в основном как у ж-тей, за счет временного объединения молекул на границе слоев. При увеличении t ухудшаются усл-ия для объед-я молекул. В следствии увеличения скоростей их движ-и и поэтому вязкость сильно сжатых газов уменьшается с ростом t-ры. С увеличением молекулярной массы газа вязкость его возрастает. Для определения вязкости газов используются следующие методы: 1. капиллярный 2. м-д измерения ск-ти падения шарика в исследован.газе. 3. м-ды, основан. на измерении ск-ти вращения цил-ров и затухания вращ-ых колебаний дисков 4. рассчетные м-ды Молекулярная масса смеси рассчитывается по принципу аддитивности:
Мi – молекулярный вес i-го компонента; gi – весовая доля; Ni – мольная доля. Молярный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул. Согласно закону Авогадро, для любого газа при нормальных условиях эта величина имеет универсальное значение 22,4 л/моль. При повышенном давлении газ сжимается. За счёт направленности связи С-Н происходит перераспределение электронной плотности, и молекулы газов начинают притягиваться друг к другу (физическое взаимодействие). Для учёта этого взаимодействия в уравнение (2.18) вводится коэффициент сверхсжимаемости z, предложенный голландским физиком Ван-дер-Ваальсом, учитывающий отклонения поведения реального газа от идеального состояния: PV = zQRT Q – количество вещества, моль; z – коэффициент сверхсжимаемости. Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Менделеева - Клайперона для высоких давлений. Коэффициент z зависит от давления и температуры (приведенных, критических давлений и температуры), природы газа. Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние. Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние.
38.Поверхностное натяжение и его зависимость от Т, Р и состава нефти. Методы его определения. σ на границе с различными технологическими жидкостями и практическое использование этих зависимостей.
|
||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 743; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.007 с.) |



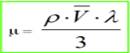 (2)
(2)