Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Специфические белки соединительной тканиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Коллаген - главный белок внеклеточного матрикса Коллагены - хорошо охарактеризованные фибриллярные белки, найденные у всех многоклеточных живых организмов. Они составляет 25% всех белков организма человека Коллагены секретируются как соединительнотканными клетками, так и различными другими типами клеток. Известно свыше 25 разных коллагеновых a-цепей, каждая из которых кодируется своими генами. Разные комбинации этих генов подвергаются экспрессии в разных тканях. Теоретически такое разнообразие может дать 10000 типов тройных спиралей в составе коллагена. Однако на сегодняшний день выделено всего лишь 15 типов коллагеновых молекул (изоколлагены). Сведения о некоторых из них упоминаются ниже в таблице 19.3. Таблица 20.3. Характеристика коллагенов
Изоколлагены типа I-III получили название фибрилл формирующих коллагенов, а изоколлагены типа IX и XII - фибрилл ассоциируемых коллагенами. Последние получили такое название, потому что они обычно связаны с коллагеновыми волокнами, которые образовали фибрилл формирующие коллагены. Они обеспечивают соединение волокон с другими молекулами матрикса. Тип IV и VII называют сеть формирующими коллагенами. Они образуют сетевидные структуры и, чаще всего, находятся в базальных мембранах, обеспечивая связь клеточных слоев эпителия с подлежащей соединительной тканью. Это особенно важно для кожи. У коллагенов особый тип пространственной организации Общие принципы организации молекул коллагенов хорошо прослеживаются в наиболее хорошо изученном коллагене кожи. На уровне первичной структуры каждую третью позицию в его полипептидной цепи занимает глицин. Наиболее популярной последовательностью аминокислотных остатков является трипептид ГЛИ-X-Y, где положение X и Y могут занимать любые аминокислоты. Чаще всего встречаются ПРО и гидроксиПРО. Кроме того, в этих местах может находиться ЛИЗ или гидроксиЛИЗ. Водородные связи, характерные для a спиралей, в коллагене не образуются.
Рис 20.5. G-X-Y- полипептид свернут в левозакрученную спираль. В отличие от a-спирали, найденной у многих глобулярных белков, для стабилизации этой структуры. водородные связи не используются.
Рис. 20.6. Триплетные повторы аминокислот в каждой из трех a-цепей коллагена. Атомы остатков ГЛИ показаны как маленькие шарики разных оттенков: черный - кислород; темно-серый - азот; белый - амидный водород. Необходимость в глицине в каждой третьей позиции в a-цепи основана на снижении стерического напряжения. Другие аминокислоты имеют большие боковые цепи и могут разрушить суперспиральную структуру.
Рис. 20.7. Каждая полоса в этой тройной спирали - это отдельная a-цепь коллагена.
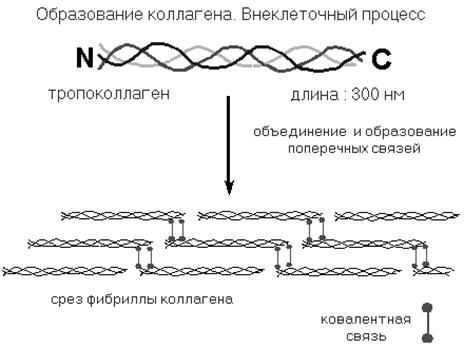
Полипептидная цепь молекулы представляет собой левозакрученную спираль с 3 аминокислотными остатками на каждый шаг спирали. Три полипептидные цепи сворачиваются в правозавернутую тройную суперспираль, образуя палочковидные молекулы диаметром 1,4 нм и длиной 300 нм. Размеры радикала глицина, самой популярной аминокислоты коллагена, способствуют образованию тройной спирали. Зрелый коллаген характеризуется низким содержанием серусодержащих и ароматических аминокислот.
Образование коллагеновых волокон - особый тип пострибосомального процессинга белковой молекулы Индивидуальные цепи коллагена синтезируются на рибосомах и переходят в пространство эндоплазматической сети в форме предшественников про-a-цепей, содержащих дополнительные пептиды на N и C концах.
Таблица 20.4. Порядок и локализация процессинга проколлагена
Гидроксилирование катализируется специфическими пролин и лизил- гидроксилазами, кофакторами которых являются аскорбиновая кислота, ионы Fe 2+, О2 и a-кетоглутаровая кислота. Гликозилирование гидроксилизина обеспечивается трансгликозидазами, субстратами которых являются УДФ-глюкоза и УДФ-галактоза. Дополнительные пептиды богаты цистеином. Они участвуют во внутриклеточном формировании тройных спиралей, тормозят образование фибрилл. Дело в том, что образование фибрилл внутри клетки могло бы быть катастрофой для неё. После секреции фибриллярные проколлагеновые молекулы теряют дополнительные пептиды, образуя молекулы коллагена, которые объединяются в волокна. Удаление дополнительных пептидов катализируют внеклеточные ферменты: проколлаген аминопептидаза и проколлаген карбоксипептидаза.
Рис. 20.8. После образования молекулы тропоколлагена, между модифицированными остатками лизина и 5-гидроксилизина замыкаются поперечные ковалентные связи. Такие поперечные связи стабилизируют фибриллы коллагена.
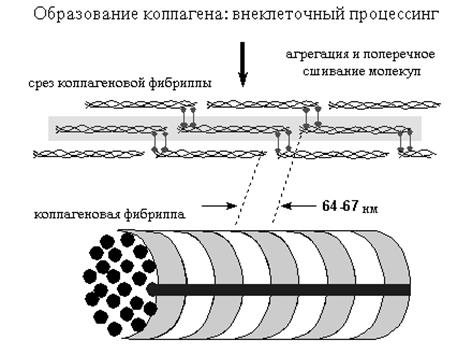
Рис. 20.9. Образование коллагеновых фибрилл
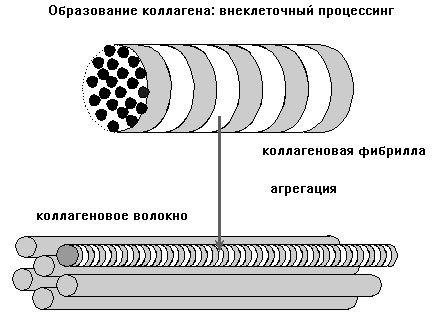
Рис. 20.10. Образование коллагеновых волокон
Процесс образования волокон основан на том, что растворимость коллагеновых молекул почти в 1000 раз меньше, чем молекул проколлагена. Это свойство обеспечивает их тенденцию к самоаггрегации. Фибриллы образуются вблизи клетки, на ее поверхности или, часто, в секретируемых пузырьках, сливающихся с мембраной клетки. Под электронным микроскопом коллагеновые волокна имеют поперечную исчерченность с периодом 67 нм. Причиной такой исчерченности является способ укладки молекул коллагена во время фибриллогенеза. Каждая соседняя молекула в фибрилле смещена на 1/4 своей длины относительно соседней. Образование поперечных ковалентных связей обеспечивает одно из важных свойств коллагеновых волокон - их механическую прочность. В качестве примера ферментативного обеспечения образования поперечных связей можно привести работу лизилоксидазы. Она катализирует окислительное дезаминирование e-аминогруппы лизина в составе молекул коллагена. Коферментом этого фермента является пиридоксальфосфат. В проявлении активности его важное место занимают ионы меди. Образующиеся в результате реакции альдегидные группы соседних молекул коллагена соединяются между собой, обеспечивая образование ковалентных связей между молекулами, фибриллами, волокнами.
О “возрасте” коллагена можно судить по его растворимости в солевых или кислых растворах На электрофореграмме солевого экстракта (0,14 М раствора NaCl) кусочка грануляционной ткани (ткань, образующаяся на месте повреждения) обнаруживаются две фракции с молекулярной массой, равной молекулярной массе одной цепи и - димеру a-цепей коллагена. Их обозначают a- и b-компоненты коллагена. Выход этих фракций повышается, если коллагены экстрагировать 0,45 М раствором NaCl. Если остаток после солевой экстракции обработать слабым раствором уксусной кислоты или цитратным буфером (рН 3.5-4.0), то в экстракте, где обнаруживаются в основном b-компоненты, появляется g-компонент, который соответствует тримеру полипептидных цепей. Остаток после кислотной обработки (нерастворимый коллаген) также можно попытаться растворить, используя более жесткие условия - нагревание в присутствии щелочи. Такое воздействие сопровождается переходом в раствор большого количества g-компонентов. По мере развития и “старения” грануляций соотношение икомпонентов в разных экстрактах изменяется. При этом в солевых экстрактах кислоторастворимого и "нерастворимого" коллагена уменьшается доля a-компонентов и увеличивается доля и компонентов.
Использование метки подтвердило представление о том, что a-компонент - это a-цепи “молодого” синтезированного коллагена, который еще не подвергался действию окидазы лизина. b-компоненты - это димеры a-цепей, сшитых ковалентно, а g-компонент - это тример цепей. Цепи, входящие в состав димеров (-компонент) и тримеров (-компонент) необязательно принадлежат одной молекуле коллагена и могут происходить из разных молекул, расположенных по соседству в фибриллах. Такие же изменения претерпевает и коллаген при нормальном “физиологическом” старении. “Молодой” коллаген содержит мало поперечных ковалентных связей и хорошо растворяется в солевых растворах, а “старение” - это процесс образования поперечных связей и уменьшение растворимости в солевых растворах. Описаны многочисленные нарушения (врожденные и связанные с влиянием внешних условий) процессинга коллагена. Некоторые из них приводятся в табл. 19.5.
Таблица 20.5. Заболевания, вызванные нарушением процессинга коллагена
Семейство эластина придает тканям эластичность
Способность соединительнотканных структур восстанавливать форму после механического воздействия связано с сетью эластических волокон, основой которых являются белки семейства эластина. Эластин - гидрофильный белок, содержащий в своем составе около 750 аминокислот. Подобно коллагену, в его молекулу входит необычно много пролина и глицина. Однако эластин не гликозилирован и содержит мало гидроксипролина и гидроксилизина. Основные различия между коллагеном и эластином приводятся в табл. 19.6.
Таблица 20.6. Отличительные признаки коллагена и эластина
Рис. 20.11. Структура десмозина Молекула эластина состоит из двух типов фрагментов чередующихся вдоль цепи: (1) гидрофобные сегменты, которые ответственны за эластические свойства молекулы и (2) сегменты, богатые аланином и лизином. Последние сегменты образуют спираль и участвуют в формировании поперечных связей между молекулами. По сути дела, в образовании поперечных связей участвуют десмозин или изодесмозин – продукты межмолекулярной конденсации лизинов. В образовании эластических волокон принимают участие большое число белков, объединенных в семейство эластина. Эластиновый остов волокна покрыт слоем микрофибрилл, имеющих диаметр 10 нм. Такие микрофибриллы встречаются в матриксе и без эластина. Они состоят из разных гликопротеинов, выполняющих важную роль в интеграции эластиновых волокон. Фибронектин - внеклеточный адгезивный белок, помогающий клеткам соединяться с матриксом
Рисунок 20.12. Схематическое изображение молекулы димера фибронектина. 2 полипептидные цепи сходны, но не идентичны. В области С-концевых отделов они соединены дисульфидными связями. В каждой цепи имеется по несколько глобулярных доменов, соединенных гибкими полипептидными сегментами. Эти домены могут специфически связываться с другими молекулами или клетками Внеклеточный матрикс содержит большое число адгезивных неколлагеновых белков, структурной особенностью которых является наличие доменов, способных специфически связываться с другими макромолекулами и рецепторами на поверхности клетки. Непременным компонентом доменов, обеспечивающих взаимодействие с клетками, является последовательность аминокислот арг-гли-асп (RGD). Фибронектин является высокомолекулярным гликопротеином. Он представляет собой димер двух больших субъединиц, соединенных парой дисульфидных связей на С-концах. Домены содержат небольшие модули, каждый из которых многократно повторяется и обычно кодируется отдельными экзонами. Главный модуль фибронектина, включающий 90 аминокислот, повторяется 15 раз в каждой субединице.
В семейство фибронектина входит фибриллин Относительно частым врожденным заболеванием, сопровождающимся поражением соединительной ткани, является синдром Марфана. При нем поражаются глаза (эктопия хрусталика), скелет (у многих больных развиваются длинные пальцы, арахнодактилия, разболтаны суставы) и сердечно-сосудистая система (слабость средней оболочки аорты, ведущая к расширению нисходящей аорты). Подобный синдром описан у президента США, А.Линкольна. В большинстве случаев заболевание развивается вследствие мутации гена (хромосома 15), кодирующего белок фибриллин. Фибриллин - это большой гликопротеин (ММ ~350000), который является структурным компонентом микрофибрилл, толщиной 10-20 нм, найденных в ряде тканей. Они обеспечивают образование эластиновых волокон. Фибриллин найден в хрусталике, периосте, он связан с эластиновыми волокнами в аорте. Такое расположение позволяет объяснить те нарушения, которые обнаруживаются при синдроме Марфана. Другой ген фибриллина обнаружен на хромосоме 5. Правда, дефекты в этом участке обнаружены у лиц с врожденной контрактурной арахнодактилией, но не с синдромом Марфана. Гликопротеины матрикса помогают клеткам выбирать пути миграции Фибронектин ускоряет клеточную миграцию, обеспечивая взаимодействие клеток с матриксом. Об этом свидетельствуют опыты, в ходе которых антитела против фибронектина, пептидов с RGD аминокислотными последовательностями и антитела против интегринов, рецепторов фибронектина, вызывали торможение миграции мезодермальных клеток в процессе гаструляции амфибий.
Более распространенным, чем фибронектин (особенно в матриксе эмбриональной ткани) является тенасцин. Тенасцин представляет собой высокомолекулярный гликопротеиновый комплекс, состоящий из 6 идентичных пептидных цепей, связанных между собой дисульфидными связями в форме морской звезды (рис. 19.13). Как и у фибронектина, каждая полипептидная цепь его состоит из нескольких коротких аминокислотных последовательностей, повторяющихся несколько раз, и имеет несколько разных функционально доменов. Одни из этих доменов связываются с трансмембранным протеогликаном - синдеканом, а другие связывают фибронектин В отличие от фибронектина тенасцин может и ускорять, и ингибировать клеточную адгезию в зависимости от типа клеток Адгезивная и антиадгезивные функции опосредуются разными доменами. Получены доказательства, что антиадгезивное взаимодействие играет важную роль в обеспечении перемещения клеток. В основе базальной мембраны лежит слоистая сеть, образованная коллагеном IV типа Внеклеточный матрикс может образовывать слоистые структуры - базальные мембраны. В ее создании принимают участие несколько типов специализированных молекул внеклеточного матрикса: коллаген IV типа, гепаран сульфат, ламинин и энтактин. Структура коллагена IV типа отличается большой гибкостью. Его тройная спираль прерывается в 26 местах участками аминокислотной последовательности неколлагенового типа. Из-за дополнительных неколлагеновых доменов на N- и C-концах полипептидов, образующих коллаген типа IV, его молекула длиннее (400 нм), чем у других коллагенов, формирующих фибриллы (300 нм). Двумерная сеточка этого коллагена - компонент внеклеточного матрикса или базальной мембраны, которая служит поверхностью для прикрепления большинства эндотелиальных и эпителиальных клеток или окружает мышечные и жировые клетки.
Рис. 20.14. Структурные особенности коллагена IV типа Коллаген IV типа (подобно фибриллассоциированным коллагенам) не теряет дополнительные пептиды после секреции. Эти пептиды способствуют образованию длинных фибрилл путем конденсации "бок в бок". Вначале идет соединение 2-х цепей С-концевыми отделами с образованием димеров, которые N-концами ассоциируются с 3-мя другими молекулами и такой способ распространяется в ширину. Результат такой ассоциации - подвижная многослойная структура, стабилизированная дисульфидными и другими ковалентными связями. При этом образуется нерастворимая сеть, к которой присоединяются другие молекулы.
Рис. 20.15. Механизм образования компонента внеклеточного матрикса - сеточки при участии коллагена IV типа В состав базальной мембраны, помимо коллагена IV типа, входят гепаран сульфат, ламинин и энтактин Базальная мембрана - это тонкая пластинка, толщиной 40-120 нм. Она расположена под слоем эпителиальных клеток и отделяет слой этих клеток от подлежащей соединительной ткани, или окружает отдельные мышечные, жировые и швановские клетки, или разделяет два слоя клеток (почки, легкие). В базальной мембране различают (электронная микроскопия) 2 слоя: электронопропускающий слой (lamina lucida), прилежащий к базальным участкам мембран эпителиальных клеток и электронноплотный слой (lamina densa), расположенный ниже предыдущего. В отдельных случаях можно выделить и третий слой, содержащий коллагеновые волокна подлежащей соединительной ткани. В базальной мембране кожи коллаген IV типа образует специальные адгезивные волокна. При тяжелом кожном заболевании, получившем название "пузырчатка", эти волокна отсутствуют, и эпидермис легко отделяется от соединительной ткани. Помимо коллагена IV типа из всех типов базальных мембран выделены гепарансульфатный протеогликан - перлекан и гликопротеины - ламинин и энтактин.
Рис. 20.16. Схема строения ламинина 1 - места соединения с клетками; 2 - места соединения с коллагеном IV типа; 3 - место связывания с гепарансульфатом; 4 - место связывания с гепарином.
Ламинин - один из первых белков внеклеточного матрикса у развивающегося эмбриона. Молекулярная масса ламинина около 8500000 Да. Он состоит из трех полипептидных цепей, организованных в форме крестообразной структуры, содержит несколько функциональных доменов. Один из них связывает коллаген IV типа, другой - гепарансульфат, два или более доменов связываются с поверхностью клеток. Молекула энтактина напоминает по форме гирю, связывается с одной молекулой ламинина в местах соединения длинной и коротких цепей ламинина. Энтактин соединяется также с молекулой коллагена, образуя дополнительную связь между ламинином и коллагеном.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 957; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.193.59 (0.012 с.) |