Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика и роль специфических белков мышечной ткани TnC, TnI, TnT, тропомиозина, актомиозина.Содержание книги
Поиск на нашем сайте
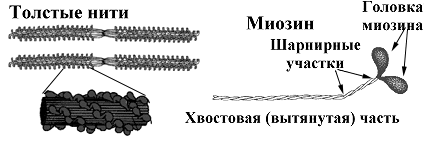
Основными белками мышц являются актин и миозин Массу мышечных фибрилл составляют вода (75%) и белки (более 20%). Основными представителями мышечных белков являются актин и миозин, среди которых на долю миозина приходится 55%. Этот белок (ММ 460 кДа) имеет форму асимметричного гексамера. Молекула миозина имеет вытянутую часть, состоящую из двух спиралей, накрученных одна на другую. Каждая спираль имеет на одном конце глобулярную головку. Гексамер (6 субъединиц) включает одну пару тяжелых цепей (ММ 200 кДа) и две пары легких цепей (ММ 15-27 кДа). Тяжелые цепи состоят из линейно вытянутого, a-спирализованного С-концевого домена (1300 аминокислотных остатков) и N-концевого домена глобулярной формы (около 800 аминокислотных остатков). Два a-спирализованных домена, принадлежащих двум тяжелым цепям, образуют вместе устойчивую суперспиральную структуру с двумя глобулярными головками (рис.17.8). Полная молекула миозина содержит также 4 сравнительно небольших полипептидных цепи (ММ 16-24 кДа), которые связаны с глобулярными головками. В отличие от актина миозин скелетных мышц обладает ферментативной активностью и катализирует гидролиз АТФ, связываясь с F-актином. Все легкие цепи связывают Са2+, фосфорилируются с помощью специальной киназы и, в целом, принимают участие в регуляции активности миозиновой АТФ-азы.
Рис.17.8. Схематическое изображение строения толстых нитей. Показана пространственная конфигурация миозина.
В молекуле миозина имеются несколько важных в функциональном отношении участков. Недалеко от середины линейной суперспирализованной зоны находится место, в котором происходит расщепление молекулы под действием трипсина. Этот фермент как бы разрезает молекулу на 2 части: одна содержит глобулярные головки и некоторую часть суперспирализованной зоны; другая состоит из оставшейся порции суперспирализованной зоны со стороны С-конца. Часть, содержащая головку, получила название "тяжелый меромиозин" (ММ 350 кДа). С-концевой фрагмент называется "легкий меромиозин" (ММ 125 кДа). Значение места действия трипсина на молекулу миозина заключается в том, что оно удивительно совпадает с тем местом в молекуле миозина, которое работает как своеобразный шарнир, превращая химическую энергию АТФ в чисто механическое явление сокращения - расслабления. Другой важный участок, выполняющий аналогичную роль, подвержен действию ещё одного протеолитического фермента - папаина. Папаин разрезает молекулу миозина очень близко к глобулярным головкам. Получается два фрагмента и именно тот из них, где находится головка, проявляет АТФ-азную активность.
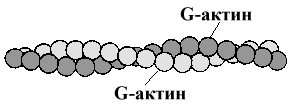
Из миозина образуются толстые нити. Толстая нить состоит, приблизительно, из 400 молекул миозина, по 200 с каждой стороны от М-линии. Эти молекулы удерживаются в связке с помощью С белка ("скрепочного" белка), белка М-линии и гидрофобного взаимодействия между собой. В точке, локализованной в месте действия трипсина, тяжелый меромиозин отклоняется от основной оси толстой нити, образуя острый угол. Благодаря этому головка тесно сближается с актином тонких нитей, локализованных в пространстве между толстыми нитями. Важнейшим молекулярным событием, предшествующим мышечному сокращению, является регулируемое связывание головок миозина с актином тонких нитей. В последующем происходит быстрое изменение конформации миозина вокруг уже упоминавшихся своеобразных "шарнирных" точек, и связанный актин перемещается в направлении М-линии. Доля актина в общей массе мышечных белков составляет 25%. Это глобулярный белок-мономер с ММ 43 кДа, получивший название G-актин. В присутствии ионов магния и физиологической концентрации ионов в растворе G-актин полимеризуется с образованием нерастворимой нити., которая называется F-актин (рис.17.9). Два F-актиновых полимера накручиваются друг на друга в виде спирали. Так формируется основная структура тонкой нити. Волокно F-актина имеет толщину 6-7 нм и повторяющуюся структуру с периодичностью 35,5 нм. Ни G-, ни F-актин не обладают никакой каталитической активностью.
Рис. 17.9. Структура F-актина
Каждая субъединица G-актина имеет центр связывания АТФ/АДФ, который принимает участие в полимеризации тонкой нити. После окончания полимеризации тонкая нить покрывается и стабилизируется белком - b-актинином. Вдобавок к центру связывания нуклеотидов на каждой молекуле G-актина имеется высокоаффинный центр связывания головки миозина. Регуляцию его работы в скелетной и сердечной мышцах осуществляют дополнительные белки тонкой нити. Таким образом, дополнительные белки контролируют сократительный цикл.
|
||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 507; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.190.247 (0.008 с.) |