Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гиалуронат обеспечивает клеточную миграцию во время морфогенеза и заживленияСодержание книги
Поиск на нашем сайте
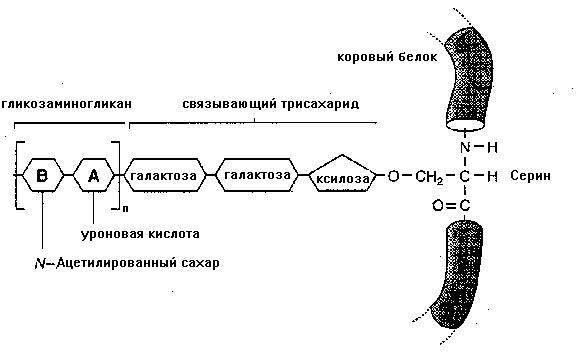
Гиалуронан (гиалуроновая кислота или гиалуронат) наиболее простой из ГАГ. Он состоит из повторяющихся (до 250000) несульфированных дисахаридных единиц и обнаружен во всех тканях и жидкостях во все стадии развития животных. Это наиболее ранняя эволюционная форма ГАГ и, возможно, поэтому не может служить типичным примером их строения. Гиалуроновая кислота не содержит в своем составе сульфата, может образовываться прямо на поверхности клеток комплексами ферментов, погруженных в плазматическую мембрану клеток. Она не всегда соединена с белками, а если и соединяется, то эта связь нековалентная. Гиалуронан синтезируется на базальной стороне эпителиального слоя и часто служит для создания свободного от клеток пространства, по которому потом мигрируют клетки во время морфогенеза и заживления ран. ГАГ, содержащие сульфат - относительно небольшие молекулы Хондроитинсульфаты (ХД-4-S, ХД-6-S). ПГ, содержащие ХДС с О-гликозидной связью, обнаружены в хряще. Каждая цепь содержит до 40 дисахаридных единиц с ММ около 20000-50000. Хондроитинсульфаты локализуются в местах кальцификации в эндохондральной кости. Протеогликан, содержащий хондроитин сульфаты, обнаружен в некоторых нейронах и может исполнять роль эндоскелетной структуры, поддерживая форму нейрона. Дерматансульфат. Широко распространен в животных тканях. Структурно подобен ХДС и гепарансульфату. В отличие от ХДС вместо глюкуроновой кислоты в 1-3 связи с N-ацетилгалактозамином содержит идуроновую кислоту. Дерматансульфат в склере придает ей прочность, участвуя в поддержке формы глаза. Кератансульфаты I и II. Они построены из повторяющихся дисахаридов, включающих галактозу и N-ацетилглюкозамин. Галактоза и глюкозамин в составе этих дисахаридов сульфатированы. Они отличаются также типом соединения с белком. Кератансульфат 1 и дерматансульфат присутствуют в роговице. Они располагаются между коллагеновыми волокнами и играют важную роль в прозрачности роговицы. Гепарин. Состоит из глюкозамина и двух типов уроновых кислот: глюкуроновой и идуроновой. Большая часть аминогрупп глюкозамина сульфатирована и меньшая - ацетилирована. Идуроновая кислота образуется из глюкуроновой уже после сборки молекулы гепарина при участии специальных ферментов эпимераз. В тканях входит в состав протеогликана. Уникально строение белковой части этих ПГ. Она богата такими аминокислотами как СЕР и ГЛИ. Гепарин выделен из гранул тучных клеток, а также из печени, легких и кожи. Гепарин является важным антикоагулянтом. Он связывается с факторами IX и XI, но наиболее важным является его взаимодействие с антитромбином III. Связываясь с ним в соотношении 1:1, гепарин резко усиливает ингибирующее действие антитромбина. Это связано с тем, что гепарин изменяет конформацию белка, усиливая взаимодействие с сериновыми пептидазами. Гепарин известен также как соединение, способное специфически связываться с липопротеинлипазой на стенках капилляров, вызывая выход фермента в кровоток и усиливая катаболизм хиломикронов. Гепарансульфат. Встречается преимущественно на клеточной поверхности. В отличие от гепарина в нем преобладает мало сульфатированный глюкозамин и глюкуроновая кислота. Протеогликаны построены из цепей ГАГ, связанных ковалентно с "коровыми" белками Обычно все ГАГ находятся в тканях в составе протеогликанов, где они соединены ковалентно с белками (их также называют "коровые белки ", core - англ., основа, ядро), синтезируемыми большинством клеток. Выделяют 3 типа связи между ГАГ и "коровыми" белками: · О-гликозидная связь между ксилулозой и СЕР. Это уникальная для ПГ связь. Она характерна для большинства ПГ и образуется в пострибосомальном процессинге ПГ путем переноса ксилулозы на СЕР корового белка. Субстратом для такого переноса служит УДФ-ксилулоза. Затем к ксилулозе добавляются 2 остатка галактозы, образуя связующий трисахарид. Цепь ГАГ растет путем постепенного наращивания указанного трисахарида. · О-гликозидная связь между N-ацетилгалактозамином и СЕР (ТРЕ), характерна для присоединения кератансульфата. Донором галактозамина является УДФ-N-ацетилгалактозамин.
Рис. 20.2. Схематическое строение протеогликанов · N-гликозиламинная связь между N-ацетиллюкозамином и амидным азотом АСН. В образовании этого типа связи, возможно, участвует долихолпроизводные олигосахариды (см. ниже). Таблица 20.1. Представители протеогликанов
Примечание: ХДС - хондроитинсульфат, ГС - гепарансульфат, ДС - дерматан сульфат, ФРФ - фактор роста фибробластов, TGF-b - трансформирующий фактор роста. Протеогликаны могут образовывать огромные полимерные комплексы с размерами, соизмеримыми с размерами бактерий, а соединяясь с другими белками, они образуют сложные структуры. Примером может служить базальная мембрана. Не все протеогликаны секретируются во внеклеточный матрикс. Находясь на поверхности клеток, они являются частью рецепторных комплексов. Другие ПГ являются интегральной частью плазматических мембран и имеют коровый белок, который пронизывает мембрану или соединен с липидами мембраны. ПГ могут быть компонентами внутриклеточных секреторных пузырьков, где способствуют упаковке и секреции молекул. Вдобавок они участвуют в регуляции активности секретируемых сигнальных молекул. Обусловлено это тем, что связывание с ПГ может ограничивать пространство действия таких молекул (локализация действия) или стерически блокировать их активность, создавать резервуар сигнальных молекул, пролонгируя их действие, защищать их от расщепления. Изменяя конформацию или концентрируя такие молекулы, ПГ способствуют их более эффективному действию (например, рецепторы на плазматической мембране клетки). На этих свойствах и механизмах основаны многообразные функции ПГ в организме. Являясь структурными компонентами внеклеточного матрикса, (1) они специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином, и другими белками. (2) Как полианионы они связывают поликатионы и катионы. (3) ПГ обеспечивают тургор различных тканей, (4) влияют на клеточную миграцию, (5) противостоят компрессионным силам в хрящевой ткани, (6) поддерживают прозрачность роговицы, (7) выполняют структурную роль в склере, (8) действуют как антикоагулянты. (9) Участвуя в формировании рецепторов на поверхности клеток, они обеспечивают взаимодействие между клетками. (10) ПГ регулируют фильтрацию в клубочках почек, (11) входят в состав синаптических и других везикул клеток. Гликопротеины и мукопротеины - 2 класса белково-углеводных комплексов, которые можно объединить в один Гликопротеины и мукопротеины -это белково-углеводные комплексы с ковалентно присоединенными углеводными цепями. Различия между ними касаются лишь количества углеводов в комплексе. Если у гликопротеинов углеводы составляют до 10%, то у мукопротеинов - до 50% от массы молекулы. Из состава глико- и мукопротеинов выделено 7 моносахаридов (табл.19.2). Таблица 20.2. Моносахариды глико- и мукопротеинов
Функции глико- и мукопротеинов: 1. Являются структурными компонентами мембраны клетки, коллагеновых, эластиновых и фибриновых волокон, костного матрикса 2. Защитные свойства: муцины выполняют роль смазочного материала, обусловливая уменьшение трения соприкасающихся поверхностей 3. Транспортные молекулы для витаминов, липидов, микроэлементов 4. Иммунная защита: иммуноглобулины, антигены гистосовместимости, комплемент, интерферон - вещества гликопротеиновой природы 5. Гормоны - гликопротеины: тиротропин, хорионический гонадотропин 6. Ферменты глико- и мукопротеиновой природы: гидролазы, нуклеазы, гликозидазы, факторы свертывания 7. Выполняют роль соединительного элемента в межклеточном взаимодействии 8. Лектины [3] Тип связи между белком и углеводом в БУК - результат разных механизмов синтеза В зависимостиот типа связи между углеводной и белковой частями БУК различают 2 типа БУК: (1) БУК с О-гликозидной связью между СЕР (ТРЕ) и N-ацетилгалактозамином, СЕР и ксилулозой или между гидроксилизином и галактозой (О-связанные БУК); (2) БУК с N- гликозидной связью между АСН и N-ацетилгалактозамином (N-связанные БУК). Полипептидные цепи (коровые белки) обоих типов БУК синтезируются на мембраносвязанных полирибосомах. Углеводная часть БУК образуется по двум механизмам. (1) Олигосахаридные цепи О-связанных БУК синтезируются путем постепенного добавления моносахаридов к образованной полипептидной цепи. Этот процесс катализируют мембраносвязанные гликозилтрансферазы. Образование одного типа связи требует отдельного специфического фермента (гипотеза одна связь - одна гликозилтрансфераза). Присоединение первого сахара происходит во время трансляции, а остальные добавляются ферментами, локализованными на эндоплазматической сети. Ферменты, присоединяющие последний сахар, локализованы в аппарате Гольджи.
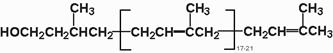
Образование олигосахаридной части N-связанных БУК происходит отдельно от белковой части. Ведущую роль в синтезе олигосахаридов занимает полиизопреновое соединение долихол (состоит 17-20 изопреновых единиц).
Рис. 20.4. Роль долихол фосфата в синтезе углеводной части БУК Долихолкиназа превращает долихол в долихолфосфат, который, в свою очередь, вступает в реакцию с УДФ-N-ацетил-глюкозамином с образованием долихол-пирофосфат-N-ацетил-глюкозамина. Затем к этому соединению присоединяется еще одна молекула N-ацетил-глюкозамина, 5 молекул маннозы (ГДФ-манноза как субстрат), затем еще 4 маннозы (донор маннозы долихол -манноза) и, наконец, добавляются 3 периферические остатка глюкозы (донор - долихол-глюкоза). Образованный олигосахарид переносится на АСН белка, расположенного на люминальной поверхности эдоплазматической сети. Катализируется этот процесс мембраносвязанным ферментом - олигосахарид трансферазой. АСН, с которым соединяется олигосахарид, входит в состав трипептида корового белка АСН-Y-СЕР (ТРЕ), где Y любая аминокислота кроме пролина или АСП. Гликозилируются, в основном, секретируемые белки. Белки цитозоля обычно не гликозилируются. Продукт трансферазной реакции, долихолдифосфат, превращается в долихолфосфат при помощи фосфатазы. Долихолфосфат вновь используется в реакциях переноса. Ряд соединений способны ингибировать различные этапы синтеза гликопротеинов. В экспериментах часто используют туникамицин, дезоксиноджиримицин и сваинсонин, которые оказывают влияние на гликозилирование. Например, если клетки растут в присутствии туникамицина, нарушается процесс гликозилирования. При этом увеличивается чувствительность таких белков к протеолизу, хотя механизмы секреции значительно не нарушаются. Нарушение распада белково-углеводных комплексов проявляется тяжелыми заболеваниями Распад белково-углеводных комплексов катализируется с участием большого набора лизосомальных гидролаз, включающих -нейраминидазу, -галактозидазу, -гексозаминидазу, - и -маннозидазы, -фукозидазу, эндо- -N-ацетилглюкозаминидазу и аспартилглюкозаминидазу. Генетически детерминированный дефект указанных ферментов приводит к нарушению распада БУК. Накопление БУК в лизосомах приводит к различным заболеваниям. Основными признаками болезней, связанными с недостаточностью гликозидаз, являются: (1) аутосомно-рецессивное наследование; (2) различные проявления и нарушения психики; (3) вакуолизация некоторых клеток, видимая под микроскопом; (4) присутствие ненормальных продуктов распада в моче. Диагностика основана на исследовании активности соответствующих ферментов (чаще всего в лейкоцитах). В ряде случаев возможна пренатальная диагностика путем анализа соответствующих ферментов в амниотической жидкости и крови матери. Из наиболее известных заболеваний этого типа можно выделить маннозидозы, фукозидозы, сиалидозы и аспартилглюкозаминурию. Их причиной является недостаточность соответственно a-маннозидазы, -фукозидазы, нейраминидазы и аспартилглюкозаминидазы. Эти заболевания имеют самые разные проявления, иногда их относят к муколипидозам.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 563; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.011 с.) |