Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Каждый тип соединительной ткани имеет свои специфические наборы молекулСодержание книги
Поиск на нашем сайте
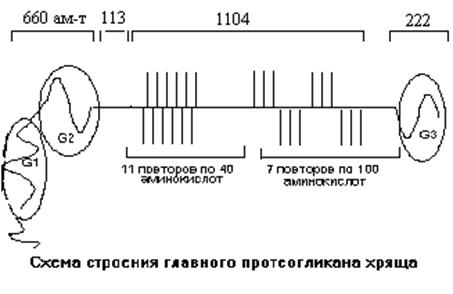
Химические компоненты хряща Одним из главных химических компонентов хряща является тип II коллагена. Другим важным компонентом является специфический для хряща протеогликан. Конечная функция хряща определяется функцией этих 2 основных типов молекул. Коллагеновые волокна, прочные на разрыв, усиливают механические свойства довольно непрочного протеогликана. Ориентация коллагеновых волокон определяется направлением воздействий, которым эта ткань противостоит. Протеогликан образует гель, который в 5 раз больше по объему в воде, чем в окружении коллагена. Причем, возможности связывания воды гелем зависят от взаимодействия между этими двумя основными белками хряща. Не исключено, что на это свойство влияют и другие белки хряща. Главный коллагеновый белок хряща - коллаген II типа [a(II)]3.Он состоит из 3 одинаковых a-цепей, гомологичных по аминокислотному составу a-цепям коллагена кожи. Коллаген II типа относится к классу главных структурных коллагенов, для которых характерно образование поперечно исчерченных прочных фибрилл. Его волокна разнообразны по диаметру, но, как правило, они тоньше волокон коллагена I типа и имеют больше поперечных ковалентных связей. Из хряща выделены и другие типы коллагена, которые составляют около 10 % от общего количества коллагена в хряще. Эти минорные коллагены отличаются по аминокислотному составу, молекулярной массе и свойствам. Их роль пока еще недостаточно хорошо выяснена. Главный протеогликан хряща занимает 5-10% от влажного веса хряща. К белковому компоненту протеогликана с ММ 210000 Да присоединяется ковалентными связями несколько типов боковых цепей. В белке ПГ выделяют несколько доменов. На N-конце имеется глобулярный домен (G1), имеющий одну одиночную и одну двойную петли. При помощи этого домена белковая цепь ПГ взаимодействует с гиалуроновой кислотой. Место контакта образовано из 5 дисахаридных структур гиалуроновой кислоты. Несколько таких белковых цепей ПГ могут взаимодействовать с одной молекулой гиалуроновой кислоты. Связь между белком и гиалуроновой кислотой усиливается при помощи специального связывающего белка. По своей структурной организации этот белок гомологичен домену белковой части ПГ, связывющемуся с гиалуроновой кислотой.
Рис. 20.17. Схематическое строение главного протеогликана хряща Подобного рода связывающие белки обнаружены и в других тканях. Они обеспечивают соединение гиалуроновой кислоты с белковыми цепями. Короткий линейный участок полипептидной цепи отделяет домен G1 от другого глобулярного домена (G2), который гомологичен домену G1, но не имеет третьей петли. Поэтому, несмотря на гомологичность, этот домен не может связываться с молекулой гиалуроновой кислоты. После домена G2 идет участок, богатый кератансульфатом. Он состоит из 23 повторяющихся шести аминокислотных участков, богатых ГЛУ и ПРО. СЕР этих повторов связан О-гликозидными связями с кератансульфатами. Вслед за богатой кератансульфатом областью расположена главная часть белка ПГ, состоящая из двух участков с разной аминокислотной последовательностью. Первый участок содержит 11 повторов по 40 аминокислот, в которых СЕР-ГЛУ последовательности, соединенные с хондроитин сульфатом, расположены без особой упорядоченности. Второй отрезок содержит 7 повторов по 100 аминокислот. Каждый повтор состоит из отрезка в 30 аминокислот и 7 участков по 10 аминокислот, в каждом из которых есть последовательность СЕР-ГЛУ. К ней обычно присоединена молекула ХДС. С-концевой отдел ПГ содержит третий глобулярный домен. Считают, что он гомологичен лектину, выделенному из печени, и может избирательно связываться с галактозой или фукозой. Характерной особенностью главного ПГ хряща является большое число отрицательно заряженных молекул. Неколлагеновые белки матрикса и низкомолекулярные протеогликаны В хряще можно найти специфические и общие для всех видов соединительной ткани белки. Из хрящевой ткани выделены два типа ПГ, содержащих хондроитин сульфат или дерматан сульфат небольшого размера. Белковые цепи этих ПГ гомологичны и содержат последовательности, богатые ЛЕЙ. В частности, такие последовательности содержит белок - фибромодулин. Он обнаружен во многих тканях, что указывает на схожесть их функций. Фибромодулин влияет на фибриллогенез. Он найден в коллагеновых волокнах костной ткани, где его рассматривают как основной регулятор фибриллогенеза. Еще два белка, бигликан и декорин, выделены из разных тканей и отличаются наличием последовательности СЕР-ГЛИ. Если назначение бигликана неизвестно, то декорин участвует в связывании с коллагенами I и II типов, а также ингибирует фибринолиз. Малые ПГ составляют лишь 1-2% от общей массы всех ПГ хряща. Белок с ММ 58 кДа. Этот основной белок был впервые изолирован из бычьего суставного хряща. Подобно другим белкам матрикса, он богат АСП, АСН, и ЛЕЙ. Предполагают, что он связывается с поверхностью клеток.
Другие белки, специфичные для хрящевой ткани Белок хрящевого матрикса с ММ 148 кДа. Этот белок выделяется совместно с главным ПГ хряща. Он состоит из 3-х субъединиц по 54000 Да, связанных S-S связями. Он обладает основными свойствами. В нем обнаружены домены, гомологичные эпидермальному фактору роста. Возможно, он ковалентно связан с белком большого ПГ, поскольку его трудно отделить от ПГ. Функция белка пока неизвестна. Хрящевой олигомерный высоко молекулярный белок матрикса. Выделен из суставного хряща. Содержит несколько субъединиц с ММ 100 кДа. Значительная часть этого белка может быть выделена из растворов с высокой ионной силой, что говорит о его слабой связи с белками матрикса. В основном, встречается в суставном хряще: Белок с ММ 36 кДа. Он найден также в костях, но не открыт в других типах соединительной ткани. До 25% всех аминокислот приходится на АСП, АСН и ЛЕЙ. В своем составе не содержит углеводов. Место расположения в хряще неизвестно, выделяется при экстракции гуанидином (4 М). Может связываться с хондроцитами. Анхорин. Этот белок (ММ 34000) специфически соединяется с коллагеном второго типа, содержит в своем составе 329 аминокислот. Он обнаружен на поверхности хондроцитов и гомологичен внутриклеточным белкам, связывающим кальций. Анхорин содержит 4 внутренних повтора по 70-80 аминокислот, не содержит сигнального пептида. Подобные белки синтезируются фибробластами. Главная функция анхорина заключается в прикреплении коллагена второго типа к поверхности хондроцитов. Это своеобразный механорецептор клетки. Через него на клетки может передаваться напряжение, прилагаемое к ткани. Хондрокальцин или С-концевой пропептид коллагена второго типа (ММ 35000 Да). Хрящ содержит небольшое количество этого белка, связанного с кристаллами гидроксиапатита. Экстрагируется солевыми растворами. В хряще участвует в процессах минерализации. Белок с ММ 21 кДа. Маленький белок, богатый АСН, АСП, ГЛУ, ГЛН, ЛЕЙ. Синтезируется гипертрофными хондроцитами и, возможно, связан с коллагеном Х, специфичным для таких хондроцитов.
|
||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 366; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.70.138 (0.006 с.) |