
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Последовательность событий передачи сигнала первичных мессенджеров с помощью инозитолфосфатной системыСодержание книги
Поиск на нашем сайте
Связывание активатора инозитолфосфатной системы с рецептором (R) приводит к изменению его конформации. Повышается сродство рецептора к Gфлс-белку. Присоединение комплекса первичный мессенджер-рецептор к Gфлс-ГДФ снижает сродство афлс-субъединицы к ГДФ и увеличивает сродство к ГТФ. В активном центре афлс-субъединицы ГДФ замещается на ГТФ. Это вызывает изменение конформации субъединицы афлс и снижение сродства к субъединицам βγ, происходит диссоциация Gфлс-белка. Отделившаяся субъединица афлс-ГТФ латерально перемещается по мембране к ферменту фосфолипазе С. Взаимодействие афлс-ГТФ с центром связывания фосфолипазы С изменяет конформацию и активность фермента, возрастает скорость гидролиза фосфолипида клеточной мембраны - фосфатидилинозитол-4,5-бисфосфа- та (ФИФ2) (рис. 4.14).
В ходе реакции образуются два продукта - вторичные вестники гормонального сигнала (вторичные мессенджеры): диацилглицерол, который остается в мембране и участвует в активации фермента протеинкиназы С, и инозитол-1,4,5-трифосфат (ИФ3), который, будучи гидрофильным соединением, уходит в цитозоль. Таким образом, сигнал, принятый рецептором клетки, раздваивается. ИФ3 связывается специфическими центрами Са2+- канала мембраны эндоплазматического ретикулума (Э)), что приводит к изменению конформации белка и открытию Са2+-канала. Так как концентрация кальция в ЭР примерно на 3-4 порядка выше, чем в цитозоле, после открытия канала Са2+ по градиенту концентрации поступает в цитозоль. В отсутствие ИФ3 в цитозоле канал закрыт. В цитозоле всех клеток содержится небольшой белок кальмодулин, имеющий четыре центра связывания Са2+. При повышении концентрации кальция он активно присоединяется к кальмодулину, образуя комплекс 4Са2+-кальмодулин. Этот комплекс взаимодействует с Са2+-кальмодулинзависимыми протеинкиназами, другими ферментами и повышает их активность. Активированная Са2+-кальмодулин-зависимая протеинкиназа фосфорилирует определенные белки и ферменты, в результате чего изменяется их активность и скорость метаболических процессов, в которых они участвуют. Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С (ПКС). Связывание ПКС с ионами кальция стимулирует перемещение белка к плазматической мембране и позволяет ферменту вступать во взаимодействие с отрицательно заряженными «головками» молекул фосфатидилсерина (ФС) мембраны. Диацилглицерол, занимая специфические центры в протеинкиназе С, в еще большей степени увеличивает ее сродство к ионам кальция. На внутренней стороне мембраны образуется активная форма ПКС (ПКС? Са2+? ФС? ДАГ), которая фосфорилирует специфические ферменты. Включение ИФ-системы непродолжительно, и после ответа клетки на стимул происходит инактивация фосфолипазы С, протеинкиназы С и Са2+-кальмодулин-зависимых ферментов. афлс-Субъединица в комплексе с ГТФ и фосфолипазой С проявляет ферментативную (ГТФ-фосфатазную) активность, она гидролизует ГТФ. Связанная с ГДФ афлс-субъединица теряет сродство к фосфолипазе С и возвращается в исходное неактивное состояние, т.е. включается в комплекс αβγ-ГДФ Gфлс-белок). Отделение афлс-ГДФ от фосфолипазы С инактивирует фермент и гидролиз ФИФ2 прекращается. Повышение концентрации Са2+ в цитозоле активирует работу Са2+-АТФаз эндоплазматического ретикулума, цитоплазматической мембраны, которые «выкачивают» Са2+ из цитозоля клетки. В этом процессе принимают участие также Na+/Са2+- и Н+/Са2+-переносчики, функционирующие по принципу активного антипорта. Снижение концентрации Са2+ приводит к диссоциации и инактивации Са2+-кальмодулинзависимых ферментов, а также потере сродства протеинкиназы С к липидам мембраны и снижению ее активности. ИФ3 и ДАГ, образовавшиеся в результате активации системы, могут снова взаимодействовать друг с другом и превращаться в фосфатидилинозитол- 4,5-бисфосфат. Фосфорилированные ферменты и белки под действием фосфопротеинфосфатазы переходят в дефосфорилированную форму, изменяется их конформация и активность. 5. Каталитические рецепторы. Каталитические рецепторы являются ферментами. Активаторами этих ферментов могут быть гормоны, ростовые факторы, цитокины. В активной форме - рецепторы-ферменты фосфорилируют специфические белки по -ОН-группам тирозина, поэтому их называют тирозиновыми протеинкиназами (рис. 4.15). При участии специальных механизмов сигнал, полученный каталитическим рецептором, может быть передан в ядро, где он стимулирует или подавляет экспрессию определенных генов.
Фосфопротеинфосфатаза дефосфорилирует специфические фосфопротеины. Фосфодиэстераза превращает цАМФ в АМФ и цГМФ в ГМФ. ГЛЮТ 4 - переносчики глюкозы в инсулинзависимых тканях. Тирозиновая протеинфосфатаза дефосфорилирует β-субъединицы рецептора инсулина Примером каталитического рецептора может служить рецептор инсулина, в состав которого входят две а- и две β-субъединицы. а-Субъединицы расположены на наружной поверхности клеточной мембраны, β-субъединицы пронизывают мембранный бислой. Центр связывания инсулина образован N-концевыми доменами а-субъединиц. Каталитический центр рецептора находится на внутриклеточных доменах β-субъединиц. Цитозольная часть рецептора имеет несколько остатков тирозина, которые могут фосфорилироваться и дефосфорилироваться. Присоединение инсулина в центр связывания, образованный а-субъединицами, вызывает кооперативные конформационные изменения рецептора. β-Субъединицы проявляют тирозинкиназную активность и катализируют трансаутофосфорилирование (первая β-субъединица фосфорилирует вторую β-субъединицу, и наоборот) по нескольким остаткам тирозина. Фосфорилирование приводит к изменению заряда, конформации и субстратной специфичности фермента (Тир-ПК). Тирозиновая-ПК фосфорилирует определенные клеточные белки, которые получили название субстратов рецептора инсулина. В свою очередь эти белки участвуют в активации каскада реакций фосфорилирования: • фосфопротеинфосфатазы (ФПФ), которая дефосфорилирует специфические фосфопротеины; • фосфодиэстеразы, которая превращает цАМФ в АМФ и цГМФ в ГМФ; • ГЛЮТ 4 - переносчиков глюкозы в инсулинзависимых тканях, поэтому повышается поступление глюкозы в клетки мышц и жировой ткани; • тирозиновой протеинфосфатазы, которая дефосфорилирует β-субъединицы рецептора инсулина; • регуляторных белков ядра, факторов транскрипции, повышающих или снижающих экспрессию генов определенных ферментов. Реализация эффекта ростовых факторов может осуществляться с помощью каталитических рецепторов, которые состоят из одной полипептидной цепи, но при связывании первичного мессенджера образуют димеры. Все рецепторы этого типа имеют внеклеточный гликозилированный домен, трансмембранный (а-спираль) и цитоплазматический домен, способный при активации проявлять протеинкиназную активность. Димеризация способствует активации их каталитических внутриклеточных доменов, которые осуществляют трансаутофосфорилирование по аминокислотным остаткам серина, треонина или тирозина. Присоединение фосфорных остатков приводит к формированию у рецептора центров связывания для специфических цитозольных белков и активации протеинкиназного каскада передачи сигнала (рис. 4.16). Последовательность событий передачи сигнала первичных мессенджеров (ростовых факторов) при участии Ras- и Raf-белков. Связывание рецептора (R) с фактором роста (ФР) приводит к его димеризации и трансаутофосфорилированию. Фосфорилированный рецептор приобретает сродство к Grb2-белку. Образованный комплекс ФР*R*Grb2 взаимодействует с цитозольным белком SOS. Изменение конформации SOS обеспечивает его взаимодействие с заякоренным белком мембраны Ras-ГДФ. Образование комплекса ФР?R?Gгb2?SOS?Ras-ГДФ снижает сродство Ras- белка к ГДФ и увеличивает сродство к ГТФ. Замена ГДФ на ГТФ изменяет конформацию Ras-белка, который отделяется от комплекса и взаимодействует с Raf-белком в примембранной области. Комплекс Ras-ГТФ?Raf проявляет протеинкиназную активность и фосфорилирует фермент МЕК-киназу. Активированная МЕК-киназа в свою очередь фосфорилирует МАП-киназу по треонину и тирозину.
Рецепторы такого типа имеют эпидермальный фактор роста (ЭФР), фактор роста нервов (ФРН) и другие ростовые факторы. Grb2 - протеин, взаимодействующий с рецептором ростового фактора (growth receptor binding protein); SOS (GEF) - ГДФ-ГТФ обменный фактор (guanine nucleotide exchange factor); Ras - G-белок (гуанидинтрифосфатаза); Raf-киназа - в активной форме - фосфорилирующая МЕК-киназу; МЕК-киназа - киназа МАП-киназы; МАП-киназа - митогенактивированная протеинкиназа (mitogen-aktivated protein kinase) Присоединение группы -РО32- к аминокислотным радикалам МАП-киназы изменяет ее заряд, конформацию и активность. Фермент фосфорилирует по серину и треонину специфические белки мембран, цитозоля и ядра. Изменение активности этих белков оказывает влияние на скорость метаболических процессов, функционирование мембранных транслоказ, митотическую активность клеток-мишеней. Рецепторы с гуанилатциклазной активностью также относятся к каталитическим рецепторам. Гуанилатциклаза катализирует образование из ГТФ цГМФ, который является одним из важных мессенджеров (посредников) внутриклеточной передачи сигнала (рис. 4.17).
Мембранно-связанная гуанилатциклаза (ГЦ) - трансмембранный гликопротеин. Центр связывания сигнальной молекулы находится на внеклеточном домене, внутриклеточный домен гуанилатциклазы в результате активации проявляет каталитическую активность Присоединение первичного мессенджера к рецептору активирует гуанилатциклазу, которая катализирует превращение ГТФ в циклический гуанозин-3',5'-монофосфат (цГМФ) - вторичный мессенджер. В клетке повышается концентрация цГМФ. Молекулы цГМФ могут обратимо присоединяться к регуляторным центрам протеинкиназы G (ПКЧ5), которая состоит из двух субъединиц. Четыре молекулы цГМФ изменяют конформацию и активность фермента. Активная протеинкиназа G катализирует фосфорилирование определенных белков и ферментов цитозоля клетки. Одним из первичных мессенджеров протеинкиназы G является предсердный натриуретический фактор (ПНФ), регулирующий гомеостаз жидкости в организме. 6. Передача сигнала с помощью внутриклеточных рецепторов. Гидрофобные по химической природе гормоны (стероидные гормоны и тироксин) могут диффундировать через мембраны, поэтому их рецепторы находятся в цитозоле или ядре клетки. Цитозольные рецепторы связаны с белком-шапероном, который предотвращает преждевременную активацию рецептора. Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНКсвязывающий домен, обеспечивающий в ядре взаимодействие комплекса гормон-рецептор с регуляторными участками ДНК и изменение скорости транскрипции.
|
||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 175; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.27.225 (0.008 с.) |

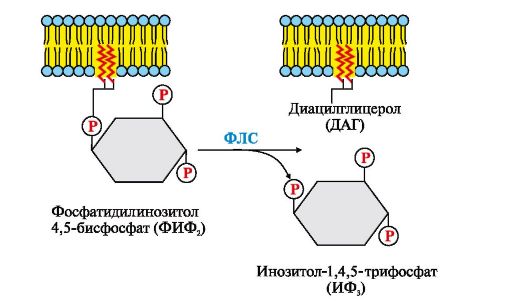 Рис. 4.14. Гидролиз фосфатидилинозитол-4,5-бисфосфата (ФИФ2)
Рис. 4.14. Гидролиз фосфатидилинозитол-4,5-бисфосфата (ФИФ2)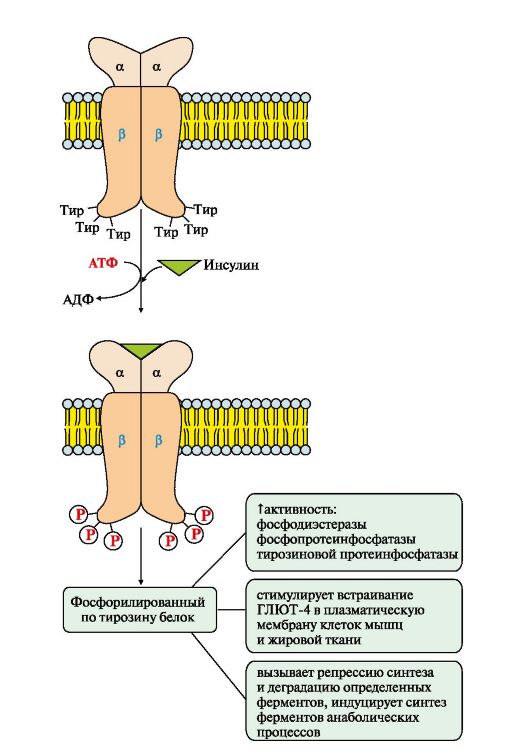 Рис. 4.15. Активация рецептора инсулина.
Рис. 4.15. Активация рецептора инсулина.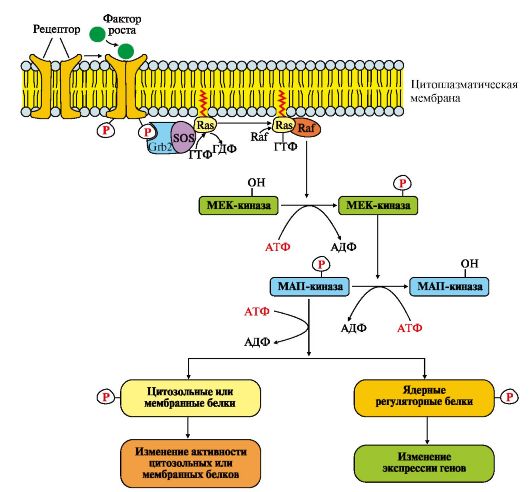 Рис.4.16. МАП-киназный каскад.
Рис.4.16. МАП-киназный каскад.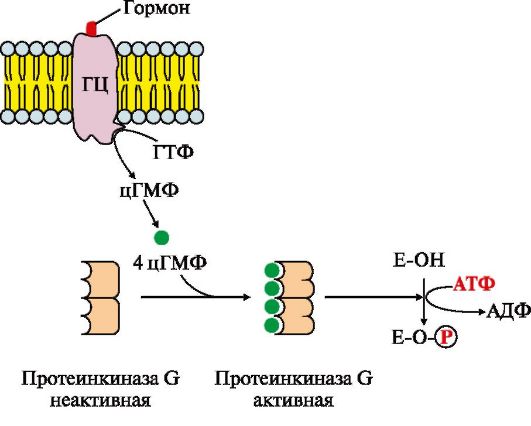 Рис. 4.17. Регуляция активности мембранной гуанилатциклазы.
Рис. 4.17. Регуляция активности мембранной гуанилатциклазы.


