
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
На аноді відбувається в першу чергу процес окиснення часток, електродний потенціал яких менший.
Можливі анодні процеси при електролізі водних розчинів: 1) окиснення молекул води (рН £ 7): 2Н2О - 4ē → О2 + 4Н+; Е0 =+ 1,23 (В); 2) окиснення ОН 4ОН 3) аніони кислот відповідно електроокисненню поділяють на дві групи: а) аніони, що не мають оксигену (Cl б) аніони оксигеновмісних кислот (SO4 4) розчинення анода: Mе0 Розрізняють розчинні електроди (Cu; Zn і т.д.) та інертні електроди (C; Au; Pt). Розглянемо приклад електролізу розчину Купрум (ІІ) хлориду з розчинним мідним анодом: CuCl2 К H2O (E0 = - 0,83 В) H2O (E0 = +1,23В) Cu0 (E0 = + 0,34В) Cu0 (E0 = + 0,34В) На катоді відбувається процес На аноді відбувається процес відновлення часток з більшим окиснення часток з меншим потенціалом: потенціалом: Cu Цей спосіб використовують для електролітичного рафінування (очищення) металів у промислових умовах. Для того щоб відбулася розрядка йонів на електродах, до них треба докласти певну електрорушійну силу, яка дорівнює різниці потенціалів і називається потенціалом розкладання (Е0розкл.). Потенціал розкладання (Е0розкл.) повинен чисельно дорівнювати за модулем електрорушійній силі гальванічного елемента, складеного на основі йонів вихідних речовин і продуктів електролізу. Наприклад: розрахувати потенціал розкладання 1М розчину хлоридної кислоти. HCl ↔ H+ + Cl окисник К відновник А+ 2Cl Ерозкл = ЕРС = ЕК0 – ЕА0 = │0 – 1,36│ =1,36В. Послідовність розрядки йонів при електролізі може порушуватися через явище, назване перенапругою. Перенапруга дорівнює різниці між напругою, прикладеною до електродів, і ЕРСгальванічного елемента, що відповідає зворотній реакції. Тому, роблячи розрахунки реальних електрохімічних процесів, необхідно пам'ятати, що реальна різниця потенціалів при електролізі (Δ Е) складається з потенціалу розкладання (Е розкл.), ЕРС для подолання опору електроліту, суми катодної й анодної перенапруги, що обумовлені побічними процесами, що відбуваються на електродах, такими як:
- підхід йона до електрода; - втрата йоном гідратної оболонки (у розчині); - розрядка йона; - рекомбінація атомів у молекули; - відхід молекули від електрода. ΔЕрозкл. = Ерозкл. + IR + ΔЕполяриз. + ΔЕконтакт.,, де I – сила струму при електролізі; R – опір систем; Δ Е поляриз. – різниця потенціалів поляризації, що перешкоджає проходженню струму; Δ Е конт. – сума контактних потенціалів. R – загальний опір системи, що дорівнює сумі опорів електроліту, діафрагми електролізера і токопідводів до електролізеру. Досвід показує, що потенціали виділення металів Е (Me Крім газової поляризації, розрізняють: - концентраційну – за рахунок зміни концентрації в приповерхневому шарі електрода, якщо анод мідний, то концентрація Cu - хімічну – виникає внаслідок того, що виділення продуктів електролізу приводить до утворення гальванічного ланцюга (йде зворотна електролізу реакція). Кількісні співвідношення при електролізі встановлені в 1827-му р. англійським фізиком Майклом Фарадєєм.
§ 11.2. ЗАКОНИ ФАРАДЕЯ 1-й закон:
|
|||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 74; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.214.215 (0.008 с.) |
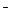 йонів (рН ≥ 7):
йонів (рН ≥ 7): 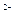 ) і легко окиснюються: 2I
) і легко окиснюються: 2I 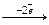 I2; E0 = +0,54 (B);
I2; E0 = +0,54 (B);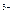 ) утримують електрони сильніше, ніж молекули води, тому на аноді окиснюється вода за наведеною вище схемою;
) утримують електрони сильніше, ніж молекули води, тому на аноді окиснюється вода за наведеною вище схемою;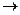 Ме
Ме 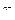 +n ē.
+n ē.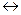 Cu
Cu 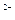 + 2Cl
+ 2Cl 
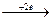 Cu0 Cu0
Cu0 Cu0 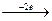 Cu
Cu 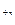 ) приблизно дорівнюють їх електродним потенціалам, а Е виділення газів значно більше їх електродних потенціалів. Це так звана газова поляризація, тобто утворення на електродах «газової шуби» за рахунок виділення водню на катоді, а кисню – на аноді чи інших газів. Газова поляризація може зупинити процеси, що проходять при електролізі, через ізоляцію електродів. Її негативний вплив може бути усунуто додаванням у розчин окисників водню – K2Cr2O7, KMnО4
) приблизно дорівнюють їх електродним потенціалам, а Е виділення газів значно більше їх електродних потенціалів. Це так звана газова поляризація, тобто утворення на електродах «газової шуби» за рахунок виділення водню на катоді, а кисню – на аноді чи інших газів. Газова поляризація може зупинити процеси, що проходять при електролізі, через ізоляцію електродів. Її негативний вплив може бути усунуто додаванням у розчин окисників водню – K2Cr2O7, KMnО4 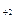 у анода більше, ніж у катода. Для усунення такої поляризації необхідно перемішувати електроліт;
у анода більше, ніж у катода. Для усунення такої поляризації необхідно перемішувати електроліт;


