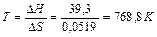Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика р ішення задач з застосуванням алгоритм івСодержание книги
Поиск на нашем сайте
Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів” Щоб розв’язати задачи з зазначеної вище теми, потрібно засвоїти визначення еквівалентів (Е), молярних мас еквівалентів (mе), молярних об’ємів еквівалентів (Ve) простих (металів і неметалів) та складних (оксидів, основ, кислот і солей) речовин, а також вивчити основні закони хімії, зокрема закон еквівалентів. Треба також знати математичний запис закону еквівалентів:
Алгор итм розв ’ язання задач 1. Визначити умови задачи, тобто як виражена кількість речовин: в молях, грамах, літрах та інше. 2. Вибрати з написанних вище формулу математичного вираження закону еквівалентів відповідну даним задачі. 3. Підставити данні задачи в вибрану формулу. 4. Знайти невідому величину (Мe, Ve). Якщо дана: 1)маса речовин, розрахунки вести згідно формули (1) 2)маса і об’єм речовин, використовувати формулу (2) 3) об’єм речовин, використовувати формулу (3). 5. По величинам Мe, Ve можна знайти Е, М, В, речовину, основність, кислотність. 5.1. Еквівалент (Е) з формули: 5.2. Молярну масу речовини (М). 5.3. Речовину, коли відома валентність (В) її, з формули:
5.4. Основність (для кислот) з формули:
5.5. Кислотність (для основ) з формули:
5.6. Визначив кислотність основ та основність кислот можна написати хімічне рівняння реакції між кислотою та основою.
Приклад роз’ язання задачі. На нейтралізацію 0,82 г Н3РО3 витрачено 1,12 г КОН. Знайти молярну масу еквіваленту (Ме), еквівалент (Е) та основність Н3РО3. Написати рівняння реакції, що відбувається. 1.Кількість речовини дана в грамах (m), тому вибираємо для розрахунків формулу (1) закону еквівалентів. 2.З цієї формули знаходим:
( 3.Знаходим: ( 4.З формули 5. Рівняння реакції буде Н3РО3+2КОН→К2НРО3+2Н2О
Методика рішення типових задач з теми: «Хімічна термодинаміка»
Щоб розв’язати задачи з зазначеної теми, треба знати, що визначають термодинамічні функції: внутрішня енергія (U), ентальпія (H), ентропія (S), вільна енергія Гіббса (G), закон Гесса та слідство з нього.
Для розвязання розрахункових задач часто користуються другим слідством з закону Гесса.
якщо
якщо DG<0, реакція може проходити в прямому напрямку в стандартних умовах (ст..у.);DG>0, реакція в прямому напрямку не йде, а може йти в ст.у. в зворотному напрямку; якщо DG=0, наступає рівновага (реакція починається).
Для рішення задач можна користуватися рівнянням Гіббса.
з цього рівняння можна знайти температуру (Т) рівноваги, чи температуру початку реакції, що за умови DG=0:
Алгоритм розв ’ язання. 1. Записати термохімічне рівняння реакції та дані задачі. 2. Вибрати з написаних вище формул необхідну, відповідно умовам задачі. 3. У вибрану формулу підставити табличні значення стандартних термодинамічних величин (DH0, S0, DG0) та дані задачі. 4. Провести розрахунки та визначити невідому величину.
Якщо треба визначити: 1) тепловий ефект реакції ( 2) зміну енергії Гіббсу (DG0) за допомогою DН0 та DS0, треба скористатися формулою (4); 3) температуру (Т) рівноваги чи початку реакції, треба скористатися формулою (5). Приклад розв’язання задачі. Визначите тепловий ефект, та зміну ентропії реакції відновлення Fe3O4(k) СО, якщо продуктами реакції є FeO та CO2. Зробіть висновок стосовно теплового ефекту реакції. Користуючись значеннями DН0 та DS0 обчисліть DG0 реакції. Визначте температуру початку реакції. Згідно алгоритму: 1) запишемо термохімічне рівняння реакції Fe3O4(k)+CO( г) = 3FeO(k)+CO2( г); вихідні речовини продукти реакції 2) для розрахунків 3) численні значення величин беремо в таблицях “Стандартних термодинамічних величин”, та підставляємо в формулу; 4) зробимо розрахунки:
Користуючись формулою (4) знайдемо
Для визначення температури початку реакції скористуємось формулою (5)
|
|||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 89; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.214.28 (0.006 с.) |

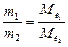 (1)
(1) 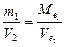 (2)
(2) 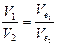 (3)
(3)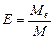 , де М- молярна маса простої чи складної речовини.
, де М- молярна маса простої чи складної речовини.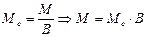 .
.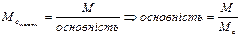 .
.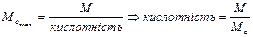
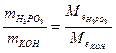

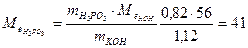 г/моль
г/моль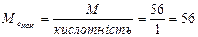 г/моль)
г/моль)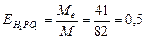 моля
моля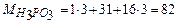 г/моль)
г/моль)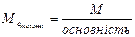 знаходимо
знаходимо 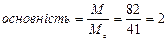 , тобто 2 іони Н+ в Н3РО3 замінюються в реакції на іони К+.
, тобто 2 іони Н+ в Н3РО3 замінюються в реакції на іони К+.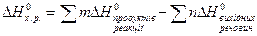 (1),
(1),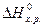 <0, реакція екзотермічна,
<0, реакція екзотермічна, 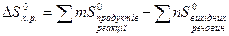 (2);
(2);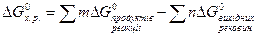 (3),
(3),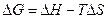 (4),
(4), 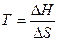 (5).
(5).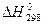 ), зміну ентропії (
), зміну ентропії (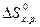 ) чи енергію Гіббсу (
) чи енергію Гіббсу (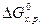 ), треба скористатися формулами (1), (2), (3);
), треба скористатися формулами (1), (2), (3);
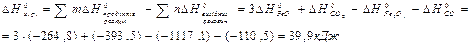
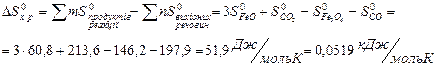
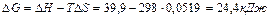 ,
,