
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
КС, що містять ліганди молекулярного типу
- аміакати: [Cu(NH3)4](OH)2; [Pt(NH3)4]Cl2; - аквакомплекси: [Cr(H2O)6]Cl3; [Cu(H2O)4]SO4; - карбоніли металів: [Fe(CO)5]; [Ni(CO)4]. КС, що містять ліганди йонного типу - гідроксокомплекси: Na2[Zn(OH)4]; K3[Al(OH)6]; - ацидокомплекси: K3[Fe(CN)6]; Na3[Al F6] K2[Hg I4]; - подвійні солі: CuCl2 · KCl; KCl · MgCl2 . 3. Циклічні КС (хелати чи клішнеподібні сполуки, в яких виникають координаційні зв’язки полідентатного ліганда з ЦА металу утворюючи цикл. Наприклад, у реакції С u(ОН)2 з амінооцтовою кислотою утворює нейтральний комплекс – Купруму(II) гліцінат: Змішані комплекси [Cr (H2O)5Cl]Cl2; [Co (NH3) 3(NO2)3]. Номенклатура комплексних сполук. В даний час єдиний підхід до рішення питання про номенклатуру КС відсутній. Українські вчені пропонують: 1. У назвах КС першим указувати катіон, другим – аніон. 2. У назвах комплексних йонів молекул ліганди перелічувати за абеткою, незалежно від заряду. Аніонним лігандам додавати до їхньої латинської назви закінчення «о»: NO2— - нітр о, Cl—- хлор о, ОН— - гідроксо. Нейтральні ліганди називати як відповідні молекули: H2O -аква, NH3 -амін. Кількість лігандів позначати грецькими числівниковими приставками: ді -; три -; тетра -; пента -; гекса - і т.д. 3. У назвах комплексних аніонів до латинської назви комплексоутворювача додавати суфікс – «ат». 4. Ступінь окиснення йона-комплексоутворювача (ЦА) вказувати в дужках римськими цифрами. Наприклад: [Co(NH3)5Cl]Cl2 – пентаамінхлорокобальта (IІІ) хлорид; K4[Fe(CN)6] – калію гексаціаноферат (II); [Mo6(H2O)6Cl8]Cl4 – гексаакваоктахлорогексамолібдена (II) хлорид. У процесі утворення КС по донорно-акцепторному механізму орбіталі ЦА перетерплюють гібридизацію. Тип гібридизації орбіталей комплексоутворювача визначає геометрію комплексного йона (дивись табл.17).
Таблиця 17
§ 7.2. ВЛАСТИВОСТІ КОМПЛЕКСНИХ СПОЛУК
Розходження в магнітних властивостях речовин можуть бути пояснені електронною будовою їхніх атомів, йонів і молекул. Діамагнітними (немагнітними) вважаються частки, сумарний магнітний момент яких дорівнює нулю, тобто всі електрони спарені і їхні магнітні моменти взаємно компенсуються. Якщо частинка має один чи кілька неспарених електронів, то сумарний магнітний момент відмінний від нуля, така частинка є парамагнітною. Властивості КС залежать також від природи L. За силою впливу на валентні електрони ЦА ліганди розташовують у спектрохімічний ряд: CO > CN- >NO2- >NH3 >CNS- >H2O >OH- >F- >Cl- >Br- >I- L сильного поля, L поля середньої сили, L слабкого поля У випадку сильного поля лігандів утворюються спін-спарені КС (табл. 17,спол. 3;5),а у випадку слабкого поля – спін-вільні КС (табл. 17, спол. 4;6). Багато КС мають забарвлення. Це з’ясовується можливістю переходу електронів з одного d - енергетичного підрівня на іншій за наявності незаповнених орбіталей. При поглинанні речовинами певної частини спектра сама речовина виявляється забарвлена у додатковий колір. Наприклад, чому сполуки Au (I) незабарвлені, а Au (III) забарвлені? Йон Au+ має електронну конфігурацію 5d10. Усі 5d-орбіталей заповнені, перехід електронів на d - підрівень неможливий. У йона Au3 + 5d8-електронів, отже, на d - рівні дві вакансії, перехід електронів у межах d-підрівня можливий і тому сполуки Au3+ забарвлені. Йони зовнішньої сфери зв'язані з комплексним йоном силами електростатичної взаємодії, тому в розчинах КС дисоціюють подібно сильним електролітам на внутрішню і зовнішню сфери (первинна дисоціація). Наприклад: [Аg (NH3) 2] Cl ↔ [Ag (NH3) 2]+ + Cl K3[Fe(CN)6] ↔ 3K+ + [Fe(CN)6]3 Якщо КС є нейтральною часткою, то їй не притаманна первинна дисоціація.
Комплексний йон дисоціює значно слабше (подібно слабким електролітам) – це вторинна дисоціація, вона може йти ступенево і характеризується КД, що називається константою нестійкості (Кнест).
[Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3 I ступінь, Кнест1; + [Ag(NH3)]+ ↔ Ag+ + NH3 II ступінь, Кнест2;
[Ag(NH3)2]+ ↔ Ag+ + 2NH3 Кнест = Кнест1 . Кнест2. Ця величина є мірою стійкості комплексного йона. Чим менше значення Кнест, тим стійкіше комплексний йон. Наприклад, з комплексних йонів [Fe(CN)6]3 Для одержання КС можна використовувати реакції сполучення, заміщення, подвійного обміну, окислювально-відновні реакції (ОВР). 1) реакції сполучення: CuCl2 + 4H2O → [Cu (H2O) 4] Cl2; Cr (OH) 3 + 3NaOH → Na3 [Cr (OH) 6]; 3KCN + Fe (CN) 3 → K3 [Fe (CN) 6]; 2) реакції зовнішньосферного обміну: 3FeSO4 + 2K3[Fe(CN) 6] → Fe3 [Fe (CN) 6]2↓ + 3K2SO4; 3) реакції внутрішньосферного обміну: [Co (H2O) 4] Cl2 + 4KCNS → K2 [Co (CNS) 4] + 2KCl + 4H2O; 4) окислювально-відновні реакції: 2K4[Fe(CN) 6] + Cl2 → 2K3[Fe(CN)6] + 2KCl. Руйнування комплексних сполук можна здійснювати нагріванням, розведенням, зв'язуванням лігандів у більш міцні сполуки. [Cu (NH3) 4](OH) 2 K2 [Co (CNS) 4] + 4H2O → [Co (H2O) 4](CNS) 2 + 2KCNS; [Ag (NH3) 2] Cl + 2HNO3(конц) → AgCl↓ +2 NH4NO3; [Cu (NH3) 4](OH) 2 + Na2S →CuS↓ + 4NH3↑ + 2NaOH. Питання для самоконтролю
1.Яке значення мають комплексні сполуки (КС)? 2.За допомогою якої теорії з’ясовують будову КС? Яка природа зв'язку в КС? 3.За яким принципом класифікують та називають КС? 4. Що таке гібридизація та її вплив на просторову будову КС? 5. Яка величина вказує на стійкість КС? 6. Наведіть реакції отримання і руйнування КС.
Р о з д і л 8 ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
§ 8.1. ПЕРЕБІГ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ Електрохімія – це розділ хімії, що вивчає хімічні процеси, у результаті яких виникає електричний струм або хімічні процеси, які відбуваються під дією електричного струму хімічні. В основі таких хімічних процесів єокисно-відновні реакції (ОВР). Окисно-відновні (редокс) реакції – це електронодинамічні реакції, що супроводжуються переходом електронів від відновника до окисника зі зміною ступенів окиснення атомів чи іонів, що входять до складу реагуючих речовин. Ступінь окиснення (z) – це формальний електричний заряд атома елемента в хімічній сполуці за умови, що всі утворені цим атомом зв'язки, носять чисто йонний характер. Ступінь окислювання елементів визначається з урахуванням таких правил: 1. z елемента в простій речовині=0 2. z (O)= -2 (виключення: F2O+2;R2O2 3. z (Н)= +1(виключення: гідриди металів Na+H 4. z йона = заряду йона (Na+ 5. Закон електронейтральності: у молекулі алгебраїчна сума ступенів окиснення елементів з урахуванням числа їх атомів дорівнює нулю. Наприклад, K +1+x+4• (-2)=0 Окисник – речовина, що приєднує електрони і при цьому відновлюється. Найважливіші окисники 1. Неметали, що переходять у процесі ОВР у негативно заряджені йони: F 2. Катіони металів і катіон водню Н+, що переходять у процесі ОВР у нейтральний стан: Ag+ 2H+ 3. Складні речовини, до складу яких входять атоми елементів у вищих ступенях окиснення, що переходять у процесі ОВР у більш низькі ступені окиснення:
Відновник – це речовина, що відщеплює електрони і при цьому окиснюється. Найважливіші відновники 1. Усі метали і деякі неметали (H2; B; C), які переходять в процесі ОВР у стан з позитивними ступенями окиснення:
2. Складні речовини, до складу яких входять елементи з низькими ступенями окиснення, що переходять при ОВР у більш високі ступені окиснення:
(FeCl2) (FeCl3). Типи ОВР 1. Міжмолекулярні ОВР – це реакції, у ході яких окисник і відновник знаходяться в різних речовинах: Mn+4O2+4HCl 2. Внутрімолекулярні ОВР – це реакції, у ході яких окисник і відновник (атоми різних елементів) знаходяться у складі однієї речовини: 2KCl 3. ОВР дисмутації – це реакції, у ході яких атоми того самого елемента, що знаходяться в складі речовини, є й окисником, і відновником: Cl При складанні рівнянь ОВР потрібно дотримуватися електронного балансу, тобто число електронів, відданих відновником, повинне відповідати числу електронів, прийнятих окисником. Обрахувавши ступені окислювання часток, що беруть участь і утворюються в результаті реакції, визначаємо відновник і окисник:
окисник [ Mn+7O4]- + 8H+ + 5ē → Mn+2 + 4H2O 2 Е0 =+1,51 (В) відновник Fe+2 - ē → Fe+3 10 ЕВ =+0,77(В).
2[MnO]-4 +16H+ + 10Fe+2 → 2Mn+2 + 10Fe+3+ 8H2O 2K+ 8[SO4 ] Для написання молекулярного рівняння складаємо ці два рівняння, дописуємо протилежнозаряджені йони та ставимо коефіцієнти у кінцеве рівняння реакції. У розчинах здатність електронів до переходу від одних атомів чи йонів до інших характеризується стандартним окисно-відновним потенціалом Е0 (В). Можливість і напрямок перебігу ОВР визначається величиною ЕРС, що розраховується як різниця потенціалів окисника (Е0) і відновника (ЕВ). ЕРС = Е0 – ЕВ, якщо ЕРС = ΔΕ>0 – реакція можлива; ΔΕ >0,2 (В) - реакція йде добре; ΔΕ <0 – реакція неможлива. Для наведеної реакції ЕРС= 1,51-0,77=0,74(В), виходить, реакція проходить в прямому напрямку досить добре. § 8.2. ЕЛЕКТРОДНИЙ ПОТЕНЦІАЛ Електродний потенціал. При зануренні металевої пластинки, вільної від оксидної плівки, у розчин електроліту на межі метал — розчин електроліту виникає подвійний електричний шар (ПЕШ), що характеризується певною різницею потенціалів або певним електродним потенціалом.
ПЕШ виникає в результаті переходу заряджених часток через межу розділу двох фаз метал (Ме), тверда фаза (т) — розчин електроліту (р). При його формуванні, наприклад, у випадку металевої пластинки, зануреної у воду, проходять такі процеси: 1. Відрив позитивно заряджених йонів (катіонів) від поверхні металу і перехід їх у розчин. Ме (т) →Ме 2. Надлишок електронів, що залишаються в металі, заряджає його поверхню негативно. 3. Гідратація катіонів полярними молекулами води в об’ємі рідкої фази (сольватація молекулами розчинника) Ме Вище названі процеси (1,2,3) проходять одночасно, і тому їх загальне рівняння можна записати: Ме (т)+ nН 4. Концентрування гідратованих (сольватованих) катіонів у прилежному до поверхні металу шарі рідини внаслідок їх взаємодії з негативно зарядженою поверхнею. Позитивно заряджені катіони притягаються негативно зарядженою поверхнею. Формується ПЕШ, що характеризується електродним потенціалом. 5. З ростом стрибка потенціалу між металом і розчином електроліту усе з більшою швидкістю починають проходити зворотні процеси, дегідратація йонів металу і їх наступне відновлення до атомів. Ме (р) 6. При деякому стрибку потенціалу настає рівновага: Ме (т) + nН
Рис. 12. Схема виникнення обмінного подвійного електричного шару та електродного потенціалу на межі метал-розчин електроліту
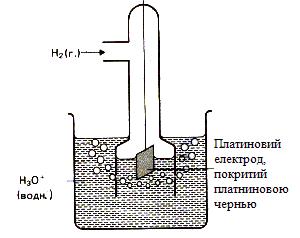
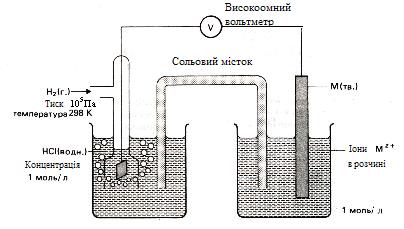
Рівноважний електродний потенціал (чи просто електродний потенціал) – це стрибок потенціалу, що установився між металом і розчином електроліту в умовах рівноваги. Величина електродного потенціалу, а також товщина подвійного електричного шару залежать від природи металу, температури й активності (концентрації) йонів у розчині. ПЕШ має дифузійну будову, тому абсолютне значення електродного потенціалу визначити неможливо. Однак якщо використовувати електрод порівняння, потенціал якого умовно прийнятий рівним нулю (Е1 = 0(В)), можна обчислювати електродні потенціали невідомих напівелементів (Е2) щодо електрода порівняння за допомогою рівняння: ЕРС (DЕ) = Е1 – Е2. На практиці користуються відносним (умовним) значенням рівноважного електродного потенціалу, що позначається Стандартний відносний електродний потенціал Як електрод порівняння використовують стандартний водневий електрод (Рис.2). Конструктивно він складається з платинової пластинки (покритої шаром електролітичної платини – платиновою черню), частково зануреної в розчин, що містить йони водню (звичайно розчин H2SO4 чи HCl). До пластинки подається чистий газоподібний водень під постійним тиском. У кислому середовищі водневому електроду H3O+ /H2, Pt відповідає рівняння електродного процесу
2H3O+ (р) +2
Рис. 13. Водневий електрод
Рис. 14. Вимір стандартних електродних потенціалів
У схематичному записі водневий електрод виражають так: Використання водневого електрода дозволяє вимірити відносний електродний потенціал будь-якого напівелемента, складаючи з його допомогою хімічне джерело струму (Рис.14). Якщо водневий електрод відіграє роль негативного електрода, схематичний запис складеного в такий спосіб хімічного джерела струму має вигляд: Отже,
Якщо водневий електрод відіграє роль позитивного електрода
Таким чином, стандартний електродний потенціал розглянутого напівелемента дорівнює стандартної ЕРС хімічного джерела, що складається з цього напівелемента і стандартного водневого електрода. § 8.3. РІВНЯННЯ НЕРНСТА У нестандартних умовах (та також за стандартної температури 298К) електродний потенціал розраховують за рівнянням Нернста:
Для металевих електродів при стандартній температурі 298К рівняння Нернста має вигляд:
де [Oх] – концентрація окисленої форми(окисника),(моль/л); [Red] – концентрація відновленої форми (відновника)(моль/л); R =8.314 Дж/К.моль – (універсальна газова постійна); Е0 – відносний стандартний електродний потенціал (табличні дані); виміряється у вольтах (В); Т – абсолютна температура (якщо стандартна, тоді Т =298К); F – число Фарадея, що дорівнює 96500 (Кл/моль); n – число електронів, що беруть участь у процесі; СМе n + – молярна концентрація катіонів металу (моль/л).
Е=Е0+0.059/n.lgCMen+, якщо CМe n+ =1 моль/л, тоді Е = Е0. Задача. Обчислити електродний потенціал золотої пластини, зануреної в розчин солі з концентрацією [ Au3+ ], рівною 0.1 моль/л. Розв’язок. Оскільки умови, наведені в задачі, відрізняються від стандартних, тобто СAu3+¹1 моль/л, а складає 0,1 моль/л, отже, для розрахунку електродного потенціалу необхідно використовувати рівняння Нернста: ЕAu3+/Au=1.5+(0.059/3).lg10-1=1.48 (В). Поняття «стандартний електродний потенціал» уведене для того, щоб можна було порівняти окислювально-відновні властивості різних систем. У відповідності зі значеннями стандартного електродного потенціалу був складений електрохімічний ряд напруг металів.
K Ca Mg Al Zn Fe Pb H+ Cu Ag Au -3.0 -2.9 -2.4 -1.7 -0.76 -0.44 -0.13 0 +0.34 +0.8 +1.5 1. Усі метали, що знаходяться ліворуч водню, мають негативні значення стандартних електродних потенціалів, праворуч –позитивні. Угоду про знаки потенціалів було прийнято в 1953 р. на конгресі Міжнародного союзу теоретичної і прикладної хімії (ІЮПАК). Умовилися приписувати потенціалу той знак, що має електрод у парі зі стандартним водневим електродом. 2. Негативні значення свідчать, що дані метали є відновниками стосовно водню, тобто витісняють (відновлюють його) з розчинів мінеральних кислот з концентрацією катіонів водню СН+=1 моль/л, аніони яких не виявляють окисних властивостей (HCl, H Zn+2HCl→ZnCl 3. Чим більш негативне значення електродного потенціалу, тим вище здатність металу віддавати свої йони в розчин, тобто тим сильніше виражена відновна здатність його відновленої форми (здатність віддавати електрони) і нижче окисна здатність його окисленої форми (здатність приймати електрони). 4. Позитивне значення потенціалу означає, що дані йони металів є окисниками стосовно водню, тобто не витискують його з розчинів, у яких концентрація катіонів водню СН+=1моль/л. Навпаки, водень витискує метали з розчинів їх солей. 5. Серед металів з позитивним значенням стандартного електродного потенціалу кожен попередній метал витискує всі наступні з розчинів їх солей. Наприклад: Cu+HgCl2→CuCl2+Hg.
Питання для самоконтролю
1.Які реакції відносяться до окислювально-відновних (ОВР)? Як їх класифікують? 2.Як можна визначити напрямок перебігу ОВР? 3. Електродний потенціал: 3.1.Що таке подвійний електричний шар; рівноважний електродний потенціал? 3.2.Як визначають стандартний електродний потенціал? 3.3.Які величини поєднує рівняння Нернста? 3.4.Як порівняти активність металів за рядом напруг металів?
Р о з д і л 9 ХІМІЧНІ ДЖЕРЕЛА СТРУМУ § 9.1. РОБОТА ГАЛЬВАНИЧНОГО ЕЛЕМЕНТУ Хімічні джерела струму (ХДС) - це гальванічні елементи, акумулятори і паливні елементи (ПЕ). Їх використовують як автономні малогабаритні джерела енергії для транспортних двигунів і машин, радіотехнічних пристроїв, приладів керування, висвітлення і тощо. До достоїнств сучасних ХДС можна віднести відносно високі ККД і питому потужність. Це дозволяє їм конкурувати з іншими видами джерел енергії. Щоб створювати і правильно використовувати ХДС, необхідно знати закономірності перебігу електрохімічних процесів, в основі яких є реакції ОВР. Гальванічними елементами (ГЕ) називаються пристрої, що перетворюють енергію ОВР в електричну. Вони звичайно складаються з двох електродів (анода і катода), виготовлених з різних металів чи їхніх сполук, занурених в електроліти (розчини солей, кислот, лугів та струмопровідні пасти). Анод (А) – це електрод, на якому відбувається процесокиснення – відщеплення електронів. Катод (К) – це електрод, на якому відбувається процесвідновлення –приєднання електронів. Елемент Даніеля-Якобі є одним з найпростіших і найрозповсюдженіших гальванічних елементів. Він, наприклад, складається з цинкового і мідного електродів, занурених відповідно в розчини сульфату цинку і сульфату міді. Розчини солей, розділені пористою чи напівпроникною перегородкою, з'єднані електролітичним містком: 1-а стадія роботи ГЕ: розчинення (окиснення) електрода, виготовленого з більш активного металу (анода); Zn0 + nН2O - 2ē → Zn2 + · nН2O Zn0 - 2ē → Zn2 +; 2-а стадія роботи ГЕ – це проходження електричного струму (спрямований потік ē) по металевому провіднику. Якщо цинк і мідь з'єднати провідником, то електрони будуть переміщуватися від цинкового анода (А 3-я стадія роботи ГЕ – на поверхні катода відбувається розрядка (відновлення) йонів Сu+2: Cu2+ · nH2O + 2ē → Cu0 + nH2O Cu2++ 2ē → Cu0. Щоб ГЕ працював, необхідно, щоб дві ізольовані системи були з'єднані електролітичним містком (агар-агар+KCl) чи напівпроникною перегородкою, по яких від К+ до А Схема роботи гальванічного елемента: ( Анодний процес. А: Zn0 - 2ē → Zn 2 + E0A= -0,76 (B). Катодний процес. К: Cu 2 + + 2ē → Cu0 E0K= +0,34 (B).
SO42- SO42- Молекулярне рівняння: Zn + CuSO4 → ZnSO4 + Cu, ЕРС=Е0 - ЕВ=ЕК-ЕА=0.34-(-0.76)=1.18 (В). У гальванічній парі анодом (А Робота з переносу електронів у зовнішньому ланцюзі та йонів у внутрішньому ланцюзі в ГЕ дорівнює добутку перенесеного заряду (n.F) на різницю потенціалів (ΔE). Максимальне значення роботи (Амах) досягається, коли ГЕ працює оборотно. У цьому випадку Амах=n.F. ΔE. Для стандартних умов Амах для елемента Даніеля-Якобі становить: Амах=n.F. ΔE =2.96500.1,1=212,46 кДж. Максимально корисна робота, яку може зробити система при перебігу реакції в умовах постійного тиску і температури, дорівнює збитку енергії Гіббса (більш докладно це питання розглядається в лекції з термодинаміки): Амах= -ΔG0298 ΔG = -n F ΔE, де n – число електронів, що беруть участь у процесі; F – число Фарадея; Δ Е = ЕРС. Це рівняння встановлює зв'язок між хімічною й електричною енергіями. ЕРС ГЕ подібно ΔG може служити критерієм рівноваги і можливості самовільного перебігу окислювально-відновних реакцій у певному напрямку: за цієї умови самовільний перебіг процесу (ΔG<0) відповідає умові ΔЕ>0. Критерієм рівноваги (ΔG=0) є рівність ЕРС ГЕ нулю. З урахуванням останнього рівняння Нернста набуває вигляду: ЕРС= ΔЕ= (RT/n.F).ln де Задача. Чи буде працювати ГЕ, що складається з нікелевого електрода, зануреного в розчин NiSO4 з концентрацією 0,01 моль/л і стандартного залізного електрода? Складіть схему, напишіть рівняння електродних процесів, розрахуйте ЕРС і ΔG0298 елемента і зробіть висновок про можливість його роботи. Розв ’язок. Визначаємо потенціали електродів. Для стандартного залізного електрода потенціал знаходимо в ряді напруг металів.
отже, у ГЕ анодом є Ферум, а катодом – Нікол. Запишемо схему ГЕ: (
А: Fe0 - 2ē → Fe2 + окислювання ЕА =-0,44 (В) K: Ni2 + + 2ē → Ni0 відновлення ЕК =-0,31 (В)
Fe + Ni2 + → Fe2 + + Ni0 SO4
ЕРС=Е0 - ЕВ=-0,31+0,44=0,13(В). Для обчислення зміни енергії Гіббса скористаємося формулою: ΔG = -n F ΔE= -2∙ 96500∙ 0,13 = -25090 Дж = -25,09 КДж, ΔG<0. Цей ГЕ буде працювати, хоча і має малу ЕРС. § 9.2. АКУМУЛЯТОРИ. ПАЛИВНІ ЕЛЕМЕНТИ Акумулятори – це хімічні джерела струму багаторазової дії, їх можна регенерувати, пропускаючи через них постійний електричний струм. Свинцеві акумулятори (кислотні) виготовляють із свинцевих пластин, на які нанесений плюмбуму оксид (PbО). Коли акумулятор заливають сірчаною кислотою, відбувається реакція: PbО + H2SO4 → PbSO4 + H2O. Далі акумулятор заряджають від зовнішнього джерела постійного струму.
+ К
Заряджений акумулятор можна відразу використати за призначенням. При зберіганні з акумулятора треба вилити електроліт, промити водою і зберігати до двох років. Для подальшого використання треба залити електроліт. Розрядка. При розрядці анод і катод міняються місцями. Відбуваються такі реакції:
Pb + 2H2SO4 + PbО2 → 2PbSO4 + 2H2O ЕРС=2,1 В. Для промивання акумулятора готують розчин, у якому на 1 л 5% NH4OH беруть 75 мл 2% трилону Б. Переваги свинцевого акумулятора: 1) велика електрична ємність; 2) стійкість у роботі; 3) велика кількість циклів зарядки-розрядки. Недоліки: 1) велика маса; 2) виділення водню при зарядці; 3) негерметичність за наявності концентрованого розчину сірчаної кислоти.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.101.192 (0.287 с.) |

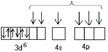
 Ag+(4d105s0)
Ag+(4d105s0)
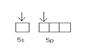
 Zn2+(3d104s0)
Zn2+(3d104s0)

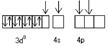

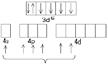
 Co3+(3d64s0)
Co3+(3d64s0)
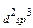 - гібридизація
6NH3
- гібридизація
6NH3
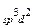 - гібридизація
- гібридизація
 6F‾
6F‾
 або
або CuО + H2O + 4NH3↑;
CuО + H2O + 4NH3↑;
 ).
). заряд =+1; F
заряд =+1; F  Mn
Mn 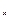 O
O 
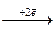 2F
2F 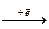 Ag0
Ag0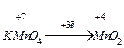 .
.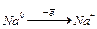 ,
,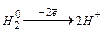 .
. ,
, O
O  =2KCl
=2KCl 

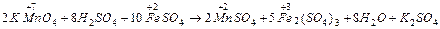

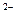 10 [ SO4 ]
10 [ SO4 ]  .
.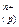 + nН
+ nН  O → Ме
O → Ме 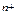 ·nН
·nН 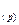 .
.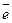 .
. · nН
· nН 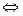 Ме (р)
Ме (р) 
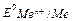 .
.
 , якщо платина служить анодом, чи
, якщо платина служить анодом, чи  , якщо платина служить катодом.
, якщо платина служить катодом.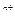 (р) êМ (т) К+.
(р) êМ (т) К+. .
.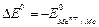 .
.
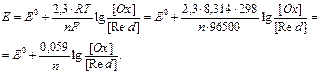
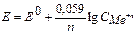

 SO
SO  (розв)):
(розв)): . Усі стадії процесів, що проходять у ГЕ, зв'язані між собою і проходять з однаковою швидкістю.
. Усі стадії процесів, що проходять у ГЕ, зв'язані між собою і проходять з однаковою швидкістю. Йонне рівняння: Zn + Cu +2 → Zn +2 + Cu0.
Йонне рівняння: Zn + Cu +2 → Zn +2 + Cu0.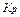 ,
,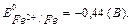 Для нікелевого електрода обчислюємо потенціал за рівнянням Нернста.
Для нікелевого електрода обчислюємо потенціал за рівнянням Нернста.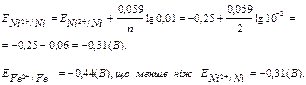
 Запишемо рівняння електродних процесів:
Запишемо рівняння електродних процесів:
 Fe + NiSO4 → FeSO4 + Ni
Fe + NiSO4 → FeSO4 + Ni Зарядка (електроліз)
Зарядка (електроліз)  A +: Pb2 + SO4 - 2ē + 2H2O → Pb4 + O2 + SO4
A +: Pb2 + SO4 - 2ē + 2H2O → Pb4 + O2 + SO4  2PbSO4 + 2H2O →Р b + PbО2 + 2H2SO4.
2PbSO4 + 2H2O →Р b + PbО2 + 2H2SO4.
 А
А  К+: Pb+4О2 + 2ē + SO4
К+: Pb+4О2 + 2ē + SO4 


