
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електроліти (за зарядом йону)Содержание книги
Поиск на нашем сайте
Електроліти (за ступенем дисоціації)
Таблиця 13
Розглянемо більш детально розведені розчини слабких електролітів. При вивченні розчинів слабких електролітів (кислот, основ, солей) було виявлено деяке відхилення від законів Вант-Гоффа і Рауля, отриманих для розчинів неелектролітів(дивись на с.). Для розчинів електролітів відзначалися більш високі значення осмотичного тиску, підвищення температури кипіння і зниження температури замерзання в порівнянні з розчинами неелектролітів тієї ж концентрації. Розчин слабкого електроліту в результаті неповної дисоціації являє собою суміш молекул електроліту, йонів електроліту, молекул розчинника, між якими відсутня взаємодія. Таким чином, відступ від законів Рауля і Вант-Гоффа зумовлений тим, що кількість частинок у розчині електроліту внаслідок неповної дисоціації більше, ніж у розчині неелектроліту. Вант-Гофф для розчинів електролітів ввів поправочний коефіцієнт
Взаємозв'язок ізотонічного коефіцієнта ( ( Середнє число частинок (
Останнє рівняння дозволяє розрахувати ступінь дисоціації слабкого електроліту, якщо ізотонічний коефіцієнт визначений експериментально (наприклад, за зміною температури замерзання розчину).Отже, слабкий електроліт у розчині дисоціює на йони, наприклад, оцтова кислота: СН3СООН à СН3СОО Процес, зворотний дисоціації, – рекомбінація йонів у молекулу: СН3СООН ß СН3СОО З часом установлюється динамічна рівновага між молекулярною й йонною формами електроліту в розчині: СН3СООН «СН3СОО
Константа дисоціації
Якщо
I ступінь: Н2СО3 «Н+ + НСО3 II ступінь: НСО3- «Н+ + СО3
Н2СО3 «2Н+ + СО3 Ступенева дисоціація для слабких багатокислотних основ: Fe(OH)3 «[Fe(OH)2]+ + OH [Fe(OH)2]+ «[FeOH] 2+ + OH [FeOH] 2+ «Fe3+ + OH ______________________________________________ Fe(OH)3 «Fe3 + +3OH
КД(I) > КД(II) > КД(III) (розпад відбувається меншою мірою у наступних ступенях).
Взаємозв'язок С a С a С Розглянемо приклад: СН3СООН «СН3СОО
де С – вихідна концентрація оцтової кислоти СН3СООН; a С – концентрація йонів; Срівн – рівноважна концентрація оцтової кислоти; С рівн = С – a С. Висновок: 1. При розведенні розчину, тобто зменшенні С, збільшується a (наближається до одиниці). 2. При збільшенні С a зменшується (імовірність взаємної зустрічі йонів у розчині і їхнього з'єднання в недисоційовані молекули збільшується).
§ 6.4. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ ВОДИ. рН РОЗЧИНІВ
Важливою особливістю рідкої води є її здатність до самовільної дисоціації за реакцією: Н2О(р) «Н+(водн) + ОН Цей процес називається ще самоіонізацією або автопротолізом. Утворені протони Н+ і аніони ОН- оточені певним числом полярних молекул води, тобто гідратовані: Н+ ×nН2O; OH Процес дисоціації води з урахуванням гідратації протона й утворення йону гідроксонію може бути записаний: 2Н2О «Н3О+ + ОН Вода – слабкий електроліт, ступінь дисоціації якого: Константа дисоціації Оскільки
Таким чином, добуток двох постійних величин [H+] = [OH При додаванні кислот концентрація [Н+] збільшується, тобто рівновага зміщується вліво, а концентрація [ОН У кислому середовищі [H+] > 10 У лужному середовищі [H+] < 10 На практиці для зручності використовують водневий показник ( рН ) і гідроксильний показник ( рОН ) середовища. Це є взятий зі зворотним знаком десятковий логарифм концентрацій (активностей) відповідно йонів водню чи гідроксильних йонів у розчині: рН = - lg[H+], рОН = - lg[OH У водних розчинах рН + рОН = 14.
Таблиця 14 Розчини | |||||||||||||||
| Нейтральні | Кислі | Лужні | ||||||||||||||
| рН = 7 | рН < 7 | рН > 7 | ||||||||||||||
Kw залежить від температури (тому що дисоціація води – ендотермічний процес);
Kw (25oС) = 10  Þ рН = 7;
Þ рН = 7;
Kw (50oС) = 5,47×10  Þ рН = 6,63.
Þ рН = 6,63.
Вимір рН використовується надзвичайно широко. У біології і медицині величина рН біологічних рідин служить для визначення патологій. Наприклад, у нормі рН сироватки крові становить 7,4±0,05; слини – 6,35..6,85; шлункового соку – 0,9..1,1; сліз – 7,4±0,1. У сільському господарстві рН характеризує кислотність ґрунтів, екологічний стан природних вод і т.д.
Кислотно-основними індикаторами називаються хімічні сполуки, що змінюють свій колір в залежності від рН середовища, у якому вони знаходяться. Ви, напевно, звертали увагу на те, як змінюється колір, якщо в нього покласти лимон – це приклад дії кислотно-основного індикатора.
Індикатори, як правило, являють собою слабкі органічні чи кислотні основи і можуть існувати в розчинах у вигляді двох таутомірних форм:
HInd «H+ + Ind 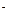 , де HInd – кислотна форма (це форма, що переважає в кислих розчинах); Ind
, де HInd – кислотна форма (це форма, що переважає в кислих розчинах); Ind 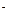 – основна форма (переважає в лужних розчинах).
– основна форма (переважає в лужних розчинах).
Поведінка індикатора подібно поведінці слабкого електроліту в присутності більш сильного з однойменним йоном. Чим більше [H+], рівновага зміщається у бік існування кислотної форми HInd, і навпаки (принцип Лє-Шательє, дивись с.).
Досвід наочно показує можливість використання деяких індикаторів:
Таблиця 15
| Індикатор | рН < 7 | рН = 7 | рН > 7 |
| Метилоранж | Червоний | Жовтогарячий | Жовтий |
| Фенолфталеїн | Безбарвний | Безбарвний | Малиновий |
| Лакмус | Червоний | Фіолетовий | Синій |
Спеціальні прилади – рН-метри дозволяють вимірювати рН із точністю до 0,01 в інтервалі від 0 до 14. Визначення засноване на вимірі ЕРС гальванічного елемента, один з електродів якого, наприклад, скляний.
Найбільш точно концентрацію водневих йонів можна визначити методом кислотно-основного титрування. Титрування – це процес поступового додавання невеликими порціями розчину відомої концентрації (титранта) до титрованого розчину, концентрацію якого хочемо визначити.
Буферні розчини – це системи, рН котрих відносно мало змінюється при розведенні чи додаванні до них невеликих кількостей кислот або лугів.
Найчастіше вони являють собою розчини, що містять:
а) слабку кислоту і її сіль (СН3СООН + СН3СООNa) – ацетатний буфер;
в) слабку основу і її сіль (NH4OH + NH4Cl) – аміачно-амонійний буфер;
с) дві кислі солі з різними  (Na2HPO4 + NaН2PO4) – фосфатний буфер.
(Na2HPO4 + NaН2PO4) – фосфатний буфер.
Регулюючий механізм буферних розчинів розглянемо на прикладі ацетатного буферного розчину.
CH3COOH «CH3COO 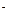 + H+,
+ H+, 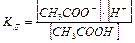
CH3COONa «CH3COO 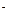 + Na+.
+ Na+.
1) якщо додати невелику кількість лугу до буферної суміші:
CH3COOH + NaOH «CH3COONa + H2O,
NaOH нейтралізується оцтовою кислотою з утворенням більш слабкого електроліту H2O. Надлишок натрію ацетату зміщує рівновагу в бік утворення кислоти.
2) якщо додати невелику кількість кислоти:
CH3COONa + HCl «CH3COOH + NaCl,
катіони водню Н+ зв'яжуть йони CH3COO 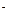 .
.
Знайдемо концентрацію йонів водню в буферному ацетатному розчині:
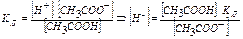 .
.
Можно припустити,що рівноважна концентрація оцтової кислоти 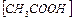 дорівнює вихідной концентрації оцтової кислоти C0 (тому що оцтова кислота відноситься до слабких електролітів), а рівноважна концентрація йону оцтової кислоти [СH3COO
дорівнює вихідной концентрації оцтової кислоти C0 (тому що оцтова кислота відноситься до слабких електролітів), а рівноважна концентрація йону оцтової кислоти [СH3COO 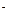 ] = Cсолі (тому що сіль є сильним електролітом), тоді
] = Cсолі (тому що сіль є сильним електролітом), тоді 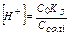 . Рівняння Гендерсона-Хассельбаха:
. Рівняння Гендерсона-Хассельбаха: 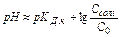 .
.
Таким чином, рН буферних систем визначається співвідношенням концентрацій солі та кислоти. При розведенні це співвідношення не змінюється, і рН буфера постійне при розведенні. Це відрізняє буферні системи від розчину чистого електроліту, для якого справедливий закон розведення Оствальда.
Існує дві характеристики буферних систем:
1. Буферна сила. Абсолютна величина буферної сили залежить від загальної концентрації компонентів буферної системи, тобто чим більше концентрація буферної системи, тим більше потрібно лугу (кислоти) для тієї ж самої зміни рН.
2. Буферна ємкість (В). Буферна ємкість – це межа, в якій виявляється буферна дія. Буферна суміш підтримує рН постійним тільки за умови, що кількість, яка додається до розчину сильної кислоти (основи), не перевищує визначеної граничної величини – В. Буферна ємкість визначається числом г/екв сильної кислоти (основи), якої необхідно додати до одного літра буферної суміші, щоб змінити значення рН на одиницю, тобто 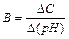 .
.
Висновок: властивості буферних систем
1. [H+] мало залежить від розведення.
2. Добавка сильних кислот (основ) мало змінює [H+] у межах буферної ємності В.
3. Буферна ємкість залежить від буферної сили (від концентрації компонентів).
4. Максимальну дію виявляє буфер у випадку, коли кислота і сіль присутні в розчині в еквівалентних кількостях:
Ссолі = Ск-ти; [H+] =  ,к; рН = рКД,к. (рН визначається значенням
,к; рН = рКД,к. (рН визначається значенням  ).
).
§ 6.5. ГІДРОЛІЗ
Гідроліз – це хімічна взаємодія води із солями. Гідроліз солей зводиться до процесу передачі протонів. У результаті його перебігу з'являється деякий надлишок водневих чи гідроксильних йонів, що надають розчину кислотні чи лужні властивості. Таким чином, гідроліз протилежний процесу нейтралізації.
Гідролізу піддаються всі солі, утворені за участю слабких електролітів:
1. Сіль, утворена аніоном слабких кислот і катіоном сильних основ: [CH3COONa, NaClО, KNO2, Na2CO3, Na3PO4]
CH3COONa + HOH «CH3COOH + NaOH CH3COO 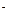 + НОН «CH3COOН + OH
+ НОН «CH3COOН + OH 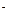 (гідроліз за аніоном), рН > 7.
(гідроліз за аніоном), рН > 7.
Аніони слабких кислот виконують функцію основ стосовно води – донору протонів, що приводить до збільшення концентрації ОН 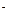 , тобто підлужуванню середовища. Глибина перебігу гідролізу визначається: ступенем гідролізу aГ:
, тобто підлужуванню середовища. Глибина перебігу гідролізу визначається: ступенем гідролізу aГ:
 ,
,
де 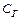 – концентрація солі, як піддалася гідролізу;
– концентрація солі, як піддалася гідролізу;
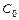 – вихідна концентрація солі.
– вихідна концентрація солі.
Ступінь гідролізу aГ невелика, наприклад, для 0,1 моль/л розчину CH3COONa при 298 К дорівнює 10 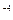 .
.
При гідролізі в системі встановлюється рівновага, що характеризується 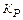 :
:
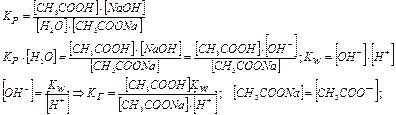
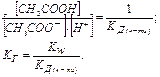 .
.
Отже, чим менша константа дисоціації, тим більша константа гідролізу. Ступінь гідролізу з константою гідролізу зв'язана рівнянням:
 .
.
Зі збільшенням розведення, тобто зменшенням С0, ступінь гідролізу збільшується.
2.Сіль, утворена катіоном слабких основ і аніоном сильних кислот: [NH4Cl, AgNO3, ZnCl2, Fe2(SO4)3];
NH4Cl + HOH ↔ NH4OH + НCl;
NH4+ + HOH ↔ NH4OH + H+ (гідроліз за катіоном), pН < 7.
Протолітична рівновага зміщена вліво, катіон слабкої основи NH4+ виконує функцію кислоти стосовно води, що приводить до підкислення середовища. Константа гідролізу визначається за рівнянням:
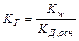 .
.
Рівноважна концентрація йонів водню може бути розрахована: [Н+]рівн = aГ × С0 ( С0 - вихідна концентрація солі ),
 ;
;
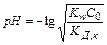 .
.
Кислотність середовища залежить від вихідної концентрації солей подібного типу.
3. Сіль, утворена аніоном слабких кислот і катіоном слабких основ. Гідролізується за катіоном і за аніоном: [NH4CN, CH3COONH4, (NH4)2S, (NH4)2CO3, (NH4)3PO4, Zn S, AlPO4, Al(CH3COO)3].
NH4CN + HOH  NH4OH + HCN
NH4OH + HCN
Для визначення рН середовища розчину порівнюють КД,к з КД,осн:
КД,к > КД,осн à середовище слабо кисле;
КД,к < КД,осн à середовище слабо лужне;
КД,к = КД,осн à середовище нейтральне.
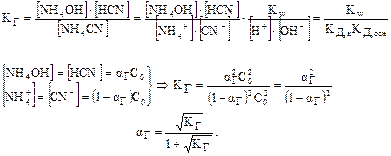
Отже, ступінь гідролізу цього виду солей не залежить від їх концентрації в розчині.
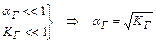 ,
,
оскільки [H+] і [ОН 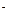 ] визначаються КД,к і КД,осн, то
] визначаються КД,к і КД,осн, то  ,
,
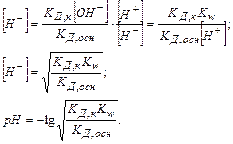
рН розчину також не залежить від концентрації солі в розчині.
Солі, утворені багатозарядним аніоном і однозарядним катіоном, наприклад, сульфіди, карбонати, фосфати амонію, практично цілком гідролізуються за першим ступенем, тобто знаходяться в розчині у виді суміші слабкої основи NH4OH і її солі NH4HS, тобто у виді амонійного буфера.
Для солей, утворених багатозарядним катіоном і однозарядним аніоном (ацетати, форміати Al, Mg, Fe, Cu), гідроліз підсилюється при нагріванні і приводить до утворення основних солей.
Гідроліз нітратів, гіпохлоритів, гіпобромитів Al, Mg, Fe, Cu протікає цілком і необоротно, тобто солі не виділені з розчинів.
Солі: Zn S, AlPO4, FeCO3 та ін. у воді малорозчинні, проте частина їх йонів бере участь у процесі гідролізу, це приводить до деякого зростання їх розчинності.
Сульфіди хрому й алюмінію гідролізуються цілком і необоротно з утворенням відповідних гідроксидів.
4. Солі, утворені аніоном сильних кислот і сильних основ, гідролізу не піддаються: [KCl, Na2SO4, Ba(NO3)2].
Найчастіше гідроліз – шкідливе явище, що викликає різні ускладнення. Так, під час синтезу неорганічних речовин з водних розчинів в одержуваній речовині з'являються домішки – продукти її гідролізу. Деякі сполуки взагалі не вдається синтезувати, через те що гідроліз проходить необоротно.
- Якщо гідроліз протікає по аніону, то в розчин додають надлишок лугу;
- Якщо гідроліз протікає по катіону, то в розчин додають надлишок кислоти.
Питання для самоконтролю
1.Які речовини відносяться до електролітів?
2.Загальні уявлення про теорію електролітичної дисоціації.
2.1.Що таке ступінь дисоціації?
2.2.Наведіть вираз константи дисоціації.
2.3.Що поєднує закон Оствальда?
3. Електролітична дисоціація води.
3.1.Який вираз йонного добутка води?
3.2. На що вказує водневий показник (рН)?
3.3.За допомогою яких речовин можна визначити рН розчину?
4. Які властивості мають буферні розчини та чому?
5. Чому розчини різних солей мають неоднакове значення рН?
Р о з д і л 7
КОМПЛЕКСНІ СПОЛУКИ
§ 7.1. БУДОВА КОМПЛЕКСНИХ СПОЛУК
Комплексні чи координаційні сполуки (КС) становлять найбільш різноманітний клас неорганічних речовин, що має велике значення в природі і техніці. За своєю будовою КС більш складні, ніж оксиди, гідроксиди, кислоти та солі. Реакції комплексоутворення лежать в основі отримання рідких та коштовних металів, чистих і надчистих речовин, аналітичних визначень, гальванотехнічних процесів, одержання лік, антидетонаторів, антиоксидантів тощо.
Неоціненна роль КС у біологічних процесах. Такі життєво важливі природні сполуки, як гемоглобін, хлорофіл, інсулін, деякі вітаміни, відносяться також до координаційних сполук.
Будову і механізм утворення хімічних зв'язків у КС найбільш вдало пояснює координаційна теорія, запропонована у 1893 р. А.Вернером. Причиною комплексоутворення може бути як електростатична, так і донорно-акцепторна взаємодія. Розглянемо механізм утворення молекули [Ag(NH3)2]Cl: AgCl + 2NH4OH ® [Ag (NH3) 2] Cl + 2H2O.
У молекулі [Ag(NH3)2]Cl йон Аргентуму (Ag+) має таку будову:
Ag0(4d105s1) 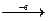 Ag+(4d105s0), йон Хлору (Cl-) – відповідно:
Ag+(4d105s0), йон Хлору (Cl-) – відповідно:
Cl0 (3s23p5) 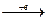 Cl- (3s23p6).
Cl- (3s23p6).
Взаємодія катіона Ag  з аніоном Cl¯ носить електростатичний характер: Ag+ + Cl-
з аніоном Cl¯ носить електростатичний характер: Ag+ + Cl- 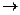 AgCl йонний зв'язок. При утворенні комплексного йона [Ag(NH3)2]
AgCl йонний зв'язок. При утворенні комплексного йона [Ag(NH3)2]  катіон Ag
катіон Ag  виступає як акцептор готової електронної пари, надаючи вільні орбіталі (5s і 5p) для координації. Молекули аміаку виступають як донори електронної пари. Хімічний зв'язок такого виду називається донорно-акцепторний чи координаційний. За своєю природою – це полярний ковалентний зв'язок, відмінність полягає лише в способі його утворення. Координаційні сполуки складаються із зовнішньої і внутрішньої сфер.
виступає як акцептор готової електронної пари, надаючи вільні орбіталі (5s і 5p) для координації. Молекули аміаку виступають як донори електронної пари. Хімічний зв'язок такого виду називається донорно-акцепторний чи координаційний. За своєю природою – це полярний ковалентний зв'язок, відмінність полягає лише в способі його утворення. Координаційні сполуки складаються із зовнішньої і внутрішньої сфер.
[H3N: 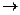 Ag
Ag  : NH3]
: NH3]  Cl‾
Cl‾
внутрішня сфера зовнішня сфера
Розрізнюють внутрішні сфери
1. Катіонного характеру: [Ag(NH)2]  ;[Cu(NH3)4]
;[Cu(NH3)4] 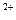 .
.
2. Аніонного характеру: [Co(CN)4] 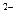 ; [Fe(CN)6]
; [Fe(CN)6] 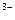 .
.
3. Нейтрального характеру: [Fe (CO) 5].
Комплексні сполуки утворюються центральним йоном (атомом), який має електроноакцепторні властивості, і оточуючими його електронодонорними частинками (йонами чи молекулами), які називають лігандами.
Комплексну частку, наприклад, 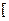 Cr3+(H2O)0 6
Cr3+(H2O)0 6 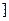 3+, утворюють:
3+, утворюють:
- центральний атом (ЦА) або, його так само називають комплексоутворювачем (К) – це катіон Хрому Cr3+;
- ліганди (L) – у нашому прикладі це молекули води, що координуються навколо ЦА, їх кількість (6) відповідає значенню координаційного числа (КЧ = 6).
Заряд комплексного йона дорівнює алгебраїчній сумі зарядів ЦА і L: К2+ 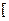 Pt+2Cl4
Pt+2Cl4 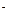
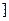
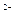 ;
; 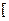 Cr+3(H2O)0 6
Cr+3(H2O)0 6 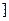 3+Cl3
3+Cl3 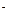 .
. 
У якості комплексоутворювачів може бути будь-який елемент періодичної системи, але найбільшу схильність до комплексоутворення мають d- і f- метали, деякі р-елементи.
Координаційне число (КЧ) визначає кількість зв'язків, утворених центральним атомом з лігандами (табл. 16)
Координаційне число залежить від багатьох факторів: RЦА, заряду ЦА, розмірів і валентності лігандів, середовища, у якому відбувається реакція комплексоутворення.
Таблиця 16
Залежність КЧ від заряду ЦА
| Заряд ЦА | КЧ | Приклад |
| +1 | 2,3,4, але найчастіше 2 | Ag+, Cu+, Au+; [Ag (NH3) 2] Cl |
| +2 | 3,4,5,6,7,8, але найчастіше 4 | Cu+2, Fe+2, Zn+2, Hg+2, Au+2, Pt+2, Pb+2; [Cu(H2O) 4]SO4, Na2[Zn(OH)4], K4 [Fe(CN)6] |
| +3 | 4,5,6,8,9,10,12, але найчастіше 6 | Fe+3, Cr+3, Co+3, Al+3; K3 [Fe (CN) 6] |
| +4 | 6,8 | Pt+4,Pb+4; K2[PtCl6], K4 [PtCl8] |
Лігандами можуть бути нейтральні молекули чи аніони, прості чи складні молекули органічних речовин, у яких є неподілені електронні пари.
За числом хімічних зв'язків, утворених лігандами з центральним атомом, ліганди можна розділити на:
- монодентатні: F‾; Cl‾; I‾; 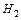
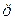 ;
; 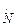
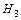
 і т.д.,
і т.д.,
- бідентатні -: SO42‾;: NH2-(CH2)2 -Н2N: - етилендиамін (ЕДА),
- полідентатні:
: OOCH2C CH2COО:
 | |||
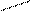 | |||
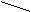
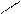
 -(CH2)2-
-(CH2)2- 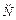
: OOCH2С CH2COO:
Аніон етилендіамінтетраоцтової кислоти (ЕДТО).
За наявністю заряду виділяють ліганди:
- аніонного типу: CN‾; Cl‾; OH‾; CNS‾;
- нейтрального типу: NH3; H2О ; CO; NO; ЕДТО.
Комплексні сполуки за хімічною природою лігандів поділяються на чотири класи.
|
| Поделиться: |

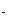 KBr à K+ + Br
KBr à K+ + Br 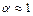
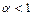
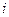 (для неелектролітів
(для неелектролітів 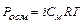 ,
, 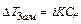 ,
, 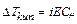 ,
,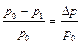 =
= 
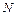 .
.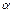 ) можна знайти, використовуючи такі міркування. Розглянемо випадок, коли молекула електроліту розпадається на
) можна знайти, використовуючи такі міркування. Розглянемо випадок, коли молекула електроліту розпадається на 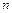 йонів зі ступенем дисоціації
йонів зі ступенем дисоціації 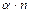 ), а кількість недисоційованих молекул складає:
), а кількість недисоційованих молекул складає: 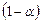 .
.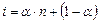
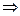
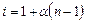
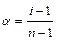 .
.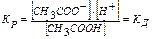 .
. ), що відповідає дисоціації слабкого електроліту.
), що відповідає дисоціації слабкого електроліту.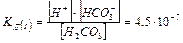
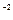
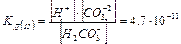
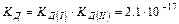

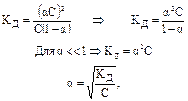
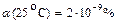 .
.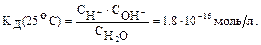

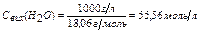 – кількість молей, що міститься в одному літрі води. Свих(Н2О) у розведеному розчині залишається постійною. Ця обставина дозволяє включити Срівн(Н2О) у константу рівноваги:
– кількість молей, що міститься в одному літрі води. Свих(Н2О) у розведеному розчині залишається постійною. Ця обставина дозволяє включити Срівн(Н2О) у константу рівноваги: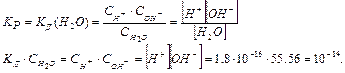
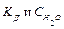 дає нову постійну, котру називають йонним добутком води
дає нову постійну, котру називають йонним добутком води 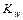 . При температурі 298К
. При температурі 298К 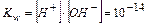 . Сталість йонного добутку води означає, що в будь-якому водяному розчині: кислотному, нейтральному чи лужному – завжди є обидва види йонів (Н+ і ОН
. Сталість йонного добутку води означає, що в будь-якому водяному розчині: кислотному, нейтральному чи лужному – завжди є обидва види йонів (Н+ і ОН 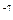 моль/л.
моль/л.


