
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика рішення задач з теми “Розчини сильних та слабких електролітів. Визначення рН розчинів”.
Щоб розв’язати задачи з цієї теми, треба знати закон Оствальда, та його математичний запис для слабких електролітів:
де КД - константа дисоціації, СМ – молярна концентрація розчину,
n - число іонів, утворених при дисоціації молекул електроліту, (слабкі електроліти мають α<2%, КД<10-5, сильні електроліти мають α>30%, КД>10-2). Для розв’язання розрахункових задач з визначення характеру реакції розчину користуються формулами: [H+]·[H-]=10-14 (5) ; рН=-lg[H+] (6), якщо рН<7, [H+]>10-7 моль/л – середовище кисле; pH=7, [H+]»10-7 моль/л – нейтральне; pH>7, [H+]<10-7 моль/л – лужне;
рОН=-lg[OH-] (7); рН+рОН=14 (8).
Алгоритм розв ’ язання задач 1. Визначити умови задачі та записати рівняння дисоціації. 1. 2. Вибрати потрібну формулу. 2. 3. Підставити данні задачі і провести розрахунок. 3. 4. Зробити висновок. Приклад розв ’ язання задачі за алгоритмом Визначити З формули (2) знаходимо 0,1 М розчин NH4OH – слабкий електроліт ( Запишемо рівняння дисоціаціі Концентрація ОН—іонів в розчині дорівнює
З формули (7) рОН=-lg[OH-]=3. З формули (8) pH+pOH=14→ pH=14-pOH=14-3=11; pH>7, середовище в розчині NH4OH – лужне.
Висновок:0,1 М розчин NH4OH – слабкий електроліт ( pH>7, середовище в розчині NH4OH – лужне.
Методика р ішення задач з теми «Гальванічні елементи» Щоб розв’язати задачі з цієї теми, треба знати будову гальванічних елементів (ГЕ), їх види, стадії роботи, мати уяви про стандартний електродний потенціал (Е0, В), рівняння Нернста для розрахунку електродного потенціалу (Е0, В), його залежність від різних факторів, розрахунок ЕРС (ΔЕ), правила запису електрохімічних формул ГЕ, напіврівняння анодного і катодного процесів, обчислювання можливості роботи ГЕ.
Головне, що треба знати при розв’язанні цих задач, що: Анод (А) – це більш активний електрод з меншим значенням електродного потенціалу; Катод (К) - це менш активний електрод з більшим значенням електродного потенціалу; При роботі ГЕ анод окислюється, а на катоді йде відновлення електроліту, у який він занурен. Рівняння Ернста де Е, Е0 – відповідно електрдний та стандартний електродний потенціали металу, n – кількість електронів, що приймають участь в електродному процессі, СМ – молярна концентрація розчину солі металу. Можливість роботи ГЕ обчислюють за допомогою значення вільної енергії Гіббса де n – кількість електронів, що приймаютьучасть в електродному процесі, F – стала Фарадея (96500 Кл/моль), ЕРС (ΔЕ), ЕРС=ЕК-ЕА (3).
|
|||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 67; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.106.100 (0.006 с.) |
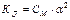 (1)
(1)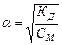 (2)
(2)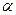 та i зв’язані між собою співвідношенням
та i зв’язані між собою співвідношенням 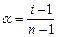 , (3)
, (3)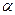 - ступінь дисоціації,
- ступінь дисоціації,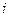 - ізотонічний коефіцієнт,
- ізотонічний коефіцієнт,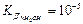 . Зробити висновки про силу електроліту та реакцію середовища.
. Зробити висновки про силу електроліту та реакцію середовища.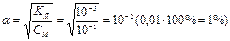
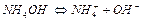
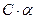
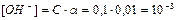 моль/л.
моль/л.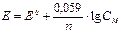 (1),
(1),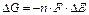 (2),
(2),


