Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Маси речовин, що виділилися на електродах, прямо пропорційні кількості електрики (Q), що пройшла кріз розчин чи розплав електроліту.
m =k . Q; Q=I· t; де Q – кількість електрики, А. с;А. год; I – сила струму, А; t – час,с; год; k – електрохімічний еквівалент, г/Кл. Маса речовини, що виділилась при проходженні через електроліт одного кулона електрики, називається електрохімічним еквівалентом (k)
де m – маса речовини, г; V – об’єм речовини, л;
F – число Фарадея, 96500 Кл/моль; 26,8 А·год/моль. II-й закон: при проходженні через різні електроліти однакової кількості електрики на електродах виділяються маси речовин пропорційно молярним масам їх еквівалентів (хімічні еквіваленти пропорційні електрохімічними): Внаслідок перебігу побічних процесів на електродах утворюється реально менша кількість речовини, ніж теоретично розраховано за вищевказаною формулою. Для характеристики практичної кількості речовини, що виділяється на електродах користуються поняттям вихід по струму (h).
Задача. Скласти схему електролізу розчину натрію сульфату. Написати рівняння катодного й анодного процесів, розрахувати кількість речовин, що утворилися при електролізі (для газоподібних – об’єм), якщо вихід по струму 70%, а через розчин пропускали струм силою 2А терміном 10 хвилин. Розв ’язок. Натрій сульфат в розчині дисоціює; Na2SO4 ↔ 2Na+ + SO4 На катоді йде відновлення тих часток, стандартний окисно-відновний електродний потенціал для яких більший,
тому на катоді буде відновлюватися вода за схемою: К до анода направляються йони SO4 На аноді окиснюються ті частки, стандартний окисно-відновний електродний потенціал для яких має менше значення
А+: 2Н2О - 4ē → О2 + 4Н+. Сумарне рівняння електролізу Na2SO4: 2Na2SO4 + 6H2O на катоді у катода на аноді у анода За законом Фарадея розрахуємо об’єми V (Н2), V (О2) і маси m (NaOH), m (H 2 SO 4), знаючи, що вихід по струму
Основне застосування електроліз знаходить у металургійній, хімічній промисловості і гальванотехніці. У металургійній промисловості електролізом розплавів одержують Al, Mg, Na, Li, Be, Ca. Електролітичне виділення металу з розчину називається електроекстракцією. Руда чи концентрат певними реагентами переводиться в розчин, який після очищення направляють на електроліз. Так одержують Zn, Cu, Cd.
Електролітичне рафінування. З металу виготовляють розчинні аноди, домішки, що містяться в чорновому металі анода, випадають у виді анодного шламу (Cu, Ni, Sn, Pb, Ag, Au) при електролізі, а чистий метал виділяється на катоді. До гальванотехніки відносять гальваностегію і гальванопластику. Гальваностегія – це нанесення шляхом електролізу на поверхню металевих виробів шарів інших металів з метою захисту від корозії, для додання твердості поверхні, у декоративних цілях. Наприклад, хромування, цинкування, нікелювання. Гальванопластика – це процес одержання точних металевих копій з рельєфних предметів електроосадом металу (на алюмінієву форму наносять електролізом шар міді потрібної товщини, потім алюміній розчиняють у соляній кислоті чи лузі). Так одержують матриці для пресування різних виробів: ґудзиків, пластинок для тиснення шкіри і паперу, радіотехнічних схем, типографських кліше. До гальванопластики відносять також такий вид електрохімічної обробки металів, як електрополіровку Al, Mg для зміцнення оксидної плівки і підвищення корозійної стійкості. У хімічній промисловості електролізом одержують фтор, хлор, луги, водень, багато окисників, гідрогену пероксид.
Питання для самоконтролю
1. Яка сутність процесів, що проходять при електролізі. 2. Види електролізу: 2.1.Що відбувається при електролізі розплавів? 2.2. Що відбувається при електролізі водних розчинів? 3. Яка послідовність розрядки йонів на електродах? 4. Що таке перенапруга.? 5. Наведіть закони електролізу. 6. Де застосовують електроліз?
Д о д а т о к 1
|
|||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 56; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.147.124 (0.006 с.) |
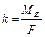 ;
; 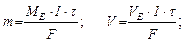
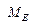 – еквівалента молярна маса, г/моль;
– еквівалента молярна маса, г/моль;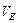 - еквівалентний об’єм, л/моль;
- еквівалентний об’єм, л/моль;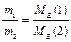 .
.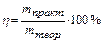 .
. ; H2O
; H2O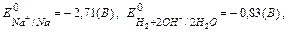
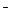 : 2НОН + 2ē → Н2↑ + 2ОН
: 2НОН + 2ē → Н2↑ + 2ОН 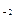 і молекули H2O.
і молекули H2O.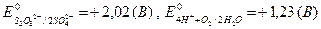 , тому буде йти окиснення води за схемою:
, тому буде йти окиснення води за схемою: 2H2 + 4NaOH + O2 + 2H2SO4
2H2 + 4NaOH + O2 + 2H2SO4 (ή) складає 70%=0,7.
(ή) складає 70%=0,7. 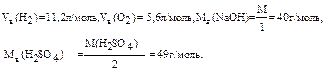
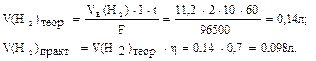
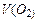 визначаємо за другим законом Фарадея:
визначаємо за другим законом Фарадея: