
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кадмієво-нікелеві акумулятори (лужні)Содержание книги
Поиск на нашем сайте
В основі їх роботи є хімічна реакція:
ЕРС = 1,4 В. В акумулятор заливають лужний електроліт, що готують таким чином: на 0,5 л води беруть 130 г КОН і 10 г LiOH. При зарядці йдуть такі процеси:
К
При розрядці: А K+: 2Ni+3OOH + 2H2O + 2ē → 2Ni(OH)2+ 2OH
Cd + 2NiOOH + 2H2O
Залізо-нікелеві акумулятори У них негативний електрод складається з порошкоподібного заліза, спресованого з невеликою кількістю спеціальних добавок (гідраргирума оксиду й ін.), а позитивний електрод – з нікеля (Ш)гідроксиду, у який для підвищення електропровідності додають чистий графіт. Електролітом служить 23% розчин їдкого калі (ρ = 1,21г/см3). Розрядка:
K+ : Ni(OH)3 + ē → Ni(OH)2 + OH
Fe + 2Ni(OH)3 ЕРС = 1,35 (В). При зарядці йде зворотний процес. В принципі, електричну енергію може дати будь-яка ОВР. Однак кількість реакцій, практично використованих у хімічних джерелах електричного струму, невелике. Це зв'язано з тим, що не всяка ОВР дозволяє створити гальванічний елемент, що має технічно коштовні властивості (висока і постійна ЕРС, тривала збереженість та ін.), крім того, багато ОВР вимагають витрати дорогих речовин. У сучасних ГЕ (це пристрій однократної дії) і акумуляторах (пристрій багаторазової дії) використовують не два, а один електроліт. Як анод найчастіше використовують цинк, а як катод – оксиди менш активних металів. Усі хімічні джерела струму мають два істотних недоліки: 1) високу вартість речовин (свинець, кадмій), з яких їх виготовляють; 2) мале співвідношення кількості енергії, що дає елемент до його маси. Працюючи над цією проблемою, прийшли до створення паливних елементів.
Паливні елементи. У них як паливо використовують вугілля, кокс, природні і штучні пальні гази, а як окисник – О2, повітря. Прикладом може служити лужний воднево-кисневий елемент. Його електроди виготовляють з порожніх, пористих трубок, на які наносять каталізатори. На водневий електрод – платину; на кисневий електрод – сплави Co+Al чи Fe+Mn+Ag. По трубках пропускають струм водню і кисню. Роботу такого елемента можна описати такими рівняннями:
А + К+ : O2 + 2H2O + 4ē → 4OH
O2 + 2 H2 → 2H2O ΔG = -574 кДж. ЕРС=ЕК-ЕА=0,4+0,83=1,23 В. Такі паливні елементи використовуються в супутниках, космічних кораблях, військовій техніці.
Питання для самоконтролю 1.Які пристрої відносять до гальванічних елементів (ГЕ)? 2.Чому і як працює ГЕ Даніеля-Якобі? 3.Де застосовують ГЕ? Перспективи розвитку? 3.1. З чого складаються кислотні акумулятори? 3.2. Принцип дії лужних акумуляторів? 3.3. Які реакції використовують у паливних елементах?
Р о з д і л 10 КОРОЗІЯ МЕТАЛІВ І ЗАХИСТ МЕТАЛІВ ВІД КОРОЗІЇ § 10.1. КЛАСИФІКАЦІЯ КОРОЗІЙНИХ ПРОЦЕСІВ
Метали внаслідок своєї високої міцності, пластичності, зносостійкості, тепло- і електропровідності є найбільш важливими конструкційними матеріалами. У процесі експлуатації в результаті впливу навколишнього середовища відбувається їх руйнування, так звана корозія. Втрати від корозії у провідних індустріальних країнах становлять близько 3-5% валового національного продукту, а витрати на відшкодування корозійних затрат в усьому світі обчислюються сотнями мільярдів доларів, тому розділ «Корозія металів і методи захисту їх від корозії» є одним з найважливіших у курсі хімії для інженерних спеціальностей. Звичайно кородують метали, що зустрічаються у природі не в самородному стані, як Au, Pt, а у вигляді різних руд. На добування цих металів із природних сполук витрачається значна кількість енергії(Меn+ + nē → Me0; ΔG>0), що накопичується в металах, роблячи їх термодинамічно нестійкими, хімічно активними речовинами (Ме0 - nē → Men+; ΔG<0). У результаті такого самовільного перебігу метали віддають навколишньому середовищу накопичену енергію, а самі руйнуються, тобто кородують і перетворюються в оксиди, гідроксиди, карбонати, сульфіди та інші сполуки і губляться безповоротно. Отже, корозію можна визначити як самовільний перебіг окисно-відновного процесу (ΔG<0) руйнування металу під впливом навколишнього середовища, що відбувається з виділенням енергії (ΔН<0) і розсіюванням речовини (ΔS>0).
Механічне руйнування металів, що відбувається з фізичних причин, називають не корозією, а ерозією, стиранням, зносом. За характером руйнування поверхні корозію підрозділяють на суцільну і місцеву. Суцільна корозія підрозділяється на рівномірну, якщо процес окиснення відбувається по всій поверхні металу з однаковою швидкістю, і нерівномірну – процес окиснення відбувається по всій поверхні з різною швидкістю на різних ділянках металу. Місцева корозія підрозділяється на корозію плямами, точ кову, піттинг (поглиблено-точкову), міжкристалеву (найбільш небезпечна, тому що послабляє зв'язок між зернами структури сплавів), що розтріскується, селективну (виборчу). За механізмом перебіг розрізняють такі види корозії: -хімічна (газова, рідинна); -електрохімічна (концентраційна, контактна, електрокорозія); -особливі види (біологічна, радіаційна, ультразвукова). За характером додаткових впливів розрізняють: -корозію під впливом механічних напруг; -корозію при терті; - кавітаційну корозію (виникає при одночасному корозійному та ударному впливі агресивного середовища, коли лопаються пухирці повітря при роботі лопастей гребного гвинта, роторів насосів).
§ 10.2. ХІМІЧНА ТА ЕЛЕКТРОХІМІЧНА КОРОЗІЯ
Розглянемо більш докладно види корозії за механізмом перебігу. Під хімічною корозією розуміють руйнування металів окисненням у навколишньому середовищі без виникнення електричного струму в системі. Газова корозія відбувається за звичайних умов, але частіше при високих температурах. Спостерігається при розливі розплавлених металів, їх термічній обробці, куванні, прокатці, зварюванні і т.д. Найпоширеніший випадок газової корозії – взаємодія металу з киснем: xMe + 1/2yО2 → MexOy 4Fe + 3O2 → 2Fe2O3 . Оксидна плівка, що утворюється при такій корозії, у ряді випадків відіграє захисну функцію. Для цього вона повинна бути суцільною, непористою, мати гарне зчеплення з металом, твердість, зносостійкість і коефіцієнт термічного розширення, близький до цієї величини, для металу. Усі ці якості оксидної плівки можна оцінити за фактором Піллінга-Бедвордса (a). Метали (лужні, лужноземельні), у яких a <1 мають тонкі оксидні плівки з розривами. Суцільні і стійкі оксидні шари утворяться при a= 1,2 – 1,6 (наприклад, Al2O3, ZnО, NiО і т.д.). При значеннях a значно більше одиниці плівки виходять несуцільними, що легко відокремлюються від поверхні металу (залізна окалина ). Корозіонно-активними газами, крім кисню, є: чадний газ, вуглекислий газ, сірчистий ангідрид, азот, його оксиди і галогени. Наприклад, при розливі розплавленого алюмінію відбувається його взаємодія не тільки з киснем, але і з азотом повітря. 4Al + 3O2 → 2Al2O3; 2Al + N2 → 2Al N Рідинна корозія протікає, як правило, у рідких неелектролітах: спиртах, хлороформі, бензолі, бензині, газі та інших нафтопродуктах. Прискорює процес рідинної корозії сірка,кисень, галогени, волога, атакож підвищена температура (корозія поршнів у двигунах внутрішнього згоряння),що можна описати рівняннями: Me (II) + R1 – S – R2 → Me S + R1 – R2 2Me (I) + 2 R – Cl → 2MeCl + R – R, де R1 – S – R2 і R – Cl вуглеводи, що містять Сульфур і Хлор. Електрохімічна корозія – найбільш розповсюджений вид корозії. Це руйнування деталей, машин, конструкцій у ґрунтових, річкових, морських водах, під впливом води (роси), під впливом мастильно-охолодних рідин, що використовуються при механічній обробці металів, атмосферній корозії і т.д.
Електрохімічна корозія – це просторово розділений окисно-відновний процес руйнування металу, що відбувається в середовищі електроліту, з виникненням усередині системи електричного струму, названого корозійним струмом. Розглянемо хімізм атмосферної корозії сталевого виробу. Сталь – це сплав Феруму з Карбоном, у якому Карбону, наприклад, у вигляді цементиту Fe3C4, менше 2%. За електрохімічної корозії у вологому повітрі (О2 + 2Н2О) Ферум і цементит утворюють мікрогальванопару, у якій роль анода виконує Ферум, а роль катода – цементит. Схема процесу: (
Катодний процес: 2H2O + O2 + 4ē → 4OH
2Fe + 2H2O + O2 → 2Fe(OH)2 (сумарне рівняння корозійного процесу руйнування сталевого виробу, що знаходиться у вологому повітрі. Для Феруму більш характерний ступінь окиснення (+3), тому процес окиснення йде далі: 4Fe(OH)2+2H2O+O2→4Fe(OH)3, Fe(OH)3 , що утворюється, при нагріванні може втрачати воду: Fe (OH)3 Тобто продуктами корозії заліза (іржа) є суміш різних сполук. Якщо врахувати, що в повітрі присутні вуглекислий газ, сірчистий газ, то можуть утворюватися і солі Феруму.
Часто через різну рельєфність металевих конструкцій, у тому числі і сталевих, на деяких ділянках накопичується вода, при цьому відбувається так звана концентраційна корозія, обумовлена різною концентрацією деполяризатора - кисню (у випадку атмосферної корозії), йонів водню (у кислому середовищі) на різних ділянках металу. Там, де концентрація деполяризатора більша (край краплі води), формується катодна ділянка, а де концентрація деполяризатора менша (центр краплі води) – анодна ділянка (рис.15). Після висихання краплі в її центрі виявляється поглиблення, а іноді навіть і отвір (для пластин товщиною 0,1...0,2 мм). Такі процеси часто спостерігаються за атмосферної і ґрунтової корозії залізних і сталевих виробів (троса, стопки листів і т.д.) – точкова корозія, що переходить у піттинг. Слід зазначити, що хоча кінцевий продукт корозії (іржа) нерозчинний, однак він не перешкоджає процесу подальшої корозії металу, оскільки формується за межами анодної ділянки (на межі зіткнення його з катодами) у вигляді кільця у середині точкі. На практиці часто зустрічаються випадки, коли метали різної активності знаходяться в контакті один з одним, утворюючи гальванопари. Крім того, технічні метали містять домішки інших металів, сплави містять різні метали. Такий метал чи сплав, знаходячись у середовищі електроліту, дає безліч мікро - і макрогальванопар, у яких анодом є більш активний метал, тобто метал з меншим значенням електродного потенціалу, саме він і піддається корозії.
Розглянемо випадок контактної корозії Цинку і Купруму з водневою деполяризацією у сірчанокислому середовищі. Цинк і Купрум мають різні значення електродних потенціалів. Більш активним у цій гальванопарі є Цинк (Е0Zn+2/Zn = -0,76 В), він має менше значення електродного потенціалу і буде анодом, тобто саме Цинк буде підвержен корозійному руйнуванню. Менш активним металом є Купрум (Е0Cu+2/Cu = +0,34 В), Купрум буде катодом.
Запишемо схему: (
Анодний процес: Zn0 - 2ē → Zn2 + Катодний процес: 2Н+ + 2ē → Н2 деполяризація
Zn + 2H+ → Zn2+ + H 2 (сумарне іонне рівняння) Молекулярне рівняння: Zn + H2SO4 → ZnSO4 + H2 Фактори, що впливають на швидкість корозії: а) напруга і деформація за механічної обробки металів; б) перемішування агресивного середовища; в) диференціальна аерація; г) температура; д) кислотність середовища (рН). Зверніть увагу, що електродні потенціали металів істотно залежать від складу електроліту і рН середовища. Наявність на металах оксидної плівки істотним чином впливає на їх потенціал, який може відрізнятися від стандартного. Так, експериментально визначено, що у випадку контактної (Al-Zn) корозії в 1М розчині HCl:
виникає гальванопара, у якій роль анода виконує Al, а катода – Zn. Схема такого процесу: (
У 0,1 М розчині HCl ( Електрокорозія протікає під дією блукаючих струмів, виникає від постійних його джерел (електротранспорт, трансформатори, лінії електропередач). Розглядаючи корозію під дією блукаючих струмів, треба пам'ятати, що місце виходу струму буде анодною ділянкою, входу струму – катодною, ділянка перебігу струму – нейтральною зоною. Радіус дії блукаючих струмів може досягати декількох десятків кілометрів. Струм силою 1А за рік руйнує до 3 кг Алюмінію, 9 кг Феруму, 11 кг Цинку чи Купруму, 34 кг Плюмбума.
§ 10.3. ЗАХИСТ МЕТАЛІВ ВІД КОРОЗІЇ Втрати від корозії у світовій економіці величезні. Близько 1/3 металу, що вводиться в експлуатацію, піддається корозії, при цьому приблизно 10% губиться безповоротно. Боротьба з корозією здійснюється різними методами. Найбільш раціональний і надійний шлях – виготовлення апаратів і машин з корозійно-стійких металевих чи неметалевих матеріалів, але через велику ціну таких матеріалів частіше використовують дешеві і доступні метали з наступним захистом їх від корозії. Цілком уникнути корозії неможливо, але, застосувавши певні методи захисту, можна знизити її вплив.
Можна умовно виділити такі групи методи захисту металів від корозії: 1. Створення раціональних конструкцій, тобто таких, котрі не мають застійних зон та інших місць скупчення вологи, бруду й інших корозійно-агресивних середовищ, допускають швидке очищення й аерацію. 2. Легування металів. Це ефективний, хоча звичайно дорогий метод підвищення корозійної стійкості металів. При легуванні до складу сплаву вводять компоненти (Cr, Ni, W, Si, V, Mo й інші), що викликають пасування металу. Механізм захисту (наприклад, у нержавіючих сталях) полягає в утворенні на поверхні щільних оксидних шарів, типу шпінелей складу NiО . Cr2O3, FeО . Cr2O3, що виявляються більш стійкими, ніж просто оксиди хрому чи нікелю. 3. Створення аморфних структур металів. Шлях до цього способу захисту відкрило надшвидке загартування. Розплавлений метал з тигля подають у найтонший зазор між двома масивними валками і піддають формуванню та різкому охолодженню. За цих умов атоми не встигають вибудовуватися у кристалічні ґратки, властиві металам, фіксується «хаос атомів», властивий розплавленому металу. У результаті виходить аморфна структура, подібна до скла, різко зростає корозійна стійкість металів. 4. Захисне покриття – найпоширеніший метод захисту металів від корозії. Зміст їх нанесення – ізоляція від агресивного середовища. Розрізняють неметалеві та металеві покриття: а) неметалеві покриття одержують нанесенням на поверхню металу лаку, фарби, смоли, оліфи, емалі чи склоемалі. Поверхню металу покривають також гумою, ебонітом, полімерними матеріалами, цементом, бетоном, оксидними плівками: ZnО, Al2O3 (оксидування) і нітридними плівками: Fe4N, Fe2N (азотування). Покрити поверхню металу можна осадженням нерозчинних фосфатів цього металу: Fe(H2PO4)2 + 2 Fe2+ ® Fe3(PO4)2 ¯ + 4H+ (фосфатування) чи насиченням поверхні металу карбоном (цементація); б) захисне покриття металами. Для цього використовують корозійностійкі метали (Sn, Zn, Al, Au, Ag, Ni, Cr та ін.). Розрізняють анодні та катодні металеві покриття. Якщо метал, що захищають, покривають більш активним металом, то таке покриття називають анодним. При порушенні покриття руйнується метал покриття. Розглянемо це на прикладі оцинкованого заліза у вологому повітрі. Складемо схему корозійного руйнування.
A: Zn0 - 2ē → Zn2+ 2 K: 2H2O + O2 + 4ē → 4OH
Якщо метал, що захищається, покритий менш активним металом, наприклад, залізо покрите оловом, то такий вид покриття називається катодним. При порушенні покриття руйнується основний метал. Розглянемо цей випадок корозії у кислому середовищі.
A: Fe0 - 2ē → Fe2 + 1 K: 2H+ + 2ē → H2↑ 1
5. Електрохімічні методи захисту: а) захист зовнішнім потенціалом; б) анодний (протекторний). Захист зовнішнім потенціалом (частіше катодний захист) здійснюється підключенням конструкції, що захищається, до негативного полюса (катода) зовнішнього джерела струму з дуже малою напругою (0,1 В). До позитивного полюса приєднується брухт, що і руйнується. Цей вид захисту використовують для металевих споруджень: трубопроводів, резервуарів тощо. Протекторний захист полягає в тім, що до виробу, який піддається електрохімічній корозії, підключають деталь – протектор, виготовлений з більш активного металу, ніж метал виробу. Протектор буде руйнуватися, а виріб залишиться незмінним. Протекторний захистзастосовують у парових казанах, для захисту корпусів морських і річкових судів, трубопроводів, рейок тощо. Задача. Наведіть приклад протекторного захисту в електроліті, що містить розчинений кисень. Складіть рівняння анодного і катодного процесів і обчислить ЕРС реакції. Розв ’язок. Протекторний захист здійснюється шляхом приєднання до заліза більш активного металу, звичайно Цинку, Магнію чи їх сплавів. Таким чином, створюється штучний мікрогальванічний елемент. Найчастіше використовують протекторний захист у розчинах електролітів (парові казани, хімічні апарати), у морській воді і у ґрунті (захист трубопроводів). Розглянемо протекторний захист від ґрунтової корозії: (протектор) ( Середовище нейтральне чи слаболужне, тому що концентрація солей незначна. У цьому, створеному нами, корозійному елементі анодом служить протектор (Цинк), він розчиняється. А: Zn0 – 2 Електрони передаються на Ферум. Деполяризатором у цьому випадку є кисень. К: O2 + 2H2O + 4 Сумарна реакція: 2Zn0 + O2 + 2H2O = 2Zn(OH)2. ЕРС реакції визначаємо: DЕ = Екатода – Еанода = 0,40 – (-0,76) = 1,16 В. Відповідь: протектор Zn, він окислюється і захищає залізо; DЕ =1,16В. 6. Вплив на агресивне середовище. Для уповільнення корозії в агресивне середовище вводять речовини, котрі називаються інгібіторами (сповільнювачами). Це найчастіше органічні речовини, що пасивують поверхню металу: тіосечовина C(NH2)2S, діетиламін C2H5— NH — C2H5, уротропін (CH2)6N4, неорганічні речовини SiО32 7. Виготовлення раціональних металевих конструкцій. Питання для самоконтролю
1.Як можна визначити поняття «корозія металів»? 2. Класифікація корозійних процесів. 2.1. За виглядом зміни поверхні металу. 2.2. За механізмом. 2.3. За характером додаткових впливів. 3. Що таке хімічна корозія, її види? 4.Як виникає електрохімічна корозія, її види і хімізм? 5. Які фактори впливають на швидкість корозії? 6. Які існують способи захисту металів від корозії?
Р о з д і л 11 ЕЛЕКТРОЛІЗ § 11.1. ЕЛЕКТРОДНІ ПРОЦЕСИ ПРИ ЕЛЕКТРОЛІЗІ
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 110; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.158.111 (0.015 с.) |

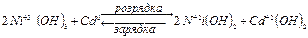
 A+ : 2Ni+2(OH)2 + 2OH
A+ : 2Ni+2(OH)2 + 2OH  - 2ē → 2Ni+3OOH + 2H2O 1
- 2ē → 2Ni+3OOH + 2H2O 1 Cd+2(OH)2 + 2Ni+2(OH)2
Cd+2(OH)2 + 2Ni+2(OH)2  Cd0 + 2Ni+3OOH +2H2O
Cd0 + 2Ni+3OOH +2H2O
 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2 А
А 
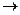 2Ni(OH)2 + Fe(OH)2
2Ni(OH)2 + Fe(OH)2 O2 + 2H2O + 2H2 + 4OH
O2 + 2H2O + 2H2 + 4OH  Анодний процес: Fe0 - 2ē → Fe2+ 2 поляризація
Анодний процес: Fe0 - 2ē → Fe2+ 2 поляризація 
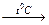 H2O + FeOOH
H2O + FeOOH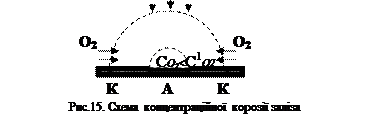


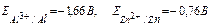 ,
, у цьому випадку більшу активність має цинк, він буде в гальванопарі анодом, алюміній – катодом, а схему запишемо так:
у цьому випадку більшу активність має цинк, він буде в гальванопарі анодом, алюміній – катодом, а схему запишемо так: (
( 2Zn + 2H2O + O2 → 2Zn(OH)2.
2Zn + 2H2O + O2 → 2Zn(OH)2. А) Fe │ 2H+ │ Sn (K+)
А) Fe │ 2H+ │ Sn (K+) Fe + 2H+ → Fe2 + + H2
Fe + 2H+ → Fe2 + + H2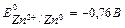
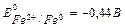 .
. ® Zn2 +
® Zn2 + 


