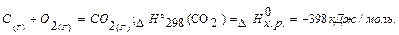Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
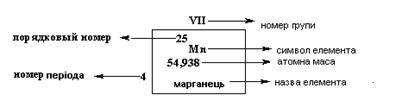
Номер групи вказує на кількість валентних електронів і відповідає вищій валентності елемента.Содержание книги
Поиск на нашем сайте
§ 3.2. ЗАКОНОМІРНОСТІ ПЕРІОДИЧНОЇ СИСТЕМИ
У періодичній системі кожен елемент має строго певний порядковий номер і займає строго певне місце.
Порядковий номер елемента відповідає позитивному заряду ядра атома (кількості протонів - ∑ Валентні електрони мають найбільший запас енергії, вони визначають хімічні властивості атомів. Атоми, вступаючи в хімічні реакції, можуть віддавати валентні електрони, приймати їх чи утворювати загальні електронні пари. Під валентністю хімічного елемента (В) мається на увазі його здатність до утворення хімічних зв'язків. В уявленні методу валентних зв'язків чисельне значення валентності відповідає кількості неспарених електронів. Крім валентності у хімії користуються ще одним поняттям «ступінь окиснення». Ступінь окиснення (z) – це умовний заряд атома елемента в сполуках, розрахований, виходячи з припущення, що всі утворені цим атомом зв'язки, мають йонний характер. Відмінності понять валентності та ступеня окиснення особливо наочно простежуються на прикладі великої кількості органічних сполук. Карбон в органічних сполуках має валентність (IV), тоді як ступінь окиснення може набувати значень від -4 до +4 залежно від типу сполук. Валентність не має знака, тому що не враховується полярність хімічних зв’язків. Здатність атомів віддавати чи приймати електрони визначається радіусом атома (Rа т). Радіусом атома (Rа т) будемо вважати половину між ’ядерного простору. Хоча ця величина фізична, у ній укладено глибокий хімічний зміст. Чим більше Rа т, тим легше атом утрачає свої валентні електрони. У періоді R а т зменшується зліва направо, оскільки зі збільшенням порядкового номера елемента кількість енергетичних шарів чи оболонок не змінюється, а кількість електронів на них і заряд ядра атома збільшуються. Це приводить до стиснення електронної густини і, як наслідок, до зменшення Rат . У групі R а т збільшується зверху донизу, оскільки зі збільшенням порядкового номера елемента збільшується кількість оболонок, і сили, які зв'язують електрони з позитивно зарядженим ядром атома, слабшають. Атоми, що віддають електрони, виявляють відновні властивості. Кількісною характеристикою відновних властивостей елементів є енергія йонізації (I, кДж/моль, еВ/атом).
Енергія йонізації (I) – це кількість енергії, необхідної для відриву електрона від незбудженого атома (А0) з перетворенням останнього в позитивно заряджений йон (катіон). Перша енергія йонізаціїхарактеризує здатність атома віддавати один електрон: А0 + I Для багато електронних атомів енергії йонізації I1;I2; I3... відповідають відриву першого, другого і т.д. електронів. При цьому I1 < I2 <I3..., тому що збільшення числа відірваних електронів приводить до зростання позитивного заряду йона, який утворюється. Співвідношення енергії іонізації до заряду електрона називається потенціалом йонізації (виміряється в електрон-вольтах, (еВ)). Потенціал йонізації чисельно дорівнює енергії йонізації. У періоді значення енергії йонізації від лужних металів до інертних газів збільшується, тому що Rат зменшується, а заряд ядра атома збільшується, у результаті чого відбувається стиснення електронної густини, тому необхідно витрачати більшу кількість енергії для відриву електрона від нейтрального атома. У групах за рахунок збільшення радіуса атома зверху донизу енергія йонізації зменшується. Найменша енергія йонізації у франція Атоми, що приймають електрони, виявляють окислювальні властивості. Кількісною характеристикою окислювальних властивостей елемента є енергія спорідненості до електрона (Есп; еВ/атом). Енергія спорідненості до електрона (Есп) – це енергія, що виділяється при приєднанні електрона до нейтрального атома(А0), вона характеризує здатність атома до утворення негативно заряджених йонів: А0 + ē Найбільша спорідненість до електрона в атома F. Енергія спорідненості до електрона значно менше енергії іонізації тих же атомів. Обидві ці величини (I і Есп) залежать від заряду ядра і розмірів атома: зі збільшенням заряду ядра вони повинні рости, а зі збільшенням радіуса атома – зменшуватися. Для порівняльної оцінки I і Е в 1932 році американським вченим Полінгом введена особлива характеристика – електронегативність (
Чим більше величина
З погляду будови атома всі елементи можна розділити на чотири типи: s - елементи (заповнюється s- підрівень АО зовнішньої оболонки):...ns1- ns2; p - елементи (заповнюється p підрівень АО зовнішньої оболонки)... np1- np6. d - елементи (заповнюється d-підрівень АО незаповненої передзовнішньої оболонки)... (n -1)d1ns2 – (n -1)d10ns2; f- елементи (заповнюється f-підрівень АО незаповненої третьої зовні оболонки) ... (n -2)f1 ns2 - (n -2)f14 ns2. Оскільки на s - підрівні може бути (1-2) Електронні аналоги – це елементи, в яких валентні електрони розташовані на орбіталях, описуваних загальною для всіх електронною формулою. Наприклад: s-елемент и IА групи мають загальну для всіх електронну формулу ns1, тобто вони - електронні аналоги (табл.6) Таблиця 6
s -елемент и IIА групи мають загальну для всіх електронну формулу ns 2, тобто вони теж є електронні аналоги (табл.7) Таблиця 7
Властивості s -елемента IА групи Натрію 11Na (дивись табл.8). Таблиця 8
Властивості s -елемента IIА групи Барію 56Ba (дивись табл.9). Таблиця 9
На p-підрівні може бути 1-6 електронів, тому p-елементи розташовуються в IIIA – VIIIA групах, головних підгрупах. Таким чином, головні підгрупи складають тільки s - і p елементи. Серед р -елементів можуть бути метали, але вони найчастіше амфотерні (дивись табл.10).
Таблиця 10
p–елементи, у яких (4-8) електронів на останньому енергетичному рівні, є неметалами (дивись табл.11;12).
Таблиця 11
17Cl (виявляє змінну валентність за рахунок появи вакантного3d-підрівня, на який можуть переходити валентні електрони з 3s- і 3p-підрівнів). Таблиця 12
В інертних газах (He і Ne) p–підрівень цілком заповнений електронами. Теоретично і практично розпарюватися електронам нікуди. Валентність дорівнює нулю. У 18Ar за рахунок появи вакантного 3d підрівня можливі валентності: Внорм=0; В*=2,4,6,8. 54Xe горить у фторі з утворенням: Xe F2, Xe F4, Xe F6, Xe F8. d - елементи – метали, тому що мають на останньому електронному рівні 2 електрони, хоча заповнення вакантних орбіталей у них відбувається на передзовнішньому шарі. Їх називають перехідними за розташуванням в періодичній системі між s і p елементами, вони формують побічні підгрупи (дивись табл.13).
Таблиця 13
Закономірності періодичної системи полягають в тому, що електронна конфігурація хімічних елементів періодично змінюється зі зростанням їхніх порядкових номерів. Перелічені фізико-хімічні характеристики або їх можна назвати критеріями періодичності (валентність, ступень окиснення, радіус атома (R а т), енергія йонізації (I), енергія спорідненості до електрона (Есп),електронегативність ( План характеристики властивостей елементів за розташуванням у періодичній системі (ПС). 1. Розташування елемента в ПС (порядковий номер, період, група, підгрупа). 2. Будова атома – число протонів, нейтронів, число електронів в атомі, структура електронної оболонки атома, електронна формула валентних рівнів, валентність в основному і збудженому станах. 3. Тип елемента (s-, p-, d-, f- елемент), (метал, неметал), можливі ступені окиснення, формули оксидів і гідроксидів для кожного валентного стану. Приклад: дати характеристику натрію. Порядковий номер його в періодичній системі 11, отже, заряд ядра атома дорівнює +11, навколо ядра обертаються 11 електронів. Натрій розташований у третьому періоді, тому його електрони розташовуються на трьох енергетичних рівнях. Натрій розташований у I - ій групі, головній підгрупі, отже, в атома Na один валентний електрон на зовнішньому рівні. А якщо в атома на зовнішньому енергетичному рівні знаходиться 1, 2 або 3 електрони, то атоми таких елементів є металами. Отже, Na – метал, його оксид Na2O має основний характер. Йому відповідає основа NaOH.
Відкриття періодичного закону Д.І. Менделєєва і створення ним періодичної системи хімічних елементів стали тріумфом у розвитку хімії XIX століття. Знання, що нагромадились до того часу, про властивості 63 хімічних елементів були приведені Д.І. Менделєєвим у строгий порядок. З відкриттям періодичного закону з'явилася можливість передбачати властивості елементів і їхніх сполук. Д.І. Менделєєв, на основі відкритого ним періодичного закону передбачив властивості тоді ще невідомих елементів: Sc, Ga, Ge, Tc, Re, Po, At, Fr, Ra, Ac, Pa., виправив атомну вагу уже відомих у той час елементів: Be, Ti, Y, In, La. Періодична система елементів дуже вплинула на подальший розвиток хімії. Вона була першою природною класифікацією хімічних елементів та показала, що хімічні елементи утворюють струнку систему і знаходяться в тісному зв'язку один з одним. Періодична система елементів стала могутнім знаряддям для подальших досліджень. З часом передбачення Д.І.Менделєєва блискуче підтвердилися. Усі передбачені елементи були відкриті, та їхні властивості з разючою точністю відповідали раніше описаним. В даний час періодичний закон залишається керівним принципом хімії. Саме на його основі штучно створюють трансуранові елементи. Один з них – елемент №101, вперше отриманий у 1955 р., – на честь великого російського вченого був назван Менделєєвієм.
Питання для самоконтролю
1.Наведіть стару та нову формуліровки періодичного закону Д.І.Менделєєва. 2.Як побудована періодична система Д.І.Менделєєва? 3.Який фізичний зміст величин періодичної системи? 4.Які закономірності періодичної системи? 5.Дайте визначення поняттям енергія іонізації, енергія спорідненості до електрона, електронегативність. 6.З чого складається план характеристики властивостей елементів по їх положенню в періодичній системі?
Р о з д і л 4 ХІМІЧНА ТЕРМОДИНАМІКА. ПЕРШИЙ ТА ДРУГИЙ ЗАКОНИ ТЕРМОДИНАМІКИ
§ 4.1. ОСНОВНІ ПОНЯТТЯ ХІМІЧНОЇ ТЕРМОДИНАМІКИ
Термодинаміка як наука виникла на початку XIX сторічча у зв'язку із завданням удосконалення теплових машин. У перекладі з грецького «термос» означає тепло, а «динамос» – силу і міць. Класична термодинаміка займається дослідженням енергії і роботи в макроскопічних системах. Цим пояснюється її значення для таких наук, як фізика, хімія, біологія, геологія, для численних галузей техніки, тому що будь-які процеси, що відбуваються в природі, супроводжуються змінами енергії. Хімічна термодинаміка – це розділ хімії, що вивчає переходи енергії з однієї форми в іншу при хімічних процесах і встановлює напрямок і межі їх самовільного перебігу за даних умов. Термодинамічна хімічна система – комплекс взаємодіючих між собою речовин, уявно відособлений від навколишнього середовища. Наприклад, системою може бути хімічна склянка, що містить певну кількість води, або теплообмінник, використовуваний на хімічному підприємстві, тощо.
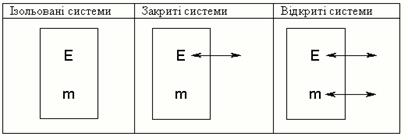
Розрізняють три типи термодинамічних систем (табл.14). Ізольованісистеми не можуть обмінюватися з навколишнім середовищем ні енергією, ні масою. Наприклад, ізольований термостат, Всесвіт у цілому. Закритісистеми можуть обмінюватися з навколишнім середовищем тільки енергією, але не масою. Наприклад, сукупність молекул розчиненої речовини можна розглядати як закриту систему, а як зовнішнє середовище може бути все інше (можливо розчинник, якщо він не бере участь у реакції). Тому в хімічній термодинаміці найбільш часто розглядають саме закриті системи. Відкритісистеми – це системи, що можуть обмінюватися з навколишнім середовищем і енергією, і масою. Наприклад, живі об'єкти тваринного чи рослинного світу.
Таблиця 14
Яку б систему ми не розглядали, вона може бути в різних станах. А щоб описати той чи інший стан, використовують термодинамічні характеристики (Рис. 4). Термодинамічні характеристики, котрі визначають стан речовини можна розглядати як основні. Їх називають параметрами стану. Звичайно це температура (Т), тиск (Р) і кількість речовини (n). Інші термодинамічні характеристики залежать від цих трьох параметрів (Т, Р, n), а значить. у цілому і від стану системи. Тому їх називають функціями стану.
Рис. 4 Термодинамічний процес – це зміна параметрів стану (тобто перехід системи з одного стану в інший). Процеси бувають: - ізохорними (V =const); - ізобарними (P =const); - ізотермічними (T =const); - адіабатними (немає обміну енергією системи з навколишнім середовищем); - ізобарно-ізотермічними (P і Т =const); - ізохорно-ізотермічними (V і T =const).
§ 4.2. ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ Перший закон термодинаміки сформульовано Джоулем у середині ХIX сторіччя. За своєю суттю це закон збереження енергії в застосуванні до термодинамічних систем: тепло, передане системі (Q), йде на зміну її внутрішньої енергії (DU) і на здійснення роботи (А): Q= DU+A Внутрішня енергія системи, (U) – це сума енергії теплового руху молекул, внутрішньо молекулярної енергії й енергії міжмолекулярної взаємодії. Абсолютне значення цієї величини невідоме, тому оперують лише величинами DU – змінами внутрішньої енергії в процесах. DU не залежить від способу переходу системи з одного стану в інший. Внутрішня енергія є функцією стану системи. Що стосується теплоти (Q) і роботи (А), то це дві єдині форми передачі енергії від системи до зовнішнього середовища і назад. Знаки теплоти і роботи визначаються схемою (Рис.5). 1. Q>0; А>0 – якщо система одержує теплоту чи над нею відбувається робота. 2. Q <0; А<0 – якщо система віддає теплоту або сама виробляє роботу. Відповідний знак (плюс чи мінус) ставиться не перед буквами Q і А, а перед цифровим значенням відповідної величини, наприклад: Q =-300 кДж; А =+50 кДж.
Рис. 5 У загальному випадку ні робота, ні теплота не є функціями стану. Перший закон термодинаміки у системі ідеального газу. Ізотермічні процеси йдуть при постійній температурі (T =const). Для їх здійснення, тобто розширення чи стиснення газу, треба сполучити систему з підведенням чи забиранням теплоти так, щоб температура газу залишалася постійною. Відповідно до вираження енергії для ідеального газу: U=3/2nRT, внутрішня енергія ідеального газу залежить тільки від температури. Тому при постійній температурі DU=0, і перший закон термодинаміки набуде такого виду: QT = AT . Таким чином, при ізотермічному розширенні газу уся теплота, що підводиться ззовні, трансформується в роботу газу, а при його стисненні, теплота що відводиться, дорівнює роботі, чиненої над газом. Адіабатні процеси – це процеси, за яких виключений теплообмін системи з навколишнім середовищем (Q =0), звідки A= DU. У цих випадках робота стає функцією стану. Ізохорні процеси (V =const) Наприклад, нагрівання газу під фіксованим поршнем. Природно, що робота при цьому не відбувається (А =0), звідки QV = DU. 1. Теплота при ізохорних процесах (QV) є функцією стану системи, оскільки такою є рівна їй величина DU. 2. QV = DU – це перше математичне вираження закону Гесса (див. далі). Ізобарні процеси (P =const) Наприклад, нагрітий газ робить роботу розширення проти постійного зовнішнього тиску. Робота розширення (АР) визначається як добуток тиску (Р) на зміну об’єму (DV). АР=Р DV, звідки: QP= DU + P DV. 1. Теплота ізобарного процесу (QP) є функцією стану системи, тому що робота проти постійного зовнішнього тиску не залежить від способу здійснення процесу, вона визначається тільки початковим і кінцевим станом системи DV. Отже, теплота є функцією стану, якщо в ході ізобарного процесу не відбувається ніякої іншої роботи, як проти постійного зовнішнього тиску. Позначимо суму (U2 + PV2) через величину Н2, а (U1 + PV1) = H1, тоді QP= H2- H1= DH. Таким чином, у термодинаміку введена нова величина Н - ентальпія. Особливість ентальпії полягає в тому, що вона є функцією стану. Отже, D H= H2 - H1, у всіх процесах (як і DU) залежить тільки від початкового (Н1) і кінцевого (Н2) станів. 2. Вираження QP = DH – це друге математичне вираження закону Гесса (див. далі). QP = U2 – U1 + P (V2 – V1) = (U2 +PV2) – (U1 + PV1) = Н2 – Н1 = D H. За умов D V=О, що найбільш характерно для хімічних реакцій. Для екзотермічних реакцій QР > 0 система віддає тепло в навколишнє середовище, виходить, її внутрішня енергія зменшується Þ DН < 0. Для ендотермічних реакцій QР < 0 Þ DH > 0. Термохімія – це розділ термодинаміки, що вивчає теплові ефекти хімічних реакцій.
§ 4.3. ЗАКОН ГЕССА
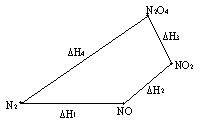
Закон Гесса - основний закон термохімії (1840 р.): Тепловий ефект хімічної реакції не залежить від механізму перебігу реакції, а залежить лише від природи і фізичного стану вихідних речовин і продуктів реакції (за умови V =const; P =const). Проілюструємо закон Гесса на прикладі. Димер оксиду азоту (IV) може бути отриманий декількома способами. По-перше: 1) N2 + O2 = 2NO, DH1 = 180900 Дж/моль; 2) 2NO + O2 = 2NO2, D H2 = -77100 Дж/моль; 3) 2NO2 = N2O4, D H3 =-10800 Дж/моль. По-друге: 4) N2+ 2O2 = N2O4, D H4 =93000 Дж/моль. D H1 + D H2 + D H3 = D H4. Більш наочно графічне вираження цих процесів:
Рис. 6 Оскільки у визначення ентальпії входить внутрішня енергія, то абсолютне значення ентальпії системи (чи будь-якої речовини) невідомо. Тому ентальпію речовини характеризують ентальпіями утворення і згоряння. DН0 f,298 (стандартна ентальпія утворення) – це теплота реакції утворення речовини (Х) із простих речовин (чи елементів) за стандартних умов: прості речовини ® Х. D Н0 f ,298 (стандартна ентальпія утворення) – це теплота реакції утворення складної речовини із простих речовин (чи елементів) за стандартних умов. Наприклад, стандартна ентальпія утворення диоксиду карбона D Н0 f ,298 дорівнює
Її визначають експериментально і заводять у таблиці (табл.2). Для простих речовин DН0 f,298 дорівнює нулю (у стійких агрегатних станах). DН0зг (стандартна ентальпія згоряння) – теплота, яка виділяється при згорянні 1моля речовини до вищих оксидів (з максимальним ступенем окиснення) за стандартних умов: Х + О2 ® оксиди (з максимальним ступенем окислювання). Значення DН0 f,298 і DН0зг містяться в довідкових таблицях. Ентальпії багатьох реакцій не піддаються експериментальному визначенню, тому що їх проведення в лабораторних умовах неможливо. Наприклад, у лабораторних умовах неможливо визначити ентальпію утворення етанола, тому що його неможливо синтезувати з атомів С, Н, О. Ентальпії подібних реакцій можуть бути обчислені по відомих ентальпіях інших реакцій за допомогою одного з наслідків закону Гесса.
Наслідки із закону Гесса Тепловий ефект хімічної реакції може бути знайдений як різниця між сумою теплот утворення продуктів реакції та сумою теплот утворення вихідних речовин з урахуванням стехіометричних коефіцієнтів. DНх.р. = S DН0 f,298 продуктів реакції – S DН0 f,298 вихідних речовин з урахуванням стехіометричних коефіцієнтів. Тепловий ефект хімічної реакції може бути знайдений як різниця між сумою теплот згоряння вихідних речовин та сумою теплот згоряння продуктів реакції з урахуванням стехіометричних коефіцієнтів. D Нх.р. = S DН0298(згор) вихідних речовин– SН0298(згор) продуктів реакції з урахуванням стехіометричних коефіцієнтів. S – грецька буква сігма, що позначає математичну операцію підсумовування. Задача: Визначити стандартну ентальпію утворення DН0 f,298(РН3), виходячи з рівняння. 2РН3(Г) + 4О2(Г) = Р2О5(Т) + 3Н2О (Р), D Нх.р = -2360 кДж. Розв’язок: D Нх. р. = [ DН0 f,298 (Р2О5(Т)) +3 DН0 f,298 (Н2О (Р))] - 2 DН0 f,298 (РН3); 2 DН0 f,298 (РН3)= [ DН0 f,298 (Р2О5(Т))+3 DН0 f,298 (Н2О (Р))] - D Н0х.р., DН0 f,298 (Р2О5(Т)) = -1492 кДж/моль, DН0 f,298 (Н2О (р)) = -285,8 кДж/моль. 2 DН0 f,298 (РН3) = [-1492 + 3(-285,8)] – (-2360)= 10.6 кДж/моль. DН0 f,298 (РН3) = 10,6/2=5,3 кДж/моль. (т) – твердий агрегатний стан, (р) – рідкий агрегатний стан, (г) – газоподібний агрегатний стан. Не тільки хімічні, але і фізико-хімічні процеси можуть супроводжуватися виділенням чи поглинанням теплоти.(дивись с….)
Питання для самоконтролю
1.Що вивчає хімічна термодинаміка? 2.Що визначають наступні основні поняття розділу «хімічна термодинаміка»: а) термодинамічна система, види систем; б) термодинамічні параметри; в) процес, класифікація процесів; г) цикл; д) термодинамічні функції? 3. Як формулюється та записується перший закон термодинаміки? 4.Визначте поняття «ентальпія». 5. Що вивчає термохімія? 6.Сформулюйте закон Гесса. Які існують наслідки з цього закону?
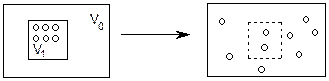
§ 4.4. ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНЕРГІЯ ГІББСА Перший закон термодинаміки за своєю суттю є законом збереження. Він дозволяє розраховувати енергетику процесу, однак не вирішує питання про можливість перебігу процесу та його напрямленість. Наприклад, такі нереальні явища, як самочинне стиснення газу чи перехід тепла від холодного тіла до гарячого, не суперечать першому закону термодинаміки. З досвіду відомо, що самочинно всі процеси проходять з певною спрямованістю, наприклад, самовільно газ поширюється на весь об’єм (Рис. 7).
Рис. 7
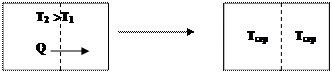
Cамовільно теплота може переходити від гарячого тіла (Т2) з більшою енергією до холодного (Т1) з меншою енергією до рівноважного стану (Т 1=Т2=Тсер). (Рис. 8).
Рис. 8
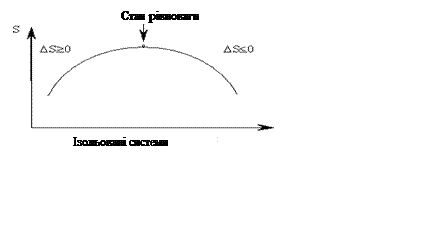
Відповідь на питання про можливість перебігу процесу та його напрямок дає другий закон термодинаміки. У підручниках для другого принципу термодинаміки звичайно наводиться безліч формулювань, наприклад: «Теплота не може самовільно передаватися від більш холодного тіла до більш гарячого» (Клаузіус). «Теплота найбільш холодного з тіл, що беруть участь у процесі, не може служити джерелом роботи» (Томсон). «Коефіцієнт корисної дії парової машини завжди менше одиниці» та ін. Але вони у здебільшого важливі для фізичних процесів. А для хімічних важливо те, що другий принцип термодинаміки дає критерії того, які процеси можуть проходити самовільно, а які не можуть. Для характеристики більш імовірних процесів у термодинаміці використовують поняття – термодинамічна імовірність, W. Термодинамічна імовірність W – це кількість мікростанів системи, якими реалізується макростан системи. Мікростан системи – це таке розташування окремих частинок (молекул) у даний момент часу, що відповідає найбільш стійкому стану системи. Отже, як критерій можливості перебігу процесу можна використовуватиW - термодинамічну імовірність. Вона є функцією стану і максимальна при рівновазі. Однак W зв'язана з механічними характеристиками системи: швидкістю руху молекул, їх положенням у просторі і т. д. А для хімічної термодинаміки важливо знайти критерій напрямку процесу, обумовлений термодинамічними параметрами: Т, Р, V (температура, тиск, об’єм). Другий принцип термодинаміки вводить у розгляд новий критерій – ентропію S, що служить мірою енергетичного безладдя в системі. Ентропія зв'язана з термодинамічною імовірністю співвідношенням: S= k.ln W, де k=R/NA» 1,381 . 10-23 Дж/град – це константа Больцмана, має розмірність енергії, віднесеної до температури і одній частці. Отже, з її допомогою здійснюється перехід від просто «безладдя» системи до «енергетичного безладдя». У розрахунку на 1 моль часток: S=R.ln W. Зміна ентропії (DS) в процесі визначається зміною числа мікростанів системи DS = S2 – S1 = R.ln W2/W1. Досвід показує, що більшість самовільних процесів проходять з виділенням теплоти (DН <0). Але серед них зустрічаються також ендотермічні (DН >0). Прикладом є розчинення амонію нітрату у воді: NH4NO3 (Т) ® NH4NO3 (Р); D Н0х.р. = + 27 кДж/моль. Виходить, тепловиділення не є вирішальним критеріємможливості самовільного перебігу процесів. Так само можуть самовільно проходити процеси зі зменшенням ентропії (DS <0): С(Т) + О2(Г) ® СО2(Г) . Між молекулами карбону С і кисню О2 встановлюється зв'язок, і тому ступінь енергетичного безладдя зменшується. Який же критерій самовільності –ентальпія (Н) чи ентропія (S)? Критерієм, що визначає можливість перебігу процесу, є баланс дії ентальпії (Н) і ентропії (S). Тому можливі самовільні процеси з поглинанням теплоти (якщо ріст енергетичного «безладдя» є більш вагомим), і процеси з DS <0 ( якщо це супроводжується більш сильним виділенням теплоти). Вимірюється зміна ентропії приведеною теплотою оборотного процесу, що зв'язує відповідні стани системи: D S = Qобор./Т. Для необоротних процесів: DS > Qнеобор./Т (алгебраїчна сума приведених теплот для необоротних процесів: Qнеобор.проц. < Qобор.проц. Математичне формулювання II закону термодинаміки (узагальнена формула) виглядає таким чином: D S ³ Q/T Для ізольованих систем, де обмін енергією з навколишнім середовищем виключений, Q=0, другий принцип термодинаміки виглядає: DS ³0. Таким чином, для ізольованих систем залишається тільки один критерій самовільного перебігу процесів – збільшення ентропії. Самовільними є лише процеси, що ведуть до збільшення загальної ентропії. Отже: 1.Ентропія – це функція стану системи, тому обчислювати зміну ентропії можна аналогічно наслідку із закону Гесса. Ентропія хімічної реакції дорівнює різниці між сумами ентропій продуктів реакції (S Sпрод)і ентропій вихідних речовин (S Sвих.р),з урахуванням стехіометричних коефіцієнтів. D Sх.р. = S Sпрод. - S Sвих.р., з урахуванням стехіометричних коефіцієнтів. Задача. Розрахувати зміну ентропії хімічних реакцій (DSх.р .) для процесу: 3С2Н2(Г) ® С6Н6 (Р). Розв’язок. DSх.р. = S0 (C6H6 (Р)) – 3 S0 (С2Н2 (Г)). D Sх.р. = 269,2 – 3 . 200,8 = - 333,2 Дж/моль.К. 2.Ентропія виміряється приведеною теплотою. Задача. Чому дорівнює збільшення ентропії моля Fe при Тпл =15360С (1809 К) при переході з кристалічного в рідкий стан, якщо ентальпія DНпл = 13765 Дж/моль. Розв’язок. При температурі плавлення Feкр Û Feр (у рівновазі Þ T=const = Тпл.). D Sпл = S (Fe (р)) -S (Fe (T)) = D Нпл/Тпл= 13765/1809= 7,61 Дж/ моль.К. D S > 0 Þ процес при Тпл відбувається самовільно. 3. Ентропія є критерієм самовільного перебігу процесів тільки для ізольованих систем. Самовільно проходять в ізольованих системах тільки ті процеси, що йдуть зі збільшенням ентропії.
Рис. 9 4. S зв'язана з числом можливих мікростанів у системі (тобто з термодинамічною імовірністю W), характеризує міру енергетичного безладдя S= kln W у системі. 5. S – це термодинамічна функція, що на відміну від термодинамічної імовірності W зв'язана з термодинамічними величинами Q
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 115; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.134.54 (0.02 с.) |

 ) і загальній кількості електронів (
) і загальній кількості електронів ( ) на його орбіталях.
) на його орбіталях. А+ + ē.
А+ + ē. .
. А- + Есп.
А- + Есп.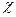 ), що визначається, за Маллікеном, як здатність атомів у молекулі притягувати електронну густину.
), що визначається, за Маллікеном, як здатність атомів у молекулі притягувати електронну густину.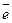 , то s - елементи розташовуються в IА і IIА групах, головних підгруп. Ці типові метали мають подібні хімічні властивості, тому що є електронними аналогами.
, то s - елементи розташовуються в IА і IIА групах, головних підгруп. Ці типові метали мають подібні хімічні властивості, тому що є електронними аналогами.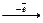 Na+ (окислюється)
Na+ (окислюється)
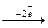 Ba 2+
(окиснюється)
Ba 2+
(окиснюється)
 Al3+
(окиснюється)
Al3+
(окиснюється)
 F –
(відновлюється)
F –
(відновлюється)
 Cl5+
(окиснюється)
Cl0
Cl5+
(окиснюється)
Cl0  Cl7+
(окиснюється)
Cl7+
(окиснюється)


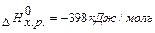 -зміні ентальпії утворення 1моль диоксиду карбона із простих речовин Карбону(С) і кисню (
-зміні ентальпії утворення 1моль диоксиду карбона із простих речовин Карбону(С) і кисню (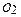 ) під час хімічної взаємодії за стандартних умов:
) під час хімічної взаємодії за стандартних умов: