
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первичная кристаллизация металлов .Содержание книги
Поиск на нашем сайте Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком, газообразном, переходы между которыми сопровождаются скачкообразными изменениями свободной энергии F. Свободная энергия изменяет свою величину при изменении температуры, плавлении, полиморфных превращениях и т. д.: F = U - TS, где F -свободная энергия; U- полная внутренняя энергия системы; Т -температура; S - энтропия. Согласно второму закону термодинамики, всякая система стремится к минимальному значению свободной энергии. Любой самопроизвольно текущий процесс идет только в том случае, если новое состояние более устойчиво, т. е. обладает меньшим запасом свободной энергии. Условия кристаллизации. Переход из жидкого состояния в твердое, кристаллическое называется кристаллизацией. Этот переход происходит при определенных условиях - температуре и давлении. При атмосферном давлении, характерном для большинства производственных процессов, основным параметром перехода является температура. В газах отсутствует закономерность в расположении частиц, частицы движутся хаотически, причем газ стремится занять возможно больший объем. Твердые кристаллические тела имеют правильное строение, при котором атомы и ионы находятся в узлах кристаллических решеток (так называемый дальний порядок). В жидкостях определенная ориентировка распространяется не на весь объем, а лишь на небольшое число атомов, образующих сравнительно устойчивые группировки, или флуктуации(ближний порядок). По мере увеличения температуры твердого тела растет подвижность атомов в узлах решетки, амплитуда колебаний увеличивается, и при достижении определенной температуры, называемой температурой плавления, закономерное расположение атомов нарушается, решетка разрушается с образованием жидкой фазы. Температура плавления - важная константа: температура плавления ртути -38,9 С; олова 232; цинка 419; алюминия 660; меди 1083; железа 1536 °С и т. д. до температуры плавления вольфрама 3410 °С. Вблизи температуры плавления существуют группировки атомов (кластеры), в которых атомы расположены как в кристаллах (ближний порядок). Эти группировки являются центрами кристаллизации или зародышами, из которых впоследствии растут кристаллы. При достижении температуры плавления - затвердевания вновь образуется кристаллическая решетка, и металл переходит в твердое состояние. Термодинамические условия кристаллизации. Энергетическое состояние любой системы характеризуется определенным запасом внутренней энергии, которая складывается из энергии движения молекул, атомов, электронов, внутриядерной энергии, энергии упругих искажений кристаллической решетки и других видов энергии. Процессы кристаллизации и плавления, как все самопроизвольно протекающие процессы, обусловлены тем, что новое состояние в конкретных условиях обладает меньшим запасом энергии. Металл затвердевает, если меньшей свободной энергией обладает твердое состояние, и плавится в том случае, когда меньшей свободной энергией обладает жидкое состояние. Изменение свободной энергии жидкого и твердого состояния при изменении температуры показано на рис.2.1 а. С повышением температуры величина свободной энергии обоих состояний уменьшается, но закон изменения свободной энергии различен для жидкого и твердого состояний вещества. Различают теоретическую и фактическую температуру кристаллизации, Ts - теоретическая, или равновесная, температура кристаллизации, при которой Fж = FTB. При этой температуре равновероятно существование металла как в жидком, так и в твердом состояниях. Реальная же кристаллизация начнется только тогда, когда этот процесс будет термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы, для чего необходимо некоторое переохлаждение. Температура, при которой практически идет кристаллизация, называется фактической температурой кристаллизации Ткр. Разность между теоретической и фактической температурой кристаллизации называется степенью переохлаждения: ΔТ = Ts - Ткр. Чем больше степень переохлаждения Δ Т, тем больше разность свободных энергий Δ F, тем интенсивнее будет идти кристаллизация. Термические кривые, характеризующие процесс охлаждения с различными скоростями, приведены на рис.2.1 б. При медленном охлаждении, соответствующем кривой vl степень переохлаждения невелика и кристаллизация протекает при температуре, близкой к равновесной. Горизонтальная площадка на термической кривой объясняется выделением скрытой теплоты кристаллизации, которая компенсирует отвод тепла. С ростом скорости охлаждения (кривые v Подобно тому, как при затвердевании необходимо переохлаждение до фактической температуры кристаллизации, так и при плавлении происходит перегрев до достижения реальной температуры плавления. 1 Механизм процесса кристаллизации. Процесс кристаллизации состоит из двух элементарных процессов: 1) зарождения центров кристаллизации; 2) роста кристаллов из этих центров. При температурах, близких к температуре затвердевания, в жидком металле существуют центры кристаллизации, в которых атомы расположены так же как в твердых кристаллах. С увеличением степени переохлаждения возрастает число центров кристаллизации, образующихся в единицу времени. Одновременно с ростом кристаллов в жидкой фазе образуются новые центры кристаллизации. Кристаллы растут до взаимного столкновения, этим объясняется неправильная форма зерен. Реальные твердые кристаллы неправильной формы называются кристаллитами. Суммарная скорость кристаллизации зависит от хода обоих элементарных процессов. Она определяется скоростью зарождения центров кристаллизации (СЗ) и скоростью роста кристаллов из этих центров (СР) (рис. 2.2.) Величины СЗ и СР зависят от степени переохлаждения. При равновесной температуре T = 0 и СЗ = О, СР = 0. С увеличением Т растет разность свободных энергий ΔF = Fж - FTв, и при достаточной подвижности атомов СЗ и СР растут и достигают максимума. Последующее уменьшение СЗ и СР объясняется снижением подвижности атомов при снижении температуры, что затрудняет перестройку атомов из хаотического расположения в жидкости в кристаллическую решетку твердого тела. При очень сильном переохлаждении СЗ и СР равны нулю, и жидкость не кристаллизуется, а превращается в аморфное тело. Для реальных металлов, как правило, реализуются лишь восходящие ветви кривых СЗ и СР, и с ростом увеличиваются скорости обоих процессов. В настоящее время с использованием специальных технологий достигаются высокая скорость охлаждения (более 106 °С/с) и стеклообразное состояние металла. Металлы в стеклообразном состоянии характеризуются особыми физико-механическими свойствами. Зародышами кристаллизации могут быть флуктуации атомов основного металла (гомогенные зародыши), примеси, различные твердые частицы (гетерогенные зародыши). Изменение свободной энергии при гомогенном зарождении центров кристаллизации включает затраты на возникновение зародыша и образование поверхности раздела. Для того чтобы зародыш обладал достаточной термодинамической и физической прочностью, он должен достичь соответствующего критического размера rк. При r<rк зародыши не образуются, потому что От соотношения скоростей зарождения и развития зависит размер зерен. При небольшом переохлаждении скорость роста велика, скорость зарождения сравнительно мала, в этом случае в объеме образуется сравнительно небольшое количество крупных кристаллов. При увеличении Размер зерна определяется не только степенью переохлаждения. Важную роль играют температура нагрева и разливки металла, его химический состав и особенно присутствие посторонних примесей. В реальных условиях самопроизвольное зарождение кристаллов в жидком металле затруднено. Источником образования зародышей служат различные твердые частицы: неметаллические, тугоплавкие включения. Для измельчения зерна в металл специально вводят вещества, которые образуют тугоплавкие соединения (карбиды, карбонитриды титана, ванадия, ниобия).
|
||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 158; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

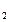 , v3) степень переохлаждения растет, и процесс кристаллизации протекает при все более понижающейся температуре. Помимо скорости охлаждения степень переохлаждения зависит от чистоты металла. Чем чище металл, тем больше степень переохлаждения.
, v3) степень переохлаждения растет, и процесс кристаллизации протекает при все более понижающейся температуре. Помимо скорости охлаждения степень переохлаждения зависит от чистоты металла. Чем чище металл, тем больше степень переохлаждения.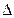 F положительна и ее величина растет; когда размер зародыша r > rк> его роль в процессе кристаллизации становится определяющей, поскольку в этот момент
F положительна и ее величина растет; когда размер зародыша r > rк> его роль в процессе кристаллизации становится определяющей, поскольку в этот момент 


