Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Следствие из закона простых кратных соотношений
Относительная атомная (молекулярная) масса (А R, MR ) – безразмерное число, показывающее, во сколько раз масса данного атома (молекулы) больше, чем 1/12 массы атома изотопа углерода 12С; измеряется в атомных единицах массы а.е.м. Следствия из закона Авогадро 1) При одинаковых (внешних) условиях (T, P) одно и тоже число молекул различных газов будет занимать одинаковый объем (формулировка, обратная закону). 2) Массы двух газов, взятых в равных объемах и при одних и тех же условиях, должны относиться друг к другу как их молярные массы:
Отношение масс газов – это относительная плотность одного газа по другому (для V1=V2 и одинаковых P, T):
3) При нормальных условиях (00С, 101,325 кПа) 1 моль любого газа занимает объем 22,4 л. Моль (ν) – количество вещества, содержащее столько же частиц вещества (молекул, атомов, ионов или любых других формульных единиц), сколько содержится атомов в 12 г изотопа углерода 12С. Число Авогадро( NA ) – 6,02·1023 частиц. Молярная масса( M ) – масса одного моля вещества; измеряется в г/моль. Молярный объем ( VM ) – объем одного моля газа; измеряется в л/моль. Полезные формулы Связь между массой вещества m, количеством вещества ν и его молярной массой M:
Связь между объемом вещества V, количеством вещества ν и его молярным объемом VM:
Закон химических эквивалентов Химический эквивалент вещества (Э) – это количество вещества, способное прореагировать (или выделить в результате химической реакции) с 1 моль атомов водорода. Закон химических эквивалентов – все вещества взаимодействуют друг с другом и образуются в результате реакций в эквивалентных количествах. Эквиваленты некоторых классов веществ. Эквивалент простого вещества Ах: Эквивалент оксида АmОn: Эквивалент гидроксида М(ОН)х: Эквивалент кислоты НхА: Эквивалент соли (K+n)m(A-m)n: NB! Эквивалент вещества зависит от реакции с участием этого вещества! С + О2 = СО2 Э(С)= 1/4 2С + О2 = 2СО Э(С)= 1/2 2NaOH + H2SO4 = Na2SO4 + 2H2O Э(H2SO4)=1/2 NaOH + H2SO4 = NaHSO4 + H2O Э(H2SO4)=1 Эквивалентная масса( MЭ ) – масса одного эквивалента вещества; измеряется в г/экв. Количество эквивалентов nЭ:
Связь между Э, MЭ, M, nЭ, ν.
Строение вещества Модели строения атома 1. Планетарная модель Резерфорда ¨ в центре атома находится положительно заряженное атомное ядро, занимающее ничтожно малую часть атомного пространства ¨ весь положительный заряд и основная масса атома сосредоточены в ядре ¨ вокруг атомного ядра по орбитам вращаютсяэлектроны; число электронов равно положительному заряду ядра. Атомное ядро – частица, состоящая из положительно заряженных протонов (p) и нейтральных элементарных частиц нейтронов (n); заряд ядра равен числу протонов. Электрон – элементарная частица, обладающая отрицательным зарядом и бесконечно малой массой. 2. Планетарная модель Бора-Зоммерфельда ¨ электрон может вращаться вокруг ядра только по строго определенным (стационарным) орбитам (орбиталям); набор таких орбиталей дискретен ¨ орбиты могут быть как сферические, так и эллипсоидные ¨ при движении по стационарным орбитам электрон не излучает и не поглощает энергии ¨ при переходе на более высоколежащую (более низколежащую) орбиталь электрон поглощает (излучает) энергию, равную энергии кванта света hν.
Электронное строение атома Электрон как трехмерная волна описывается четырьмя квантовыми числами:
1) номер энергетического уровня (в теории Бора – номер орбиты); 2) интервал энергий электронов, находящихся на этом уровне; чем больше n, тем больше запас энергии электрона в атоме 3) размеры атомных орбиталей (в теории Бора – радиусы орбит); 4) расстояние электрона от ядра; 5) число подуровней данного энергетического уровня; 6) в Периодической системе значению n соответствует номер периода;
Атомная орбиталь (АО) описывается двумя квантовыми числами – n и l, которые полностью определяют ее энергию.
Набор АО с одинаковым значением n называется энергетический уровень (слой). Набор АО с одинаковыми значениями n и l называется энергетический подуровень.
Ø Принцип минимальной энергии Ø Принцип (запрет) Паули Ø Правило Хунда Ø Правило Клечковского
Химическая связь ü Механизмы образования химической связи 1. Ковалентная неполярная (образование обобществленной электронной пары за счет двух неспаренных электронов атомов одного и того же элемента или элементов с близкими значениями электроотрицательности H2 (H-:-H), O2 (O-::-O)) 2. Ковалентная полярная (образование обобществленной электронной пары за счет двух неспаренных электронов атомов различных элементов, общая электронная пара сдвинута к более электроотрицательному элементу H–:-Cl, Ba–::-O) 3. Ионная (предельный случай ковалентной полярной связи – общая электронная пара практически полностью сдвинута к более электроотрицательному элементу: Na—:Cl, Li—:F); реализуется только в твердых (кристаллеских) веществах 4. Донорно-акцепторная (образование обобществленной электронной пары за счет неподеленной электронной пары одного атома—донора, и вакантной электронной орбитали второго атома—акцептора NH4+ (NH3:®H+))
Электроотрицательность – относительная характеристика способности атомов притягивать общую электронную пару. Ион – заряженная частица, образованная путем присоединения или отщепления одного или нескольких электронов от нейтрального атома; катион – положительно заряженный ион, анион – отрицательно заряженный ион. Донор – атом или молекула, обладающие одной или несколькими валентными неподеленными электронными парами, способными к участию в химической связи. Акцептор – атом или молекула, обладающие одной или несколькими вакантными валентными орбиталями, способными к участию в химической связи.
ü Типы химической связи
Прочность связи в ряду σ-π-δ уменьшается, а значит в первую очередь между элементами образуется σ -связь, потом π -связь, и в заключении δ -связь.
Ø Кратность химической связи 1. Одинарная связь А-В – это всегда σ -связь. 2. Двойная связь А=В – это всегда 1 σ + 1 π -связи. 3. Тройная связь А≡В – это всегда 1 σ + 2 π -связи. 4. Четверная связь А ≡ В – это всегда 1 σ + 2 π + 1 δ -связи. Прочность связи с увеличением ее кратности возрастает, а длина связи уменьшается при прочих равных условиях.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 74; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.76.0 (0.018 с.) |
||||||||||||||||||||||||||||
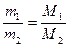
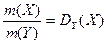
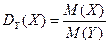
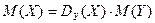
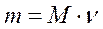 ,
, 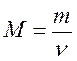 или
или 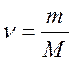
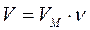 ,
, 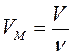 или
или 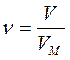
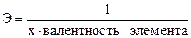
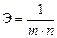
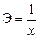
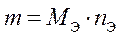 ,
, 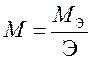 или
или 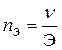



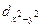 ,
, 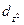 )
)