Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Средняя энергия связей в молекуле
Средняя энергия химической связи – теплота, необходимая для разрушения 1 моля молекул с образованием нейтральных атомов, отнесенная к общему количеству химических связей в молекуле.
В случае молекул, содержащих кратные связи, рассчитывается суммарная средняя энергия кратной связи. Критерий направленности химических реакций Энтропия (S)– мера неупорядоченности системы, выражается через вероятность Третье начало термодинамики (постулат Нернста) – энтропия идеального кристалла при абсолютном нуле (0 К) равна нулю. Свободная энергия (энергия Гиббса, G) – функция состояния химической системы,включающая энтальпийный и энтропийный вклады. G ≡ H - T×S. Тогда 1. Нулевое начало термодинамики – две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом: если Т1 = Т3 и Т2 = Т3, то Т1 = Т2. 2. Первое начало термодинамики – количество энергии, выделяющееся или поглощающееся в форме теплоты или работы равно изменению внутренней энергии: 3. Второе начало термодинамики – в изолированной системе самопроизвольно могут протекать только процессы, приводящие к увеличению неупорядоченности системы, т.е. к росту энтропии (DS > 0) 4. Принцип Бертло-Томсена – в химической системе самопроизвольно протекают реакции, в результате которых выделяется тепло (∆Н < 0). 5. Принцип Гиббса – в любой химической системе при постоянном давлении и температуре возможен только такой самопроизвольный процесс, который ведет к уменьшению свободной энергии системы: G→0, Вопросы и задачи к РАЗДЕЛУ Термохимия 1. Тепловой эффект химической реакции, знак теплового эффекта, причины возникновения теплового эффекта. 2. Основные законы термохимии (Закон Лавуазье–Лапласса, закон Гесса). 3. Термохимический цикл. Энергия кристаллической решетки. 4. Какие характеристики ионов определяют энергию ионной кристаллической решетки?
5. В чем различие теплового эффекта и энтальпийного эффекта химической реакции? Могут ли они быть равны друг другу? 6. Стандартное состояние вещества. 7. Энтальпия фазовых превращений (плавления, испарения, сублимации). 8. Энтальпия атомизации и средняя энергия связи в многоатомной молекуле. 9. В чем различие между истинной и средней энергиями связи A–B в молекуле ABx? 10. Может ли энтальпия атомизации вещества быть экзотермической? 11. Энергетика химических реакций в организме. Гликолиз – основные стадии с позиций термохимии. 12. Использование термохимии в практической медицине: термостатирование, глубокое охлаждение, химические грелки. 13. АТФ – как источник энергии для жизнедеятельности организма. 14. Можно ли рассчитать изменение энтальпии в ходе таких химических реакций и таких фазовых переходов, которые практически не осуществимы в данных условиях? 15. Процесс протекает по схеме : Справедливо ли для данного случая соотношение DH1=DH2=DH3? Можно ли эти значения энтальпий использовать для определения энергии связи A–B? 16. Напишите процессы образования 1 моля указанных веществ из простых веществ в стандартных состояниях (укажите эти состояния): a) NaCl, CO, V2O3, Na2SO4, HNO3, H3PO4; b) СuSO4·5H2O, Ca3(PO4)2, CaSiO3, (NH4)2CO3; c) KF, NO, P2O5, HClO3, H2SO4, K3AlF6; d) (NH4)2Cr2O7, KAl(SO4)2·12H2O, Mg(NO3)2, FeCl3. 17. Приведите примеры процессов атомизации элементов (простых веществ), гомоатомных молекул, бинарных соединений, кислород–содержащих кислот и их солей. 18. Пользуясь табличными данными для DH°f, рассчитайте изменения энтальпии в следующих реакциях: a) H2O(г) + Br2(г) ¾® HBr(г) + O2(г); b) NH3(г) + NO2(г) ¾® N2(г) + H2O(г); c) N2(г) + H2O(ж) + O2(г) ¾® HNO3(ж). 19. Вычислите DH°f подчеркнутых веществ по данным об энтальпиях реакций (DH°f остальных веществ возьмите из справочника): a) SiO2(кр) + CO(г) ¾® SiO (г) + CO2(г) DH° = +52,3 кДж/0,1 моль CO; b) BaO(кр) + O2(г) ¾® BaO 2(кр) DH° = –6,4 кДж/л O2. 20. Вычислите DH°f подчеркнутых веществ по данным об энтальпиях реакций (DH°f остальных веществ возьмите из справочника): a). SnCl4(г) + HCl(г) + NH3(г) ¾® (NH 4 ) 2 SnCl 6(кр) DH° = –23,4 кДж/0,1 моль HCl; b) NH3(г) + AlCl3(кр) ¾® AlN (кр) + HCl(г) DH° = +52,3 кДж/г AlN.
21. Определите DH° реакции COCl2(г) + 1/2O2(г) ¾® CO2(г) + Cl2(г) по следующим данным: COCl2(г) ¾® CO(г) + Cl2(г) DH° = +112,5 кДж CO2(г) ¾® CO(г) + 1/2O2(г) DH° = +282,8 кДж 22. Определите DH° реакции HNO2(г) + 1/2O2(г) ¾® HNO3(г) по следующим данным: 1/2N2O4(г) ¾® NO2(г) DH° = +28,5 кДж 2NO2(г) + H2O(г) ¾® HNO2(г) + HNO3(г) DH° = –39,3 кДж 4HNO3(г) ¾® 2N2O4(г) + O2(г) + 2H2O(г) DH° = +77,0 кДж. 23. Определите DH° превращения твердой серы в двухатомные газообразные молекулы по следующим данным: 2H2(г) + S2(г) ¾® 2H2S(г) DH° = –167,2 кДж 2H2(г) + S(кр) ¾® 2H2S(г) DH° = –20,4 кДж. 24. Определите DH° реакции: CH3OH(ж) + H2(г) ¾® CH4(г) + H2O(г) исходя из энтальпий сгорания, которые равны: CH3OH(г) –642,3 кДж CH4(г) –802,7 кДж H2(г) –242,0 кДж Как изменится найденная величина DH°, если образуется не газообразная, а жидкая вода (энтальпия испарения воды 44,0 кДж/Моль)? 25. Энтальпия сгорания газообразного бензола с образованием углекислого газа и жидкой воды равна –3301,5 кДж/Моль. Рассчитайте энтальпию образования бензола из простых веществ. 26. Энтальпия сгорания мочевины с образованием жидкой воды равна –635 кДж/Моль. Рассчитайте энтальпию образования мочевины из простых веществ. Химическая термодинамика 1. Типы систем: гетерогенная, гомогенная, закрытая, открытая, изолированная. 2. Живой организм – открытая система. Особенности процессов, происходящих в открытых системах. 3. Энтропия – мера неупорядоченности системы. Микро– и макросостояние. Факторы, влияющие на изменение энтропии. 4. Свободная энергия Гиббса, DG реакции. 5. Изменение энтропии и свободной энергии в химических процессах. Термодинамический критерий возможности протекания реакции. 6. В чем различие DG и DG°? 7. Вычислите DS° реакций по табличных данным: a) CO(г) + O2(г) ¾® CO2(г); b) SiCl4(г) + O2(г) ¾® SiO2(кр) + Cl2(г); c) Fe2O3(кр) + Al(кр)¾® Al2O3(кр) + Fe(кр); d) SiF4(г) + H2O(г) ¾® SiO2(кр) + HF(г); e) CaO(кр) + CO2(г) ¾® CaCO3(кр); f) CuO(кр) + H2(г) ¾® Cu(кр) + H2O(г); g) CH4(г) + Cl2(г) ¾® C(гр) + HCl(г); h) HCN(г) + O2(г) ¾® H2O(г) + CO2(г) + N2(г); i) TiCl4(г) + Mg(кр) ¾® Ti(кр) + MgCl2(кр); j) SnCl4(г) ¾® SnCl2(кр) + Cl2(г); k) SnO2(кр) ¾® SnO(кр) + O2(г); l) Fe(кр) + H2O(г) ¾® Fe3O4(кр) + H2(г). 8. Определите DS° реакции Cu2O(кр) ¾® Cu(кр) + CuO(кр) по следующим данным: CuO(кр) + H2(г) ¾® Cu(кр) + H2O(г) DS°= +48,8 Дж/К Cu2O(кр) + H2(г) ¾® 2Cu(кр) + H2O(г) DS°= +31,7 Дж/К. 9. Определите DS° реакции 2NO(г) + O2(г) ¾® N2O4(г) по следующим данным: N2O4(г) ¾® 2NO2(г) DS°= +176 Дж/К NO(г) + 1/2O2(г) ¾® NO2(г) DS°= – 73 Дж/К. 10. Одним из возможных метаболических превращений глюкозы является спиртовое брожение:
∆G0298 – 916,34 – 181,37 – 385,86 кДж/моль Вычислите величину изменения энтропии этого процесса при 250 К, имея в виду, что ∆Н0298 = –77,2 кДж/моль. 11. Простое тело элемента X реагирует с фтором, серой, кислородом, азотом, образуя соединения, в которых элемент X имеет одну и ту же степень окисления. Если исходные вещества находятся в стандартных условиях, а продукты реакций – кристаллические, то как соотносятся между собой энтропии этих реакций? Определите, для какой из них изменение энтропии наибольшее. Подтвердите правильность Ваших рассуждений каким-либо конкретным примером. Покажите, что изменится, если во всех случаях продукты реакций газообразны.
12. Вычислите DG°T реакций при 298 и 1000 К по табличным данным для DH°f и S°298. Оцените температуру, при которой DG0T = 0. a) Na(кр) + Cl2(г) ¾® NaCl(кр); b) MnO2(кр) + H2(г) ¾® Mn(кр) + H2O(г); c) NH4Cl(кр) ¾® NH3(г) + HCl(г). d) NO(г) + O2(г) ¾® NO2(г); e) Al(кр) + Fe2O3(кр) ¾® Fe(кр) + Al2O3(кр); f) H2O(г) + Cl2(г) ¾® HCl(г) + O2(г). 13. Не пользуясь табличными данными, определите знак DG° следующих реакций: a) KClO3(кр) ¾® KCl(кр) + O2(г) DH°<0 b) (NH4)2Cr2O7(кр) ¾® N2(г) + H2O(г) + Cr2O3(кр) DH°<0 c) Au(кр) + O2(г) ¾® Au2O3(кр) DH°>0 d) O2(г) + Cl2(г) ¾® Cl2O7(г) DH°>0 e) KBr(кр) + O2(г) ¾® KBrO(кр) DH°>0 f) CS2(г) + O2(г) ¾® CO2(г) + SO2(г) DH°<0 14. Для реакции A(г) + 2B2(г) ¾® AB4(г) при 1000 К DG° = 0. Оцените DH° реакции. 15. Для реакции АТФ + Н2О = АДФ + Н3РО4 при 310 К DG и DН равны соответственно –30,96 и –20,67 кДж/моль. Вычислите DG этой реакции при 277 К. 16. Установлено, что при гидролизе АТФ при 36°С и физиологических значениях рН величины DН и DG соответственно равны –20800 и –29200 Дж/моль. Вычислите изменение энтропии данного процесса. Каков смысл того, что изменение энтропии имеет положительное значение? Основы химической кинетики Основные понятия Скорость химической реакции (v) – число элементарных актов, происходящих в единице объема или на единице поверхности за единицу времени; в случае реальной химической системы скорость реакции удобнее определять как изменение концентрации реагирующих веществ (реагентов) или образующихся веществ (продуктов) в единицу времени. Концентрация – содержание растворенного вещества в единице объема. Природа вещества – геометрическое и электронное строение молекулы (типы атомов и связей между ними, размеры…). Гомогенная реакция – реакция, когда все реагирующие вещества находятся в одной фазе; гомогенная реакция протекает по всему объему химической системы. Гетерогенная реакция – реакция, когда реагирующие вещества находятся в разных фазах; гетерогенная реакция протекает только на границе раздела фаз. Механизм реакции – последовательность элементарных процессов превращения исходных веществ в продукты реакции. Элементарный процесс – химическая реакция, протекающая в одну стадию. Скоростьопределяющая (лимитирующая) стадия – самая медленная стадия механизма реакции.
Кинетическое уравнение реакции – зависимость скорости реакции от концентраций (парциальных давлений) реагирующих веществ. Порядок реакции по веществу n (i) – экспериментально определяемое число: степень в которую возводится концентрация данного вещества в математическом выражении закона действующих масс; стехиометрические коэффициенты совпадают с порядками реакции только в случае одностадийного процесса. Суммарный порядок реакции n – сумма всех порядков реакции по веществам, участвующим в реакции. Константа скорости k –коэффициент пропорциональности в математическом выражении закона действующих масс; удельная скорость при единичных концентрациях веществ; константа скорости зависит только от природы реагирующих веществ и температуры и не зависит от концентраций, давления и объема. Температурный коэффициент реакции (g) – число, показывающее, во сколько раз возрастет скорость реакции при увеличении температуры на 10°. Катализатор – вещество, вызывающее изменение скорости химической реакции, но не входящие в стехиометрическое уравнение реакции; катализатор изменяет энергию активации реакции из-за разбиения пути реакции на стадии. Энергия активации Ea – энергетический барьер, который должны преодолеть исходные вещества для превращения в продукты реакции. Закон действующих масс
|
|||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 735; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.20 (0.055 с.) |

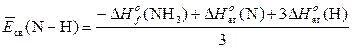
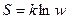 , где k – постоянная Больцмана, а w – количество микросостояний, с помощью которых можно реализовать данное макросостояние;
, где k – постоянная Больцмана, а w – количество микросостояний, с помощью которых можно реализовать данное макросостояние; 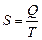 , а в неравновесном
, а в неравновесном 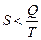 ; измеряется в Дж/К.
; измеряется в Дж/К.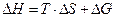 и ∆ G – это часть энергии, которую можно превратить в работу, а T∆ S – это рассеянное тепло (часть энергии, которую нельзя превратить в работу).
и ∆ G – это часть энергии, которую можно превратить в работу, а T∆ S – это рассеянное тепло (часть энергии, которую нельзя превратить в работу).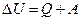
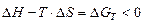
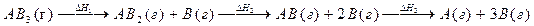

 Глюкоза 2C2H5OH(водн.) + 2СО2(г)
Глюкоза 2C2H5OH(водн.) + 2СО2(г)