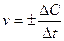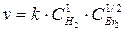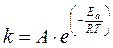Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные законы и понятия химииСтр 1 из 12Следующая ⇒
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по общей и неорганической химии для студентов 1 курса медицинского факультета
Часть II. Теоретические основы. Задачи. Справочные материалы.
Санкт-Петербург 2008 Утверждено на заседании кафедры общей и неорганической химии химического факультета 24.06.08, протокол №11. Составители: проф. М. К. Хрипун,
Рецензент: доц. Н. Г. Суходолов
Набор и компьютерная верстка В.Д. Хрипун
Методические указания для студентов медицинского факультета состоят из семи разделов: 1. Основные законы и понятия химии. 2. Введение в теорию химического процесса. 3. Основы химической кинетики. 4. Химическое равновесие. 5. Растворы. 6. Окислительно-восстановительные реакции. 7. Приложения. Основные законы и понятия химии Атомно-молекулярная теория 1.1.1. Основные положения 1. Все вещества состоят из молекул. Молекула – сложная частица, состоящая из нескольких атомов и являющаяся наименьшей частицей вещества, обладающего всеми его химическими свойствами 2. Все молекулы состоят из атомов. Атом – мельчайшая частица вещества, которую невозможно разделить на составные части, превратить в другой атом или уничтожить химическим путем. Атом – носитель свойств элемента. 3. Атомы разных элементов различаются по массе. Химический элемент – совокупность атомов, имеющих одинаковый заряд ядра. Совокупность одинаковых атомов образуют простое вещество. 4. Атомы различных химических элементов взаимодействует друг с другом в целочисленных соотношениях, образуя молекулы. 1.1.2. Основные законы Закон сохранения массы (1748 г. – М.В. Ломоносов; 1789 г. – А.-Л. Лавуазье) любое химическое превращение в закрытой системе не приводит к изменению массы системы. Закон постоянства состава (1799 г. – Ж.Л.. Пруст) состав чистого молекулярного вещества не зависит от способа его получения Закон простых кратных соотношений (1804 – Дж. Дальтон) если два элемента образуют между собой несколько соединений, то на одну и ту же массу первого элемента будут приходиться массы второго, соотносящиеся между собой как небольшие целые числа.
Закон простых объемных соотношений (1805 – Ж. Гей-Люссак) объемы реагирующих газов относятся друг к другу и к объему газообразных продуктов как небольшие целые числа Закон Авогадро (1811 г. – А. Авогадро) в равных объемах газов при одинаковых условиях содержится одинаковое число молекул Закон Дальтона сумма парциальных давлений всех газов, входящих в смесь, равно общему давлению газовой смеси Парциальное давление – это давление, которое создавал бы газ, если бы находился в том же объеме при той же температуре один Обобщенный газовый закон (уравнение Клапейрона-Менделеева)
где Р – давление газа (газовой смеси) или парциальное давление газа (кПа), входящего в смесь; V – объем сосуда (л); ν – количество газа (газовой смеси) (моль); Т – температура (К); R – универсальная газовая постоянная (8,31 Дж/К·моль)[1]. Основные следствия Следствие из закона простых кратных соотношений Относительная атомная (молекулярная) масса (А R, MR ) – безразмерное число, показывающее, во сколько раз масса данного атома (молекулы) больше, чем 1/12 массы атома изотопа углерода 12С; измеряется в атомных единицах массы а.е.м. Полезные формулы Связь между массой вещества m, количеством вещества ν и его молярной массой M:
Связь между объемом вещества V, количеством вещества ν и его молярным объемом VM:
Строение вещества Модели строения атома 1. Планетарная модель Резерфорда ¨ в центре атома находится положительно заряженное атомное ядро, занимающее ничтожно малую часть атомного пространства ¨ весь положительный заряд и основная масса атома сосредоточены в ядре ¨ вокруг атомного ядра по орбитам вращаютсяэлектроны; число электронов равно положительному заряду ядра. Атомное ядро – частица, состоящая из положительно заряженных протонов (p) и нейтральных элементарных частиц нейтронов (n); заряд ядра равен числу протонов. Электрон – элементарная частица, обладающая отрицательным зарядом и бесконечно малой массой. 2. Планетарная модель Бора-Зоммерфельда ¨ электрон может вращаться вокруг ядра только по строго определенным (стационарным) орбитам (орбиталям); набор таких орбиталей дискретен
¨ орбиты могут быть как сферические, так и эллипсоидные ¨ при движении по стационарным орбитам электрон не излучает и не поглощает энергии ¨ при переходе на более высоколежащую (более низколежащую) орбиталь электрон поглощает (излучает) энергию, равную энергии кванта света hν.
Электронное строение атома Электрон как трехмерная волна описывается четырьмя квантовыми числами:
1) номер энергетического уровня (в теории Бора – номер орбиты); 2) интервал энергий электронов, находящихся на этом уровне; чем больше n, тем больше запас энергии электрона в атоме 3) размеры атомных орбиталей (в теории Бора – радиусы орбит); 4) расстояние электрона от ядра; 5) число подуровней данного энергетического уровня; 6) в Периодической системе значению n соответствует номер периода;
Атомная орбиталь (АО) описывается двумя квантовыми числами – n и l, которые полностью определяют ее энергию. Набор АО с одинаковым значением n называется энергетический уровень (слой). Набор АО с одинаковыми значениями n и l называется энергетический подуровень.
Ø Принцип минимальной энергии Ø Принцип (запрет) Паули Ø Правило Хунда Ø Правило Клечковского
Химическая связь ü Механизмы образования химической связи 1. Ковалентная неполярная (образование обобществленной электронной пары за счет двух неспаренных электронов атомов одного и того же элемента или элементов с близкими значениями электроотрицательности H2 (H-:-H), O2 (O-::-O)) 2. Ковалентная полярная (образование обобществленной электронной пары за счет двух неспаренных электронов атомов различных элементов, общая электронная пара сдвинута к более электроотрицательному элементу H–:-Cl, Ba–::-O)
3. Ионная (предельный случай ковалентной полярной связи – общая электронная пара практически полностью сдвинута к более электроотрицательному элементу: Na—:Cl, Li—:F); реализуется только в твердых (кристаллеских) веществах 4. Донорно-акцепторная (образование обобществленной электронной пары за счет неподеленной электронной пары одного атома—донора, и вакантной электронной орбитали второго атома—акцептора NH4+ (NH3:®H+))
Электроотрицательность – относительная характеристика способности атомов притягивать общую электронную пару. Ион – заряженная частица, образованная путем присоединения или отщепления одного или нескольких электронов от нейтрального атома; катион – положительно заряженный ион, анион – отрицательно заряженный ион. Донор – атом или молекула, обладающие одной или несколькими валентными неподеленными электронными парами, способными к участию в химической связи. Акцептор – атом или молекула, обладающие одной или несколькими вакантными валентными орбиталями, способными к участию в химической связи.
ü Типы химической связи
Прочность связи в ряду σ-π-δ уменьшается, а значит в первую очередь между элементами образуется σ -связь, потом π -связь, и в заключении δ -связь.
Ø Кратность химической связи 1. Одинарная связь А-В – это всегда σ -связь. 2. Двойная связь А=В – это всегда 1 σ + 1 π -связи. 3. Тройная связь А≡В – это всегда 1 σ + 2 π -связи. 4. Четверная связь А ≡ В – это всегда 1 σ + 2 π + 1 δ -связи. Прочность связи с увеличением ее кратности возрастает, а длина связи уменьшается при прочих равных условиях.
Простые вещества Простые вещества – вещества, состоящие из атомов только одного элемента. Степень окисления элемента в простом веществе равна нулю. Металлы вещества, проявляющие металлические свойства (теплопроводность, электропроводность); металлы – в основном элементы I, II и III групп Периодической системы, элементы дополнительных подгрупп (d- элементы) Неметаллы вещества, в основном не проявляющие металлических свойств; неметаллы – элементы IV-VIII групп главных подгрупп Периодической системы Оксиды Оксиды – бинарные соединения, состоящие из атомов двух элементов, один из которых – кислород в степени окисления –2. 1. Основные 2. Кислотные 3. Амфотерные 4. Безразличные (несолеобразующие) Гидроксиды 1. Основания Основания – вещества, образованные катионом металла и одной или несколькими гидроксогруппами M(OH)x. ¨ Однокислотные: содержат одну гидроксогруппу – NaOH, LiOH ¨ Многокислотные: содержат несколько гидроксогрупп – Ca(OH)2, Al(OH)3
ü Сильные (щелочи): гидроксиды активных металлов (щелочных и щелочно-земельных) – LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2 хорошо растворимые в воде ü Слабые: все остальные гидроксиды (в том числе и амфотерные) – Zn(OH)2, Cu(OH)2; практически не растворяются в воде 2. Кислоты Кислоты – вещества, образованные одним или несколькими ионами водорода и анионом кислотного остатка (по Аррениусу). o бескислородные (к гидроксидам не относятся!) – HCl, H2S; o кислородсодержащие – HNO3, H2SO4.
¨ Одноосновные: содержат один протон – HCl, HNO3 ¨ Многоосновные: содержат несколько протонов – H2SO4, H3PO4 Протон – положительно заряженный ион водорода Н+.
ü Сильные: диссоциирующие на ионы в водном растворе практически нацело – HCl, HClO4, HBr. ü Слабые – слабо диссоциирующие в водном растворе – H2S, HCN, HF.
Соли Соли – вещества, образованные катионом металла и анионом кислотного остатка. 1. Средние 2. Основные
гидроксосульфат меди (II) 3. Кислые гидросульфат кальция 4. Двойные Смешанные вещества, образованные ионами двух разных кислотных остатков и одним ионом металла, существуют только в твердой фазе белильная известь: СaOCl2 или Ca(Cl)(OCl) 6. Комплексные K3[Fe(CN)6] [Ag(NH3)2]OH 7. Кристаллогидраты Вопросы и задачи К РАЗДЕЛУ. Термохимия. Законы и следствия 1. Закон Лавуазье-Лапласа 2.
Тепловой эффект химической реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от числа промежуточных стадий, т.е. от пути протекания процесса C(графит) + 1/2 O2 (г) = CO (г) D H ° 1 + CO(г) + 1/2 O2 (г) = CO2 (г) D H ° 2 3. Следствия из закона Гесса 2. Изменение стандартной энтальпии химической реакции равно разности сумм стандартных энтальпий образования продуктов и стандартных энтальпий образования исходных веществ (с учетом количеств реагирующих веществ, т.е. стехиометрических коэффициентов).
3. Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов, с учетом их стехиометрических коэффициентов.
Энтальпийные диаграммы. Циклы Борна-Габера Расчет энергии кристаллической решетки. Энергия кристаллической решетки – теплота, выделяющаяся при образовании решетки из газообразных ионов. Энтальпия образования кристаллической решетки – отрицательна (экзотермична), т.к. идет процесс образования химических связей. Кристаллическая решетка – это решетка, состоящая из упорядоченно расположенных ионов (атомов).
I 1 – первый потенциал ионизации натрия Потенциал ионизации – энергия, необходимая для отрыва одного электрона от нейтрального газообразного атома и удаления его на бесконечно большое расстояние А – энергия сродства к электрону хлора Сродство к электрону – энергия, выделяющаяся при присоединении одного электрона, находящегося на бесконечно большом расстоянии от атома, к нейтральному газообразному атому.
Вопросы и задачи к РАЗДЕЛУ Термохимия 1. Тепловой эффект химической реакции, знак теплового эффекта, причины возникновения теплового эффекта. 2. Основные законы термохимии (Закон Лавуазье–Лапласса, закон Гесса). 3. Термохимический цикл. Энергия кристаллической решетки. 4. Какие характеристики ионов определяют энергию ионной кристаллической решетки? 5. В чем различие теплового эффекта и энтальпийного эффекта химической реакции? Могут ли они быть равны друг другу? 6. Стандартное состояние вещества. 7. Энтальпия фазовых превращений (плавления, испарения, сублимации). 8. Энтальпия атомизации и средняя энергия связи в многоатомной молекуле. 9. В чем различие между истинной и средней энергиями связи A–B в молекуле ABx? 10. Может ли энтальпия атомизации вещества быть экзотермической? 11. Энергетика химических реакций в организме. Гликолиз – основные стадии с позиций термохимии. 12. Использование термохимии в практической медицине: термостатирование, глубокое охлаждение, химические грелки. 13. АТФ – как источник энергии для жизнедеятельности организма. 14. Можно ли рассчитать изменение энтальпии в ходе таких химических реакций и таких фазовых переходов, которые практически не осуществимы в данных условиях? 15. Процесс протекает по схеме : Справедливо ли для данного случая соотношение DH1=DH2=DH3? Можно ли эти значения энтальпий использовать для определения энергии связи A–B? 16. Напишите процессы образования 1 моля указанных веществ из простых веществ в стандартных состояниях (укажите эти состояния): a) NaCl, CO, V2O3, Na2SO4, HNO3, H3PO4; b) СuSO4·5H2O, Ca3(PO4)2, CaSiO3, (NH4)2CO3; c) KF, NO, P2O5, HClO3, H2SO4, K3AlF6; d) (NH4)2Cr2O7, KAl(SO4)2·12H2O, Mg(NO3)2, FeCl3. 17. Приведите примеры процессов атомизации элементов (простых веществ), гомоатомных молекул, бинарных соединений, кислород–содержащих кислот и их солей. 18. Пользуясь табличными данными для DH°f, рассчитайте изменения энтальпии в следующих реакциях: a) H2O(г) + Br2(г) ¾® HBr(г) + O2(г); b) NH3(г) + NO2(г) ¾® N2(г) + H2O(г); c) N2(г) + H2O(ж) + O2(г) ¾® HNO3(ж). 19. Вычислите DH°f подчеркнутых веществ по данным об энтальпиях реакций (DH°f остальных веществ возьмите из справочника): a) SiO2(кр) + CO(г) ¾® SiO (г) + CO2(г) DH° = +52,3 кДж/0,1 моль CO; b) BaO(кр) + O2(г) ¾® BaO 2(кр) DH° = –6,4 кДж/л O2. 20. Вычислите DH°f подчеркнутых веществ по данным об энтальпиях реакций (DH°f остальных веществ возьмите из справочника): a). SnCl4(г) + HCl(г) + NH3(г) ¾® (NH 4 ) 2 SnCl 6(кр) DH° = –23,4 кДж/0,1 моль HCl; b) NH3(г) + AlCl3(кр) ¾® AlN (кр) + HCl(г) DH° = +52,3 кДж/г AlN. 21. Определите DH° реакции COCl2(г) + 1/2O2(г) ¾® CO2(г) + Cl2(г) по следующим данным: COCl2(г) ¾® CO(г) + Cl2(г) DH° = +112,5 кДж CO2(г) ¾® CO(г) + 1/2O2(г) DH° = +282,8 кДж 22. Определите DH° реакции HNO2(г) + 1/2O2(г) ¾® HNO3(г) по следующим данным: 1/2N2O4(г) ¾® NO2(г) DH° = +28,5 кДж 2NO2(г) + H2O(г) ¾® HNO2(г) + HNO3(г) DH° = –39,3 кДж 4HNO3(г) ¾® 2N2O4(г) + O2(г) + 2H2O(г) DH° = +77,0 кДж. 23. Определите DH° превращения твердой серы в двухатомные газообразные молекулы по следующим данным: 2H2(г) + S2(г) ¾® 2H2S(г) DH° = –167,2 кДж 2H2(г) + S(кр) ¾® 2H2S(г) DH° = –20,4 кДж. 24. Определите DH° реакции: CH3OH(ж) + H2(г) ¾® CH4(г) + H2O(г) исходя из энтальпий сгорания, которые равны: CH3OH(г) –642,3 кДж CH4(г) –802,7 кДж H2(г) –242,0 кДж Как изменится найденная величина DH°, если образуется не газообразная, а жидкая вода (энтальпия испарения воды 44,0 кДж/Моль)? 25. Энтальпия сгорания газообразного бензола с образованием углекислого газа и жидкой воды равна –3301,5 кДж/Моль. Рассчитайте энтальпию образования бензола из простых веществ. 26. Энтальпия сгорания мочевины с образованием жидкой воды равна –635 кДж/Моль. Рассчитайте энтальпию образования мочевины из простых веществ. Химическая термодинамика 1. Типы систем: гетерогенная, гомогенная, закрытая, открытая, изолированная. 2. Живой организм – открытая система. Особенности процессов, происходящих в открытых системах. 3. Энтропия – мера неупорядоченности системы. Микро– и макросостояние. Факторы, влияющие на изменение энтропии. 4. Свободная энергия Гиббса, DG реакции. 5. Изменение энтропии и свободной энергии в химических процессах. Термодинамический критерий возможности протекания реакции. 6. В чем различие DG и DG°? 7. Вычислите DS° реакций по табличных данным: a) CO(г) + O2(г) ¾® CO2(г); b) SiCl4(г) + O2(г) ¾® SiO2(кр) + Cl2(г); c) Fe2O3(кр) + Al(кр)¾® Al2O3(кр) + Fe(кр); d) SiF4(г) + H2O(г) ¾® SiO2(кр) + HF(г); e) CaO(кр) + CO2(г) ¾® CaCO3(кр); f) CuO(кр) + H2(г) ¾® Cu(кр) + H2O(г); g) CH4(г) + Cl2(г) ¾® C(гр) + HCl(г); h) HCN(г) + O2(г) ¾® H2O(г) + CO2(г) + N2(г); i) TiCl4(г) + Mg(кр) ¾® Ti(кр) + MgCl2(кр); j) SnCl4(г) ¾® SnCl2(кр) + Cl2(г); k) SnO2(кр) ¾® SnO(кр) + O2(г); l) Fe(кр) + H2O(г) ¾® Fe3O4(кр) + H2(г). 8. Определите DS° реакции Cu2O(кр) ¾® Cu(кр) + CuO(кр) по следующим данным: CuO(кр) + H2(г) ¾® Cu(кр) + H2O(г) DS°= +48,8 Дж/К Cu2O(кр) + H2(г) ¾® 2Cu(кр) + H2O(г) DS°= +31,7 Дж/К. 9. Определите DS° реакции 2NO(г) + O2(г) ¾® N2O4(г) по следующим данным: N2O4(г) ¾® 2NO2(г) DS°= +176 Дж/К NO(г) + 1/2O2(г) ¾® NO2(г) DS°= – 73 Дж/К. 10. Одним из возможных метаболических превращений глюкозы является спиртовое брожение:
∆G0298 – 916,34 – 181,37 – 385,86 кДж/моль Вычислите величину изменения энтропии этого процесса при 250 К, имея в виду, что ∆Н0298 = –77,2 кДж/моль. 11. Простое тело элемента X реагирует с фтором, серой, кислородом, азотом, образуя соединения, в которых элемент X имеет одну и ту же степень окисления. Если исходные вещества находятся в стандартных условиях, а продукты реакций – кристаллические, то как соотносятся между собой энтропии этих реакций? Определите, для какой из них изменение энтропии наибольшее. Подтвердите правильность Ваших рассуждений каким-либо конкретным примером. Покажите, что изменится, если во всех случаях продукты реакций газообразны. 12. Вычислите DG°T реакций при 298 и 1000 К по табличным данным для DH°f и S°298. Оцените температуру, при которой DG0T = 0. a) Na(кр) + Cl2(г) ¾® NaCl(кр); b) MnO2(кр) + H2(г) ¾® Mn(кр) + H2O(г); c) NH4Cl(кр) ¾® NH3(г) + HCl(г). d) NO(г) + O2(г) ¾® NO2(г); e) Al(кр) + Fe2O3(кр) ¾® Fe(кр) + Al2O3(кр); f) H2O(г) + Cl2(г) ¾® HCl(г) + O2(г). 13. Не пользуясь табличными данными, определите знак DG° следующих реакций: a) KClO3(кр) ¾® KCl(кр) + O2(г) DH°<0 b) (NH4)2Cr2O7(кр) ¾® N2(г) + H2O(г) + Cr2O3(кр) DH°<0 c) Au(кр) + O2(г) ¾® Au2O3(кр) DH°>0 d) O2(г) + Cl2(г) ¾® Cl2O7(г) DH°>0 e) KBr(кр) + O2(г) ¾® KBrO(кр) DH°>0 f) CS2(г) + O2(г) ¾® CO2(г) + SO2(г) DH°<0 14. Для реакции A(г) + 2B2(г) ¾® AB4(г) при 1000 К DG° = 0. Оцените DH° реакции. 15. Для реакции АТФ + Н2О = АДФ + Н3РО4 при 310 К DG и DН равны соответственно –30,96 и –20,67 кДж/моль. Вычислите DG этой реакции при 277 К. 16. Установлено, что при гидролизе АТФ при 36°С и физиологических значениях рН величины DН и DG соответственно равны –20800 и –29200 Дж/моль. Вычислите изменение энтропии данного процесса. Каков смысл того, что изменение энтропии имеет положительное значение? Основы химической кинетики Основные понятия Скорость химической реакции (v) – число элементарных актов, происходящих в единице объема или на единице поверхности за единицу времени; в случае реальной химической системы скорость реакции удобнее определять как изменение концентрации реагирующих веществ (реагентов) или образующихся веществ (продуктов) в единицу времени. Концентрация – содержание растворенного вещества в единице объема. Природа вещества – геометрическое и электронное строение молекулы (типы атомов и связей между ними, размеры…). Гомогенная реакция – реакция, когда все реагирующие вещества находятся в одной фазе; гомогенная реакция протекает по всему объему химической системы. Гетерогенная реакция – реакция, когда реагирующие вещества находятся в разных фазах; гетерогенная реакция протекает только на границе раздела фаз. Механизм реакции – последовательность элементарных процессов превращения исходных веществ в продукты реакции. Элементарный процесс – химическая реакция, протекающая в одну стадию. Скоростьопределяющая (лимитирующая) стадия – самая медленная стадия механизма реакции. Кинетическое уравнение реакции – зависимость скорости реакции от концентраций (парциальных давлений) реагирующих веществ. Порядок реакции по веществу n (i) – экспериментально определяемое число: степень в которую возводится концентрация данного вещества в математическом выражении закона действующих масс; стехиометрические коэффициенты совпадают с порядками реакции только в случае одностадийного процесса. Суммарный порядок реакции n – сумма всех порядков реакции по веществам, участвующим в реакции. Константа скорости k –коэффициент пропорциональности в математическом выражении закона действующих масс; удельная скорость при единичных концентрациях веществ; константа скорости зависит только от природы реагирующих веществ и температуры и не зависит от концентраций, давления и объема. Температурный коэффициент реакции (g) – число, показывающее, во сколько раз возрастет скорость реакции при увеличении температуры на 10°. Катализатор – вещество, вызывающее изменение скорости химической реакции, но не входящие в стехиометрическое уравнение реакции; катализатор изменяет энергию активации реакции из-за разбиения пути реакции на стадии. Энергия активации Ea – энергетический барьер, который должны преодолеть исходные вещества для превращения в продукты реакции. Закон действующих масс Давление при увеличении давления для газофазных реакций происходит пропорциональное увеличение всех парциальных давлений; следовательно, скорость возрастает пропорционально изменению давления в степени суммарного порядка реакции: H2(г) + Br2(г) ® 2HBr При увеличении давления в 9 раз, парциальные давления водорода и брома увеличиваются в 9 раз, следовательно, скорость реакции увеличивается в 91·91/2 = 9·3=27 раз. Объем при изменении объема, давление в системе (или концентрации всех зообразных веществ) уменьшаются обратно пропорционально; следовательно уменьшение объема в n раз эквивалентно увеличению общего давления в n раз или возрастанию всех концентраций в n раз. Уравнение Аррениуса
Здесь А – предэкспоненциальный множитель, определяющий зависимость константы скорости от природы реагирующих веществ и от вероятности «удачных» столкновений, приводящих к элементарному акту реакции. Еа – энергия активации. Величина энергии активации может быть изменена с помощью катализатора. По характеру взаимодействий катализатора и химической системы различают гомогенный, гетерогенный и ферментативный катализ. Задачи к разделу. 1. Понятие о скорости химической реакции. 2. Какие из следующих факторов влияют на скорость химической реакции (дайте пояснения): a) природа реагирующих веществ; b) концентрация реагирующих веществ в растворе; c) объем раствора; d) природа растворителя; e) температура; f) присутствие катализатора. 3. Напишите выражение для скоростей реакций, протекающих по схеме A + B ¾® AB, если: a) A и B – газообразные вещества; b) A и B – жидкости, смешивающиеся в любых отношениях; c) A и B – вещества, находящиеся в растворе; d) A – твердое вещество, B – газ или вещество, находящееся в растворе. 4. От каких факторов зависит константа скорости химической реакции? Почему эту величину называют «константой»? 5. Какую размерность имеет константа скорости химической реакции? 6. Влияние температуры на скорость химической реакции. Правило Я.Г. Вант–Гоффа, температурный коэффициент. Уравнение Аррениуса. 7. Может ли температурный коэффициент скорости химической реакции быть отрицательным? 8. Энергия активации, кривая распределения молекул по энергиям. Энергетические схемы химических реакций. 9. Как различаются энергии активации прямой и обратной реакций? Должны ли они различаться по знаку? 10. Кинетическое уравнение химической реакции. Понятие о механизме химической реакции. Порядок и молекулярность химической реакции. 11. Отличаются ли порядок и молекулярность реакции? 12. Могут ли быть реакции нулевого порядка? 13. В чем отличие между общим порядком реакции и порядком по данному веществу? 14. Типы катализа (гомогенный, гетерогенный, ферментативный). Механизмы катализа. Примеры. 15. Какое общее представление лежит в основе объяснения действия катализатора в гомогенном и гетерогенном катализе? 16. Дайте определения следующих понятий: a) скорость химической реакции; b) кинетическое уравнение реакции;
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 96; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.73.35 (0.316 с.) |
|||||||||||||||||||||||||||||||||||||||
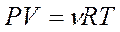
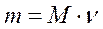 ,
, 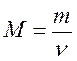 или
или 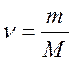
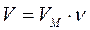 ,
, 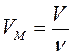 или
или 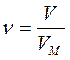



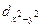 ,
, 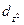 )
)


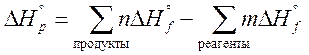
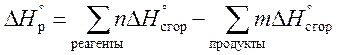

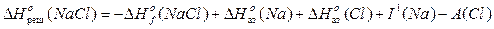
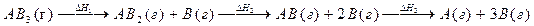

 Глюкоза 2C2H5OH(водн.) + 2СО2(г)
Глюкоза 2C2H5OH(водн.) + 2СО2(г)